吸血類動物組織蛋白質組學研究進展
張志林
(遼寧師范大學生命科學學院,遼寧 大連116081)
肖蓉,勾萌,李慶偉
(遼寧師范大學生命科學學院 遼寧省生物技術與分子藥物研發重點實驗室,遼寧 大連116081)
奇妙的自然界中生活著一群恐怖的 “吸血鬼”,有人們所熟悉的吸血動物,如按蚊、水蛭和血吸蟲等,也有令海洋中的 “吸血鬼”七鰓鰻。它們不僅依靠吸食動物和人類的血肉為生,而且還會傳播慢性或致命疾病,給社會經濟和人類健康帶來極大危害。隨著人類和多種模式生物全基因組測序和基因功能注釋的逐步完成,龐大的基因組信息被源源不斷地挖掘出來,人們逐漸找到了預防和診斷這些疾病的方法,也在吸血動物的唾液腺中找到了一些具有抗凝、鎮痛以及抗炎等功能的活性成分。但是單純基因組信息并不能完全解決相關疾病的困擾,因為基因只是遺傳信息的攜帶者,蛋白質才是機體生理功能的最終執行者和疾病發生的核心。與相對穩定的基因組不同,在內外環境的作用下,蛋白質組總是處于動態變化過程,所以研究全部蛋白質表達譜才能確切闡明細胞的生理功能狀態及疾病的病理演進過程。因此,對吸血動物蛋白質組學的深入研究將有助于了解吸血過程中相關蛋白質的變化情況,發掘功能蛋白,闡明疾病傳播的機制,為特異生物標志物和治療靶點的篩選和鑒定提供有效依據。綜述了吸血動物蛋白質組學的主要研究內容和手段,以及吸血過程中各組織蛋白質組的動態變化及其潛在的臨床應用意義。
1 吸血類動物蛋白質組學的主要研究范疇及手段
吸血類動物蛋白質組學的主要研究范疇包括3個方面:①功能蛋白質組學:主要是對吸血類動物唾液腺中的活性蛋白質組分進行鑒定并詳細闡述其主要功能;②差異蛋白質組學,即比較蛋白質組學:比較吸血類動物在生理和病理過程中蛋白質組的表達變化;③相互作用蛋白質組學:主要是研究蛋白質與蛋白質之間的相互作用,繪制某個體系的蛋白質間相互作用和聯系的網絡圖譜[1](圖1)。其中,差異蛋白質組學是研究吸血類動物蛋白質組學的重點。目前,蛋白質組學研究的主要手段有:以雙向凝膠電泳為核心的蛋白質組分分離技術和以質譜為代表的蛋白質組分鑒定技術,以及蛋白質組生物信息學等。
吸血動物從寄主血液中汲取營養并傳播疾病,它們的唾液腺、中腸、血液和排泄分泌物中可能含有一些致病分子,以及一些具有抗凝、鎮痛、免疫防御等功能的活性成分,作為其對抗天敵的重要武器。其中部分活性物質已經應用于臨床疾病的治療(如:水蛭素、吸血蝠唾液酶)[2]。
2 吸血類動物唾液腺蛋白質組學研究
吸血動物為了成功從宿主吸取血液需要克服一系列障礙:必須刺穿皮膚,快速完成吸血過程,逃避宿主的排斥反應以及抑制宿主的凝血、疼痛和炎癥反應等等。它們的唾液腺應含有一些具有抗凝等功能的活性成分,如血小板聚集抑制因子、抗凝因子、血管擴張因子等。這些活性成分將有助于保證吸血動物吸血過程的順利進行。
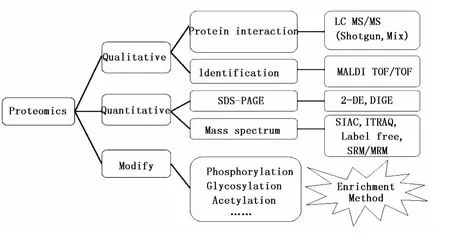
圖1 蛋白質組學的主要研究方法及技術路線
2.1 按蚊唾液腺蛋白質組學研究
唾液腺是按蚊的重要器官,不僅有助于消化攝入的糖分及血液,同時也能傳播疾病并引起局部的變態反應。2012年Narissara等人通過SDS-PAGE電泳分析發現:按蚊(Anopheles barbirostris)在叮咬期間、吸血中,以及吸血后,其唾液腺蛋白質組分的表達水平發生下調,甚至消失[3]。這些表達水平發生改變的蛋白質組分包括:組胺結合蛋白(Long for m D7),血管舒張劑(Peroxidase),凝血酶抑制劑(Serpin protease inhibitor)、抗血小板凝集因子(Anopheline antiplatelet pr otein)、免疫調節劑(Adenosine deaminase)等。這些活性組分可通過吸血過程流入到宿主體內從而抑制宿主的凝血及炎癥反應等,并傳播病原體。2012年,WASS等對按蚊唾液腺的抽提物進行了胰蛋白酶酶解[4],然后采用基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS)對其肽段進行了鑒定。序列分析結果表明按蚊唾液腺除了含有能夠抑制宿主凝血過程所需的活性蛋白質或多肽,如抗凝血(Ser pin超家族蛋白)、抗血小板聚集(Apyrase)和血管舒張因子(Tyrosinase)等生物活性成分,還含有抑制宿主免疫防御的蛋白質,如腺苷脫氨酶(Adenosine deaminase,ADA)等。它能夠通過水解腺苷為次黃苷從而抑制炎性細胞因子的產生,最終起到免疫逃逸的作用。然而,由于按蚊唾液腺蛋白質含量較低,目前的研究多集中于與吸血相關的蛋白質的生物功能上[5]。
2.2 水蛭唾液腺蛋白質組學研究
水蛭具有多種藥理活性,其應用前景非常廣闊。2004年,Baskova等首先運用蛋白質組學技術對歐洲醫蛭(Hir udo medicinalis)唾液腺分泌物進行了分析鑒定[6]。研究發現歐洲醫蛭唾液腺分泌物中共含有100多種蛋白質,通過質譜鑒定和生物信息學分析發現水蛭唾液腺分泌物中除了含有熟知的水蛭素(Hirudin)以外,還含有多種生物活性成分:如類胰蛋白酶抑制劑(Tryptase inhibitor)、胰蛋白酶抑制劑(Trasylol)、乳清酸(Saratin)、溶菌酶(Destabilase-lysozy me)、透明質酸酶(Hyal uronidase)、膠原誘導型血小板聚集抑制劑(Calin)、谷酰基轉肽酶(γ-Glutamyl transpeptidase)、凝血因子Xa抑制劑(Antistasin)、血小板糖蛋白拮抗劑(Decorsin)以及能夠降解血栓(富含血小板)的蛋白(Hementin)等[7]。2007年,Baskova等利用雙向電泳和質譜技術對不同季節不同月份的歐洲醫蛭唾液腺分泌物進行了分析和鑒定[8]。研究發現,歐洲醫蛭唾液腺組分中抗凝血酶活性隨季節發生改變,冬季活性最強,且水蛭素只有在冬季才能被檢測出來。2012年,Abbas等對不同月份的馬來西亞水蛭(Hir udinaria Manillensis)進行了蛋白質組學比較分析[9]。研究發現:在5月,馬來西亞水蛭唾液腺的抗凝血酶活性最強,最弱是在11月至1月。因此,作者認為:①不同種屬水蛭唾液腺組分不同并且會隨著外界環境、時間的變化而發生變化;②水蛭體內能產生抗凝活性成分以幫助水蛭吸取寄主血液并儲存在體內,且不會發生凝血反應。除此之外,在水蛭的蛋白質組學研究過程中,還有很多低分子量多肽組分尚未被分離和鑒定,亟待進一步的分析與研究。采用蛋白質組學技術手段深入研究水蛭唾液腺的蛋白質組分可為闡明水蛭的藥理學活性和作用機制奠定基礎,具有較好的市場開發應用前景。
2.3 蜱類唾液腺蛋白質組學研究
唾液腺是蜱類體內最大的器官,能夠維持體內離子、水分平衡,抑制寄主的凝血反應,并傳播各類疾病。有文獻報道,蜱類唾液腺組分中含有大量的抗凝血分子(Tcik anticoagulant peptide)、抗血小板聚集分子(Triplatin)、層粘連蛋白(Laminin)、蛋白酶抑制劑(Serpin protease inhibitor)[10]、蛋白酶(Aminopeptidase、Car boxylesterase、Adipose triacyl glyceride lipase、Super oxide dismutase),以及免疫調節分子(Thioredoxin)和神經麻痹毒素(HT-1、HT-2、HT-3)[11]。因此,深入研究蜱類唾液腺蛋白質組成員可為探索蜱類相關傳染病的傳播機制和尋找新型生物制劑提供重要的理論基礎。2005年,Lu等采用生物化學和蛋白質組學等多學科交叉的前沿方法,對不同發育期的長角血蜱(Haemaphysalis l ongicor nis)唾液腺蛋白質含量與成分的動態變化進行了比較分析[12]。研究發現雌性長角血蜱唾液腺在饑餓期蛋白質含量最低,吸血初期含量明顯升高,到交配期達到最大值,飽血后蛋白質含量開始下降,到飽血后第4天急劇下降至原始水平。這一變化趨勢與雌蜱的附著、吸血、交配和飽血等寄生期的特點相一致。此外,經過多次重復實驗Lu等發現凝膠上有6個蛋白點在不同發育時期表達模式不同,可以分為兩類:第一類蛋白質表現為在饑餓期和吸血期不存在,在交配期開始出現,在飽血期當天表達量增至最大。第二類蛋白質表現為在饑餓期存在,在吸血期表達水平發生上調,在交配期表達量增至最大,飽血期含量開始下降。質譜鑒定結果顯示第一類蛋白質為:熱激基因轉錄調控因子(COG1420)、琥珀酰-輔酶A合成酶β亞基和一種與產熱有關的蛋白質(CG17514,is form A);第二類蛋白質為:絲氨酸蛋白激酶(Serine protein kinase)、免疫球蛋白(Similar to Drosophila melanogaster PebⅢ)和依賴DNA的RNA聚合酶Ⅱ亞基[13]。后續功能實驗結果表明所有這些蛋白質表達水平的變化都與蜱類吸血過程密切相關[14]。然而不足的是所鑒定的差異蛋白點只是少數含量相對豐富的蛋白質。因此,還迫切需要鑒定蜱類唾液腺中的低豐度蛋白質以進一步闡明蜱類吸血及傳播疾病的分子機制。
3 吸血動物中腸蛋白質組學研究
3.1 按蚊中腸蛋白質組學研究
攜帶有瘧原蟲的蚊子在吸食人血的過程中會傳播瘧疾。瘧原蟲在侵染按蚊時,其雄性和雌性的配子細胞會在按蚊的中腸內完成受精過程并形成合子。因此,1998年Prevot等在研究瘧原蟲侵染按蚊機制的時候,把中腸作為重點研究對象,對瘧原蟲侵染不同品系的按蚊中腸做了蛋白質組學分析[15],試圖在其中腸中篩選參與調控瘧原蟲卵囊黑化作用的關鍵蛋白質。研究結果表明,按蚊在被瘧原蟲感染之前,其瘧原蟲易感品系和抗性品系中腸組織的雙向電泳圖譜差異較小;但是,按蚊在被瘧原蟲感染之后第3天,其瘧原蟲抗性品系中腸的雙向電泳圖譜出現了一條分子量約為67k Da的蛋白條帶,且該蛋白質濃度隨著感染時間的延長而增加,而其易感品系的雙向電泳圖譜卻沒有發生明顯變化。質譜鑒定此蛋白質為前酚氧化酶(Prophenoloxidase,PPO)[16],能夠通過介導卵囊黑化包裹反應從而激活按蚊的先天性免疫防御系統。2000年,Chun等采用冷激或注射等手段刺激瘧原蟲易感和抗性品系的按蚊,并對其中腸雙向電泳圖譜中發生差異表達的蛋白點進行鑒定,發現刺激后按蚊絲氨酸蛋白酶(AgSpl4D1)的表達水平發生上調[17]。序列分析結果表明該蛋白質與果蠅的脂酶和煙青蟲的酚氧化酶極為相似。后續功能實驗結果證實AgSpl4D1能夠通過誘導按蚊體液分泌黑色素,并協同具有細胞毒性的醌類中間產物沉積到入侵的病原體周圍,從而起到隔離殺死病原體的作用[18]。此外,Prevot等研究發現雌按蚊和雄按蚊在添食糖水后,其中腸雙向電泳圖譜差異很小;而在添食血液后,雌按蚊中腸雙向電泳圖譜比雄按蚊多出8個特異性蛋白點。質譜鑒定結果顯示這8個特異性蛋白點能夠參與雌按蚊的吸血、免疫防御和炎癥反應,并在繁殖等生理過程中發揮重要作用[19]。目前,已有研究團隊陸續采用蛋白質組學手段從瘧疾傳播媒介-按蚊體內大規模高通量篩選出與瘧疾傳播相關的特異性抗原成分,隨后利用分子及免疫技術制備降低蚊蟲生存力和生育力的疫苗,從而達到阻斷蚊蟲傳播疾病的目的。
3.2 扇頭牛蜱中腸蛋白質組學研究
蜱類疫苗被認為是控制蜱類吸血和相關疾病傳播最為有效的方法。目前市面上商業化的疫苗僅有兩種,主要成分是蜱類中腸膜的重組蛋白(Tick Gard和Grave)。蜱類中腸不僅能快速消化血液,還具有極強的抗病能力。因此,對蜱類中腸蛋白質組學的深入研究能夠為疫苗的開發提供更為重要的理論依據。2009年Kritaya等對扇頭牛蜱(Rhipicephal us sanguineus) 的 中腸進行了蛋白質組學研究,共發現134種蛋白質,并按生物學功能對其進行了分類(圖 2)[20]。此外,在吸血過程中其中腸雙向電泳圖譜含有15個分子量相同、p H值不同的蛋白質。Kritaya認為這15個蛋白質為同種蛋白質的不同亞型。質譜鑒定和后續功能實驗結果表明這15個蛋白質與能量代謝和蛋白質的折疊戚戚相關。它們分別是3種乙醛脫氫酶(Aldehyde dehydrogenase)、3種蛋白質二硫鍵異構酶(Pr otein disulfide iso merase)、3種泛醌-細胞色素 C(ubiquinol-cytochro me c)、2種 ATP5 A1綜合酶(ATP synthase H+transporting atp5 A1)、2種內質網駐留蛋白(Endoplasmic reticulu m resident protein 29-like),以及3種細胞膜孔蛋白(Porin)[21]。這些蛋白質被認為是蜱類疫苗的潛在作用靶點,可利用RNA干擾等技術控制蜱類食物消化和病原體繁殖等生命過程。

圖2 扇頭牛蜱中腸功能蛋白質分析
4 吸血動物血液蛋白質組學研究
血液中富含多種蛋白質組分。在某些病理狀態下,機體會分泌一些關鍵調節蛋白質或應激蛋白質到血液中,最終導致血液中總蛋白質成分發生質或量的變化。因此,比較分析正常與異常狀態下血液的蛋白質表達圖譜,尋找發生差異表達的蛋白點并進行結構和功能鑒定,最終獲得相應的生物標志物和(或)藥物作用靶點,已成為疾病監測、新藥開發、藥理毒理學研究的重要手段。
按蚊血液中富含的血淋巴就是其重要的非特異性免疫器官,對多種病原物具有很強的抵抗能力。為了從中找到一些具有廣譜抗菌或抗病毒等活性的成分,2005年Paskewitz等人利用雙向電泳、基質輔助激光解吸電離飛行時間質譜(MALDI-TOF-MS)的方法對瘧原蟲侵染前后的按蚊血液進行了蛋白質組學的研究[22]。研究發現,按蚊血液的雙向電泳圖譜約含有280個蛋白點,對其中豐度較高的28個蛋白點進行了分析鑒定,共獲得了26個不同的蛋白質的序列。分析結果表明這些蛋白質主要參與按蚊的免疫調節反應、離子轉運和脂類的生理代謝等活動。按蚊在感染細菌后,其血液中的酚氧化酶和兩個類幾丁質酶的表達水平明顯發生上調。后續功能實驗結果表明該蛋白酶主要通過參與黑化包裹瘧原蟲的過程從而起到抵抗病原物的作用。此外,血液中轉鐵蛋白等的表達水平則發生明顯的下調,推測與按蚊體內鐵穩態的調節密切相關[23]。由于血清中富含多種蛋白質組分,因此,若在復雜的血清組分中發現針對相關疾病的靶標分子,可對疾病的診治起事半功倍的效果。2010年Shen等利用蛋白質組學方法從日本血吸蟲成蟲血清內篩選出4種蛋白質:亮氨酸氨基肽酶(Sj LAP)、果糖二磷酸醛縮酶(Sj FBPA)、26 k Da谷胱甘肽轉移酶(Sj GST)和22.6 k Da血吸蟲表膜主要蛋白(Sj22.6)。其中,Sj LAP和Sj FBPA可作為指示工具去診斷慢性血吸蟲病。2011年Chaerkady等研究發現,按蚊受到機械性傷害后,一些不含信號肽的代謝相關酶類(淀粉酶、水解酶、脂酶、胰蛋白酶)會發生上調反應[24]。因此,采用蛋白質組學研究手段可于短時間內從整體水平獲得大量表達水平發生改變的蛋白質,為今后研究微生物感染按蚊的機制提供了良好的參考。
5 吸血動物排泄分泌物蛋白質組學研究
吸血動物在寄生過程中通常會向宿主體內排泄、分泌一些能夠干擾宿主免疫反應過程的活性分子,從而使其可以逃脫宿主的免疫攻擊。因此,開展對吸血動物排泄分泌物蛋白質組學的研究,將有助于了解免疫逃避分子機制,研制新的預防疫苗和新的診斷方法。
血吸蟲在終末宿主體內完成其生活史的過程中,可通過其體表、腸上皮表面或者是其它器官釋放分泌物,以免疫模擬方式來干擾宿主免疫系統的攻擊。血吸蟲寄生于人畜體內會嚴重危害人畜健康,而目前市面上可治療的藥物只有吡喹酮(Praziquantel),但該藥物對重復感染束手無策,亟需改善。采用蛋白質組學技術高通量篩選并鑒定血吸蟲排泄分泌物中的蛋白質組分不僅有助于揭示血吸蟲調節宿主免疫應答反應、建立慢性感染的機制,還為篩選抗血吸蟲感染的疫苗候選分子,藥物靶標和診斷抗原提供理論依據。到目前為止,已有大量文獻報道日本血吸蟲(Schistosoma j aponicu m)各個發育時期排泄分泌物蛋白質組學的研究。2004年,Cur wen等對曼氏血吸蟲(Schistosoma mansoni)的尾蚴、童蟲、成蟲、未成熟卵,以及成熟卵進行了可溶性蛋白質組學分析,并成功鑒定出84種蛋白質。這些蛋白質主要在細胞運動,蛋白折疊、修飾和合成,核酸合成,信號轉導、肌肉發育,以及電子傳遞等方面發揮重要作用。差異蛋白質組學分析結果顯示各蟲體階段共同表達的蛋白質比發生差異表達的蛋白質含量高。這些高豐度的蛋白質分別是谷胱甘肽轉移酶、脂肪酸結合蛋白,以及腺苷酸激酶。它們在血吸蟲的傳播及發育過程中發揮重要作用。2009年Feng等人采用蛋白質組學手段研究發現日本血吸蟲尾蚴的排泄分泌物中含有Actin等結構肌動蛋白、甘油醛-3-磷酸脫氫酶等能量代謝相關酶類、14-3-3蛋白等信號傳導通路相關分子、HSP70家族等相關熱休克蛋白,以及20s蛋白酶體等五類功能蛋白[25]。序列分析和后續試驗證明這些成分有利于尾蚴以皮膚滲透方式入侵宿主,并逃避其體內的免疫反應。在血吸蟲童蟲時期,排泄分泌物中的組分則主要參與機體細胞代謝、應激反應,以及生長發育等過程[26]。2009年Liu等在日本血吸蟲成蟲的排泄分泌物中鑒定出大量的脂肪酸結合蛋白(Fatty acid binding protein)和少量的熱休克蛋白(HSP70、HSP90、HSP97)、肌動蛋白、微管蛋白、氨肽酶(Aminopeptidase)、烯醇化酶(Enolase)以及甘油醛-3-磷酸脫氫酶等。后續分析結果表明這些蛋白質在調節宿主免疫反應中發揮著重要作用[27]。此外,2009年Steinfel der等還在日本血吸蟲蟲卵的排泄分泌物中發現了高豐度的、能特異性引起Th2細胞極化的糖蛋白(Omega-1)。除此之外,抗菌蛋白(CAP18)、硫氧還蛋白過氧化物酶(Thioredoxin per oxidase),分子伴侶(Heat Shock Pr oteins)和信號通路相關蛋白(14-3-3蛋白、GTP-結合蛋白、肌鈣網蛋白)等也同時被鑒定出來[28]。這些結果為進一步闡明血吸蟲的致病機制提供了重要的信息,為下一步阻斷或抑制血吸蟲的發育傳播以及緩解病情奠定了堅實的理論基礎。
6 吸血動物口腔腺蛋白質組學研究
七鰓鰻(La mpetr a j aponica)是迄今所知的最原始的無頜類脊椎動物,是研究適應性免疫系統起源與進化,系統發育的優良動物模型。此外,七鰓鰻還具有非常特殊的半寄生生活方式,即依靠吸食宿主魚體的血肉為生。Li等人根據已構建好的七鰓鰻口腔腺c DNA文庫成功克隆出七鰓鰻吸血過程中的重要功能基因[29],如富含半胱氨酸分泌蛋白(Cysetine rich secretory protein)、具有纖維蛋白原水解酶活性的BGSP-1(Buccal gland secretion pr otein-1)、Per oxiredoxin(Pr x),含有精氨酸-甘氨酸-天冬氨酸的短肽序列(Arg-Gly-Asp,RGD)等[30]。然而目前國內外尚無關于七鰓鰻蛋白質組學的研究工作。本課題組擬率先采用蛋白質組學技術手段分析七鰓鰻的口腔腺、血清、髓樣,以及肝臟等組織。大規模、高通量的篩選鑒定一些與其組織器官的系統發育,適應性免疫系統起源,以及與抗凝、抗炎和鎮痛等功能相關的關鍵蛋白質,這將為海洋生物資源的保護與開發以及新型藥物的研制帶來極大的推動作用。
7 展望
隨著人類基因組計劃(Hu man Geno me Project)的完成,生命科學研究已進入后基因組時代,其標志之一就是蛋白質組學(Proteomics)的興起。蛋白質組學作為重要的實驗技術,已經成為人們篩選重大疾病的特異生物標志物和研究發病機理的新途徑。對吸血動物的唾液腺、中腸、血液、排泄分泌物,以及口腔腺等組織進行蛋白質組學研究不僅有助于尋找和篩選具有特殊功能的生物活性分子,還為闡明某些因寄生行為而引起的疾病的致病機制奠定良好的理論基礎。這可為今后應用于寄生動物引起的疾病的預防、早期診斷、臨床治療和疫苗研發等方面提供有利的數據支撐。
雖然運用蛋白質組學技術,研究人員已從吸血動物的唾液腺、中腸、血液、排泄分泌物,以及口腔腺等組織中發現了大量的生物活性成分以及一些引起疾病的關鍵分子,但是還有很多低豐度的功能蛋白質仍未被鑒定出來。發展高通量、高靈敏度、高準確性的研究技術平臺仍是今后相當一段時間內蛋白質組學研究中的主要任務。相信隨著蛋白質組學技術的不斷發展,國際間的學術合作及資源交流的不斷加強,全球共享數據庫系統的不斷完善,越來越多的低豐度重要功能分子將被挖掘出來,為人類健康提供更有價值的理論參考。
[1]Zhang A,Sun H,Wang P,et al.Salivary proteomics in biomedical research [J].Clin Chi m Acta,2013,415:261-265.
[2]Ohtsuki S.Novel approach for biochemistr y by quantitative tar geted proteo mics:new protein quantification met hod wit hout using antibodies [J].Seikagaku,2012,84(11):911-919.
[3]Narissara J,Sittir uk R,Atchara P,et al.Proteo mic analysis of salivary glands of female Anopheles bar bir ostris species A2(Diptera:Culicidae)by two-di mensional gel electrophoresis and mass spectr o metry [J].Parasitol Res,2012,111:1239-1249.
[4]Wass MN,Stan way R,Blagbor ough A M,et al.Proteo mic analysis of Plas modiu m in the mosquito:progress and pitfalls [J].Parasit ology,2012,43:1131-1145.
[5]Kalu me DE,Okulate M,Zhong J,et al.A proteomic analysis of salivary glands of female Anopheles gambiae mosquito [J].Proteo mics,2005,5(14):3765-3777.
[6]Baskova IP,Zavalova LL,Basanova AV,et al.Pr otein Profiling of the Medicinal Leech Salivar y Gland Secretion by Pr oteo mic Analytical Methods[J].Biochemistry(Moscow),2004,27:945-951.
[7]Baskova IP,Kostrjukova ES,Valsova MA,et al.Pr oteins and Peptides of the Salivar y Gland Secretion of Medicinal Leeches Hir udo ver bena,H.medicinalis,and H.orientalis[J].Biochemistr y(Mosco w),2008,38:388-394.
[8]Baskova IP,Zavalova LL,Kostrjukova ES,et al.Proteomic Analysis Methods for Characterization of Proteins from the Salivary Gland Secretions of the Medicinal Leech during Different Seasons [J].Bioche mistry(Moscow),2007,35:219-225
[9]Abbas G,Abdualrah man A,Ah med M,et al.Season Variation and Starvation Period Influence on the Antithrombotic Activity of Leech Saliva Extract Fr o m the Medicinal Malaysian Leech Hir udinaria Manillensis [J].Bioequivalenc &Bioavailability,2012(Sup):14-23.
[10]Daniel E,Sonenshine DE,Bissinger BW,et al.First Transcripto me of the Testis-Vas Deferens-Male Accessory Gland and Pr oteo me of the Sper matophore fr o m Der macentor variabilis(Acari:Ixodidae)[J].PLo S One,2011,6(9):e24711.
[11]Tucker A M,Driskell LO,Pannell LK,et al.Differential Pr oteo mic Analysis of Rickettsia prowazekii Pr opagated in Diverse Host Backgr ounds [J].Applied and Envir on mental Micr obiology,2011,86:4712-4718.
[12]Lu X,Che Q,Lv Y,et al.A novel defensin-like peptide from salivary glands of the hard tick,Haemaphysalis longicornis [J] .Protein Sci,2010,19(3):392-397.
[13]Hajem N,Weintraub A,Ni mtz M,et al.A study of the antigenicity of Rickettsia helvetica proteins using two-di mensional gel electrophoresis[J].APMIS,2009,117(4):253-262.
[14]Jindrich C,Eric C,Joao HF,et al.Tick salivary secretion as a source of antihe mostatics [J].Jour nal of pr oteo mic,2012,75:3842-3854.
[15]Prévot GI,Laurent-Winter C,Feld mann A M,et al.Two-di mensional gel analysis of midgut proteins of Anopheles stephensi lines with different susceptibility to Plasmodiu m falciparu m infection [J].Insect molecular biology,1998,7(4):375-383.
[16]Qiu ZW,Zhang XL,Xu WY.Changes of prophenoloxidase in the midguts of Anopheles stephensi and Anopheles dirus bef ore and after infection with plas modiu m yoelii[J] .Acta academiae medicinae militaris tertiae,2004,26(6):490-493.
[17]Chun J,Mc Master J,Han Y,et al.Two-di mensional gel analysis of haemoly mph pr oteins fro m Plas modiu m-melanizing and non-melanizing strains of Anopheles gambiae [J].Insect Mol Biol,2000,9(1):39-45.
[18]PeiZhi H,Kai W,Hong Xia M,et al.Application prospect of anticoagulant substances fro m mosquit oes on phar macology [J].Chinese Veterinar y Science,2009,39(9):839-842.
[19]Prévot GI,Laurent-Winter C,Rodhain F,et al.Sex-specific and blood meal-induced pr oteins of Anopheles gambiae midguts:analysis by two-di mensional gel electr ophoresis [J].Malaria Jour nal,2003,11:2-11.
[20]Kongsu wan K,Josh P,Zhu Y,et al.Exploring the midgut proteo me of partially fed female cattle tick(Rhipicephalus(Boophilus)micr oplus)[J].Jour nal of Insect Physiology,2010,56(2):212-226.
[21]Villar M,Popara M,Bonzón-Kulichenko E,et al.Characterization of the tick-pat hogen interface by quantitative pr o teo mics [J].Ticks and Tick-bor ne Diseases,2012,3(3):154-158.
[22]Paskewitz S,Dickinson K.Willingness to pay for mosquito control:how i mportant is West Nile vir us risk co mpared to the nuisance of mosquitoes?[J].Vector Bor ne Zoonotic Dis,2012,12(10):886-892.
[23]Paskewitz SM,Shi L.The he moly mph proteo me of Anopheles ga mbiae [J].Insect Bioche m Mol Biol,2005,35(8):815-824.
[24]Chaer kady R,Kel kar DS,Mut husamy B,et al.A pr oteogeno mic analysis of Anopheles gambiae using high-resolution Fourier transf or m mass spectr o metr y [J] .Geno me Res,2011,21(11):1872-1881.
[25]Liu F,Cui SJ,Hu W,et al.Excretory/Secretor y Proteo me of the Adult Develop mental Stage of Hu man Blood Fluke,Schistoso ma japonicu m [J] .Molecular &Cell ular Pr oteo mics,2009,8(6):1236-1251.
[26]Verjovski-Al meida S,De Marco R.Current develop ments on Schistoso ma proteo mics [J].Acta Tr op,2008,108(2/3):183-185.
[27]Liu F,Lu J,Hu W,et al.New perspectives on host-parasite inter play by co mparative transcripto mic and pr oteo mic analyses of Schist oso ma japonicu m [J].Plos Pat hog,2006,2(4):29.
[28]Steinfelder S,Andersen JF,Cannons JL,et al.The major co mponent in schistoso me eggs responsible for conditioning dendritic cells for Th2 polarization is a T2 ribonuclease(o mega-1)[J].J Exp Med,2009,206(8):1681-1690.
[29]Rong X,Pang Y,Li QW.The buccal gland of Lampetra japonica is a source of diverse bioactive pr oteins [J] .Biochi mie,2012,94(5):1075-1079.
[30]Wang J,Han X,Yang H,et al.A novel RGD-toxin pr otein,Lj-RGD3,from the buccal gland secretion of La mpetra japonica impacts diverse biological activities [J].Biochi mie,2010,92(17):1387-1396.

