Survivin和Bax蛋白在食管鱗癌組織中的表達及臨床意義
吳小源,胡曉娜,賀春語,楊原源,郝大選,李 雪,王建華
(1.鄭州大學附屬腫瘤醫院 放療科 河南鄭州 450008;2.河南省中醫學院三附院 醫學影像科 河南鄭州 450008)
細胞凋亡是由Caspase半胱氨酸蛋白酶家族引發的級聯反應的細胞自我破壞的程序性生化過程,對維持組織的正常形態結構和機體內環境穩定具有重要的作用,細胞凋亡出現異常最終會導致腫瘤的發生。Survivin和Bax是重要的細胞凋亡調控基因,與腫瘤的發生發展密切相關[1-2]。本研究通過免疫組織化學(SP)法檢測Survivin和Bax蛋白在食管鱗癌組織中的表達,旨在探討其與臨床病理特征及預后的關系。
1 材料與方法
1.1 研究對象 收集河南省腫瘤醫院2007年10月至2009年8月臨床資料完整的食管鱗狀細胞癌(ESCC)病例58例,被檢測的腫瘤標本均為石蠟包埋組織,其中手術標本50例,胃鏡活檢病理組織8例。男37例,女21例;年齡38~80歲,中位年齡63歲;高、中、低分別為19例、25例、14例;采用2009年AJCC食管癌分期標準進行分期,Ⅰ期6例,Ⅱ期37例,Ⅲ期15例;淋巴結轉移24例,無淋巴結轉移34例。所有患者均為初治,胃鏡檢查或手術前均未行放、化療。
1.2 研究方法 所有標本均經10%甲醛固定,石蠟包埋,制成3 μm厚的切片,采用免疫組化SP法進行Survivin、Bax染色。Survivin兔抗人多克隆抗體、Bax鼠抗人單克隆抗體及免疫組化通用試劑盒均購自福州邁新公司。免疫組化染色按SP試劑盒操作說明進行,以微波修復法進行抗原修復,工作液濃度均為1∶150。
1.3 評定標準 Survivin和Bax陽性表達產物呈棕黃色細顆粒狀,主要定位在細胞質。染色表達情況采用半定量法推算,按以下比例計分:腫瘤細胞染色陽性率為0%~4%計0分,5%~24%計1分,25%~49%計2分,50%~74%計3分,75%~100%計4分,染色強度用0(陰性)、1(弱陽性)和2(強陽性)來表示。各指標的表達水平用腫瘤細胞染色陽性率與染色強度評分的乘積表示,具體結果統計按 Krajewska等[3]推薦的方法進行。
1.4 統計學處理 應用SPSS 17.0統計軟件進行統計分析,不同臨床病理特征間同一指標比較采用χ2檢驗,各指標相關性采用Spearman等級相關分析;繪制Kaplan-Meier生存曲線,生存差異采用log-rank方法進行比較,以P<0.05為差異有統計學意義。
2 結果
2.1 Survivin、Bax蛋白在食管鱗癌組織中的表達及其與臨床病理特征的關系 Survivin和Bax蛋白陽性表達產物呈棕黃色顆粒位于食管鱗癌細胞質和細胞核中,以細胞質為主,其陽性表達率分別為77.6%(45/58)和43.1%(25/58)。Survivin蛋白在高、中、低分化食管鱗癌組織中的陽性表達率分別為63.2%、76.0%和100.0%,差異有統計學意義(P=0.042),而與性別、年齡、浸潤深度、淋巴結轉移和臨床分期無關(P>0.05)。Bax蛋白的表達與性別、年齡、浸潤深度、淋巴結轉移、臨床分期及分化程度均無關(P>0.05)。見表1。
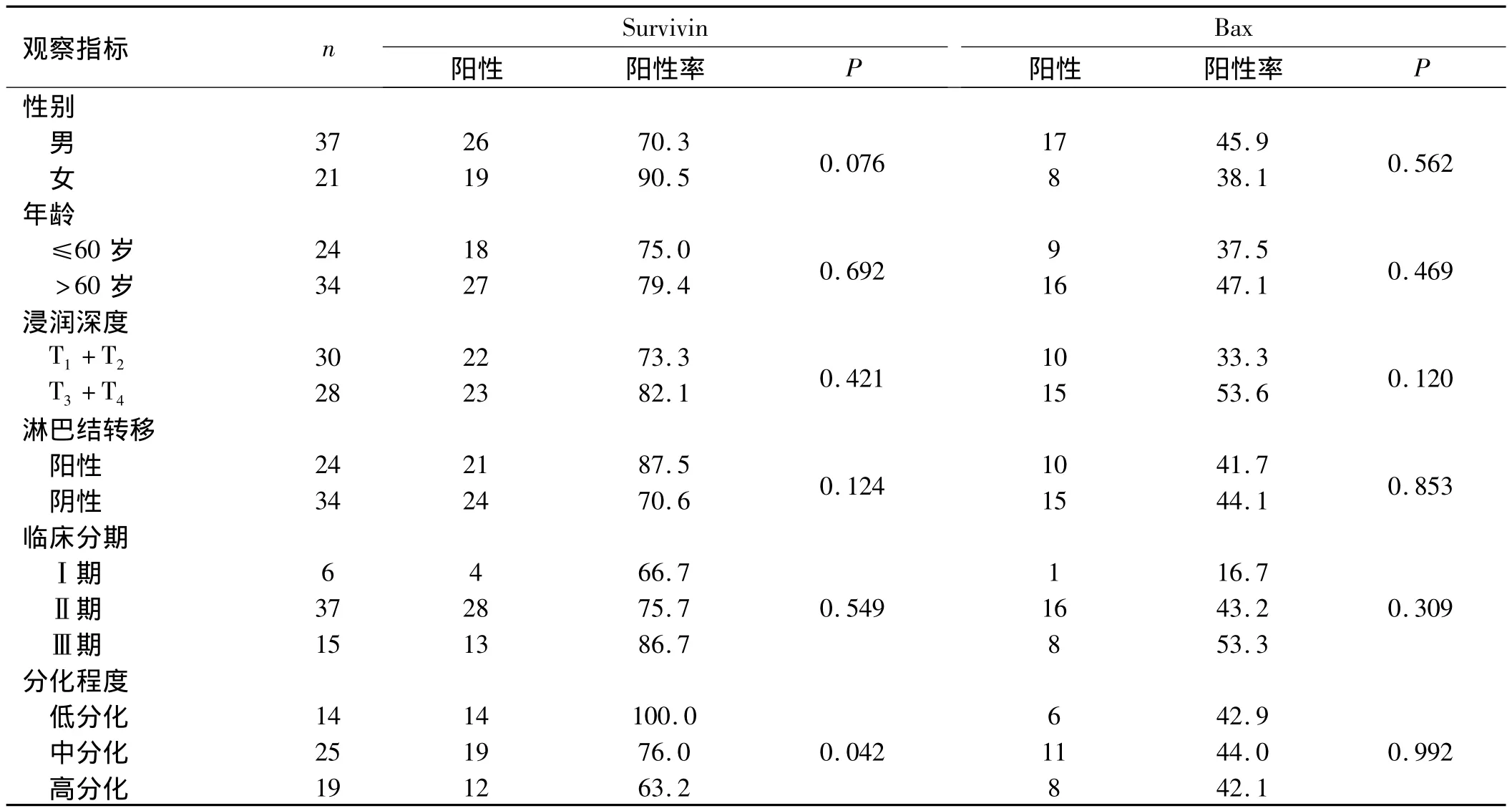
表1 Survivin和Bax蛋白的表達與臨床病理特征的關系(n,%)
2.2 Survivin、Bax蛋白在食管鱗癌組織中表達的相關性 采用Spearman等級相關分析評價Survivin和Bax蛋白在食管鱗癌組織中表達的相關性,結果顯示Survivin和Bax蛋白的表達無相關性(r=0.134,P=0.316),見表2。

表2 Survivin和Bax蛋白表達的相關性(n)
2.3 Survivin、Bax蛋白對食管鱗癌預后的影響 全組58例食管鱗癌患者均完成隨訪,末次隨訪時間為2014年8月31日。全組1、3、5年生存率為93.1%、46.6%和27.5%,中位生存時間34.5個月。Survivin蛋白陽性組與陰性組患者的1、3、5年生存率分別為95.6%、46.7%、28.7%和84.6%、46.2%、23.1%,中位生存時間分別為35.2個月和26.6個月(P=0.560)(見圖1)。Bax蛋白陽性組與陰性組患者的1、3、5年生存率分別為92.0%、44.0%、24.0%和93.9%、48.5%、30.3%,中位生存時間分別為25.5 個月和35.6 個月(P=0.330)(見圖2)。
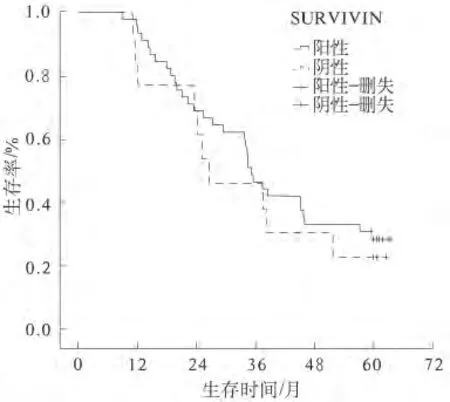
圖1 Survivin蛋白陽性組與陰性組預后比較
3 討論
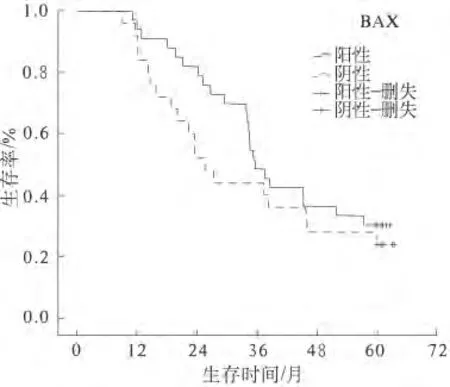
圖2 Bax蛋白陽性組與陰性組預后比較
食管癌是人類常見的惡性腫瘤,惡性程度高,預后差,其發生發展與細胞增殖、細胞凋亡的失衡密切相關。細胞凋亡是由Caspase半胱氨酸蛋白酶家族引發的級聯反應的細胞自我破壞的程序性生化過程,對維持組織的正常形態結構和機體內環境穩定具有重要的作用,受多種細胞凋亡相關基因的調控。Survivin是凋亡抑制蛋白(IAP)家族成員之一,也是迄今發現的作用最強的凋亡抑制因子。Survivin通過特異性地與Caspase-3和Caspase-7結合,抑制有活性的半胱天冬蛋白酶形成,從而發揮強大的抗凋亡作用,同時具有促進細胞增殖、參與細胞周期調控及促進血管生成多方面的功能。理論上,Survivin在腫瘤細胞中表達越強,腫瘤細胞的惡性程度越高,局部浸潤和遠處轉移的能力越強,從而導致患者生存期縮短,死亡率增高。
Survivin的表達具有組織選擇性,在胚胎組織和大多數人類腫瘤組織中都有表達,但在分化成熟的組織無表達。本研究中,Survivin在食管鱗癌組織中的陽性表達率為77.6%,與國內程道博等[4]的報道接近,提示Survivin可能對食管癌的早期診斷具有潛在價值。Muzio等[5]報道在浸潤性鱗癌中,Survivin的表達和腫瘤分化程度、腫瘤大小及淋巴結轉移相關。Cao等[6]對108例食管鱗癌患者外周血中Survivin的表達情況進行研究,結果顯示循環血液中Survivin表達與腫瘤侵犯深度、血管侵犯、淋巴結轉移和腫瘤分期均相關(P<0.05)。本研究中,高、中、低分化食管鱗癌的Survivin 陽性表達率分別為63.2%、76.0%和100.0%,差異有統計學意義(P<0.05),與程道博[4]的報道一致。同時發現,淋巴結陽性組的Survivin表達率高于淋巴結陰性組,隨著腫瘤侵犯深度及臨床分期的升高,Survivin的陽性表達率也逐漸提高,但均無統計學差異,考慮與樣本量小有關。本研究未發現Survivin的表達與患者的性別和年齡有關,與曹富民等[7]的結果一致。Ikeguchi等[8]在對53例食管鱗癌患者的研究中發現,17例Survivin mRNA高表達者與36例Survivin mRNA低表達者的5年生存率分別為14.1%和46.8%(P=0.001 8),結論為Survivin mRNA的表達是獨立于分期之外評估食管癌預后的一個良好生物指標。Cao等[6]發現循環血液中Survivin陽性患者腫瘤復發率高,生存率低,認為術后監測食管癌患者的Survivin表達情況可作為腫瘤復發的預測標志。但本研究中,Survivin蛋白陽性組與陰性組患者的1、3、5年生存率分別為95.6%、46.7%、28.7%和84.6%、46.2%、23.1%,中位生存時間分別為35.2個月和26.6個月,差異無統計學意義(P>0.05)。
Bax是原癌基因Bcl-2家族的一員,其編碼的蛋白21%與Bcl-2同源,生物學作用是拮抗Bcl-2基因,促進細胞凋亡。當Bax在細胞內過表達時,細胞對死亡信號的反應增強,細胞死亡增多[9]。目前關于Bax在食管癌中的表達及作用仍存在爭議[10-14]。Kang等[12]報道Bax在食管癌中的高表達率為67.0%(42/63),與放化療后的臨床完全緩解率密切相關,而與年齡、分期等無關,單因素分析顯示Bax低表達與預后不良密切相關(P=0.000 8),多因素分析認為Bax低表達是局部進展期食管癌預后不良的最強獨立因子(P=0.009)。Kurabayashi等[13]報道,Bax 在食管鱗癌中的陽性表達率為82.9%(63/76),與性別、年齡、腫瘤侵犯深度、血管侵犯、淋巴結轉移和臨床分期均無關,Bax陰性組的生存反而優于Bax陰性組(P=0.043)。本研究中,Bax在食管鱗癌組織中的陽性表達率為43.1%,其表達與患者性別、年齡、腫瘤侵犯深度、分化程度、淋巴結轉移及臨床分期均無關,Bax蛋白陽性組與陰性組患者的1、3、5年生存率無顯著性差異(P=0.330),與Natsugoe等[14]的研究結果相似。考慮造成Bax蛋白在食管癌中的表達程度及其作用不完全相同甚至完全相反的原因可能與樣本大小、病例選擇、實驗方法及判斷標準不同有關,亦有可能是Bax在食管癌的不同階段所起的作用不同造成的。
Survivin和Bax在腫瘤的發生發展過程中的作用不同,是一對作用相反的凋亡抑制與促進基因,兩者之間的平衡對細胞凋亡有重要作用。本研究中,Bax表達陽性及陰性的食管鱗癌組織中,Survivin陽性表達率均無顯著性差異(r=0.134,P=0.316),提示 Survivin和Bax基因可能通過各自不同的機制參與食管鱗癌的發生發展。
綜上所述,Survivin蛋白在食管鱗癌組織中呈高表達狀態,與食管鱗癌的分化程度密切相關,可能在食管鱗癌的發展過程中起重要作用,有待大樣本臨床研究來進一步驗證。
[1]賈百靈,李繼昌.胃腺癌發生過程中Fas、Bax蛋白表達的變化[J].河南醫學研究,1999,8(1):21-23.
[2]石敏.Survivin與腫瘤[J].河南醫學研究,2004,13(2):187.
[3]Krajewska M,Krajewski S,Epstein J I,et al.Immunohistochemical analysis of bcl-2,bax,bcl-X,and mcl-1 expression in prostate cancers[J].The American journal of pathology,1996,148(5):1567.
[4]程道博,何巧玉,汲振余,等.Survivin在不同分化狀態的食管鱗癌組織及體外食管鱗癌細胞中的表達[J].河南醫學研究,2010,19(1):27-29.
[5]Lo M L,Staibano S,Pannone G,et al.Expression of the apoptosis inhibitor survivin in aggressive squamous cell carcinoma[J].Experimental and molecular pathology,2001,70(3):249-254.
[6]Cao M,Yie S M,Wu S M,et al.Detection of survivin-expressing circulating cancer cells in the peripheral blood of patients with esophageal squamous cell carcinoma and its clinical significance[J].Clinical& experimental metastasis,2009,26(7):751-758.
[7]曹富民,張祥宏,嚴霞,等.食管鱗癌組織中survivin和caspase-3表達的預后意義及其與熱休克蛋白表達的關系[J].中華腫瘤雜志,2005,27(7):416-416.
[8]Ikeguchi M,Kaibara N.Survivin messenger RNA expression is a good prognostic biomarker for oesophageal carcinoma[J].British journal of cancer,2002,87(8):883-887.
[9]Kagawa S,Gu J,Swisher S G,et al.Antitumor effect of adenovirusmediated Bax gene transfer on p53-sensitive and p53-resistant cancer lines[J].Cancer research,2000,60(5):1157-1161.
[10]Sturm I,Petrowsky H,Volz R,et al.Analysis of p53/BAX/p16ink4a/CDKN2 in esophageal squamous cell carcinoma:High BAX and p16ink4a/CDKN2 identifies patients with good prognosis[J].Journal of clinical oncology,2001,19(8):2272-2281.
[11]Sarbia M,Stahl M,Fink U,et al.Expression of apoptosis-regulating proteins and outcome of esophageal cancer patients treated by combined therapy modalities[J].Clinical cancer research,1998,4(12):2991-2997.
[12]Kang S Y,Han J H,Lee K J,et al.Low expression of Bax predicts poor prognosis in patients with locally advanced esophageal cancer treated with definitive chemoradiotherapy[J].Clinical cancer research,2007,13(14):4146-4153.
[13]Kurabayashi A,Furihata M,Matsumoto M,et al.Expression of Bax and apoptosis-related proteins in human esophageal squamous cell carcinoma including dysplasia[J].Modern Pathology,2001,14(8):741-747.
[14]Natsugoe S,Matsumoto M,Okumura H,et al.Bax and Bcl-X expression are not related to prognosis in patients with advanced esophageal squamous cell carcinoma[J].Cancer letters,2001,174(1):91-97.

