室內(nèi)臨床生化不同檢測體系間檢測結(jié)果的可比性及偏倚評估
天津市海河醫(yī)院(300050)李妍 張立 秦中華
不同診斷試劑或設備對同一項目檢測結(jié)果的可比性檢驗和偏倚評估是申請臨床醫(yī)學實驗室認可必不可少的內(nèi)容[1]。ISO15189文件指出:當同樣的檢驗項目應用不同程序或設備,或在不同地點進行,或以上各項均不同時,應有確切機制以驗證在整個臨床適用區(qū)間內(nèi)檢驗結(jié)果的可比性[1][2]。由于中國檢驗試劑的生產(chǎn)和臨床實驗室參考系統(tǒng)并不十分完善,多數(shù)實驗室按照自己的意愿和實際情況選擇需要的儀器、試劑、質(zhì)控和操作程序等,并隨意組合成不同的檢測系統(tǒng)。因此,保證這些不同檢測系統(tǒng)間檢測結(jié)果的溯源性和可比性,是一個極大的現(xiàn)實問題[3]。本研究從實際出發(fā),同時對三種不同的臨床生化檢測體系進行對比分析和偏倚評估,以考察結(jié)果的一致性情況,為進一步制定質(zhì)量控制計劃,提供詳實數(shù)據(jù)支持。
1 材料與方法
1.1 檢測系統(tǒng)的組成
1.1.1 檢測系統(tǒng)1 Hitachi7600(DPP+ISE模塊)購買于2000年供住院部檢驗科使用;試劑:除開放通道(TBA,NEFA,ADA,LPa,AFU,PLIP,D3-H,β2MG)外均為羅氏原裝試劑,校準品:羅氏cafs和單項定標液;質(zhì)控品:羅氏PCCC系列質(zhì)控及單項質(zhì)控品;開放通道試劑為金斯爾(北京九強)試劑,定標液為試劑盒自帶,質(zhì)控品為朗道多項質(zhì)控液。
1.1.2 檢測系統(tǒng)2 Cobas6000(501+501+ISE模塊)購買于2012年供住院部檢驗科使用;試劑、標準液及質(zhì)控品與系統(tǒng)1相同。
1.1.3 檢測系統(tǒng)3 強生Vitros350購買于2007年供急診檢驗科使用;試劑、標準液及質(zhì)控品均有強生公司提供。
1.2 樣本 連續(xù)5天每日8例收集本院門診及住院患者的當天檢測樣本,檢測項目濃度覆蓋高中低值,應盡可能使至少50%樣本的測定結(jié)果處于實驗室的參考區(qū)間之外;當單個樣本量無法滿足實驗需求時,可選擇相同病例背景、檢測結(jié)果相近的兩個樣本進行混合,成為“微混合樣本”當作一個樣本進行測試。

附表1 Cobas6000與Hitachi7600的線性回歸方程及相關系數(shù)
1.3 方法
1.3.1 參比儀器的確定 檢測系統(tǒng)1為Hitachi7600檢測體系,其所有項目均定期校準,并參加全國室間質(zhì)評,成績優(yōu)異。其室內(nèi)質(zhì)控數(shù)據(jù)詳實,日間CV均小于1/3 CLIA88室間質(zhì)評允許誤差,故以其作為參比方法;以系統(tǒng)2和3作為待評系統(tǒng)。
1.3.2 儀器準備及質(zhì)控 按照實驗室制訂的SOP文件對三臺儀器進行每日、每周、每月維護保養(yǎng),每日質(zhì)控結(jié)果必須在控,確定儀器處于良好狀態(tài)。測試前均使用校準品校準, 并檢測試劑空白和室內(nèi)質(zhì)控。
1.3.3 樣本測定及數(shù)據(jù)收集 連續(xù)5天每天8份分別在三臺儀器上對同一樣本進行雙份測定;全部標本,均應在兩小時內(nèi)測定完畢。在樣本的雙份測定中,指定第一次測定順序,按反向順序檢測第二次(雙份)。例如:樣品可以按下述順序進行:1→8和8→1“正反向測定”。這樣共40份標本的每個檢測項目在三臺儀器上均分別得到80個檢測數(shù)據(jù),可用于后續(xù)分析判斷。
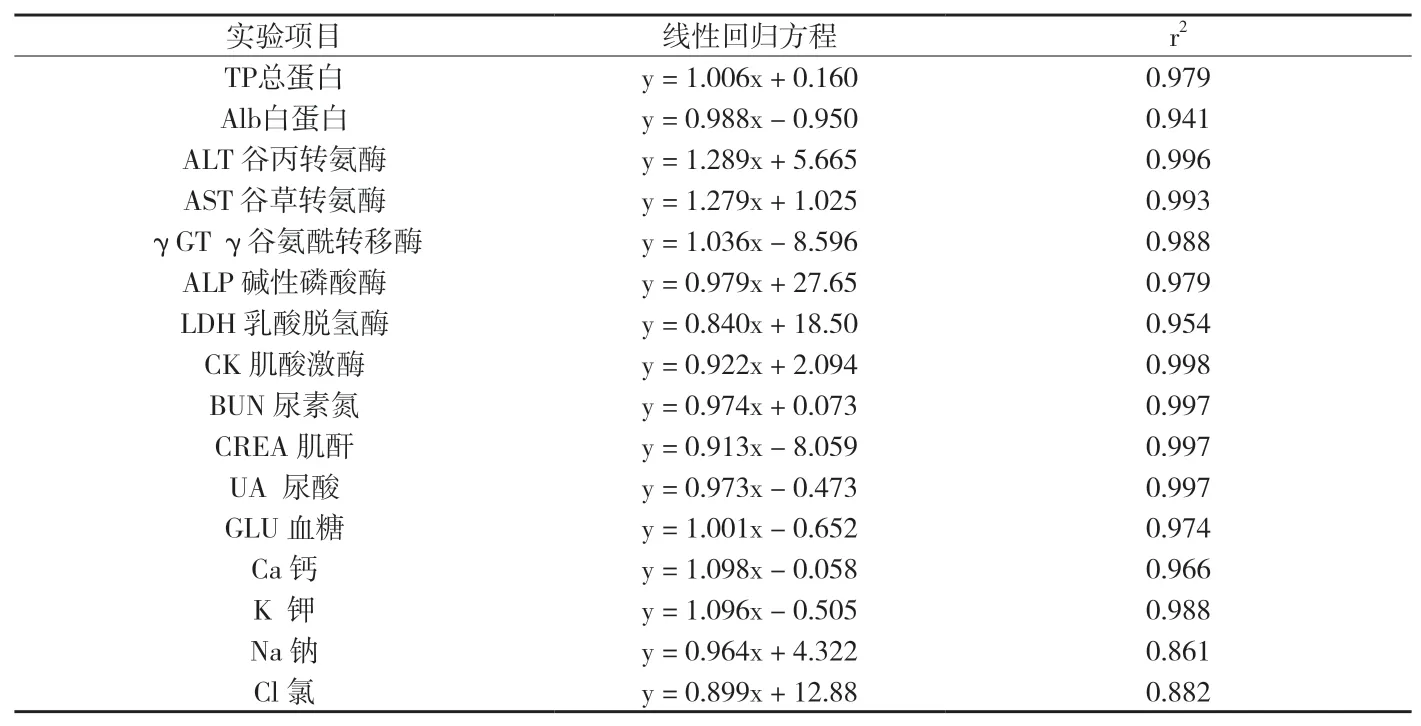
附表2 Vitros350(干化學)與Hitachi7600的線性回歸方程及相關系數(shù)
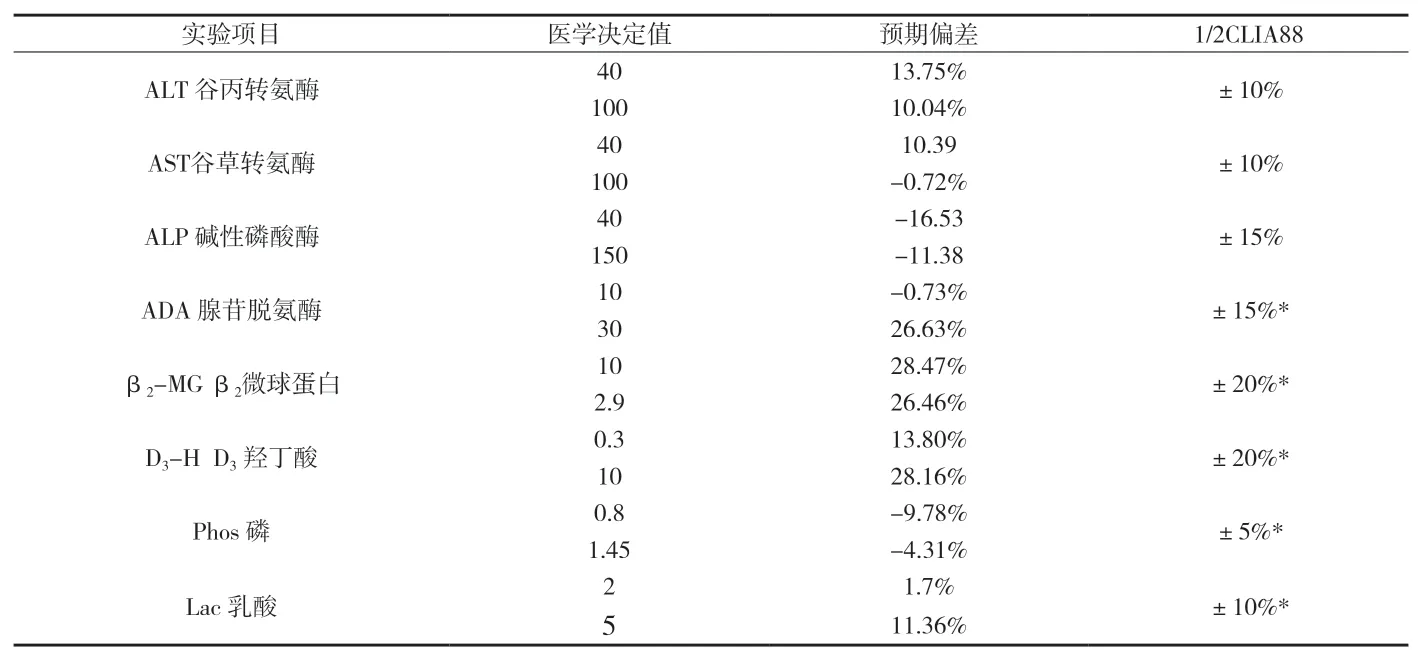
附表3 Cobas6000與Hitachi7600預期偏差及可接受性評價
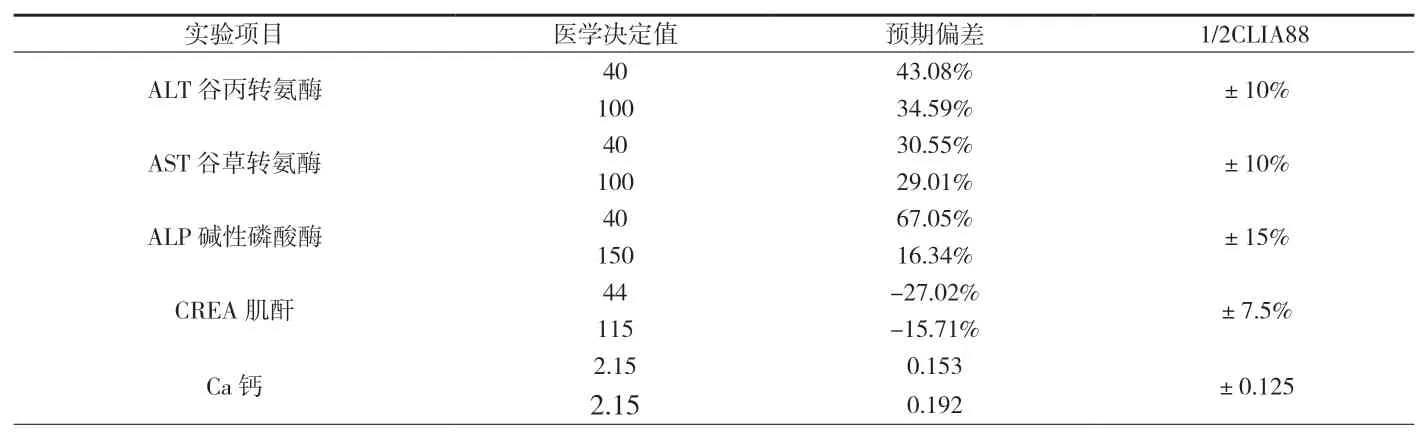
附表4 Vitros350(干化學)與Hitachi7600預期偏差及可接受性評價
1.3.4 實驗數(shù)據(jù)處理 用Microsoft Excel 2007計算相關性統(tǒng)計分析并給出線性回歸方程y= bx + a,其中Cobas6000和Vitros350為待評系統(tǒng)(y),Hitachi7600為參比系統(tǒng)(x),計算待評方法(y)與參比方法(x)之間的預期偏差。
1.3.5 實驗數(shù)據(jù)可信度判斷 按EP9A2文件進行2臺儀器測定值之間的離群值檢查并判斷。參比方法(x)測定范圍的檢驗,x的分布范圍是否合適,可用相關系數(shù)( r )作粗略估計,如r>0. 975或r2>0. 95,則認為x取值范圍合適,直線回歸統(tǒng)計的斜率和截距可靠,如r<0. 975則說明實驗方法的精密度較差或x取值范圍不合適,直線回歸統(tǒng)計的斜率和截距不可靠,需改善方法的精密度后重新試驗。
1.3.6 偏差估計和可接受判斷 將各個項目給定的醫(yī)學決定水平濃度代入回歸方程, 以CLIA88對室間評估的允許誤差為判斷依據(jù),由儀器間比較評估的預期偏差不大于允許誤差的1/2為臨床可接受水平,即2臺儀器間的測定結(jié)果具有可比性。對CLIA88未給定明確標準的項目,我們以過去40天內(nèi)本實驗室室內(nèi)質(zhì)控CV%的1/2作為判斷標準。
2 結(jié)果與分析
2.1 方法內(nèi)雙份測定的離群值檢查
計算每個樣品雙份測定差值的絕對值:DXi=︱xi1-xi2︱DYi=︱yi1-yi2︱其中i=樣品號(由1到40)。計算每個方法雙份測定的差值絕對值的均值:
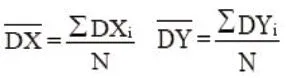
取各方法的平均絕對差值的四倍作為每個方法的“可接受”限,如果有一個值超過上述“可接受”限,檢查原因,并從數(shù)據(jù)組中刪除此值。經(jīng)方法內(nèi)離群值檢查,本實驗三種檢測體系,各方法內(nèi)均無離群點。
2.2 方法間離群值的檢查
計算兩種方法的絕對差值及其平均值,即:Eij=︱yij-xij︱(i=樣本號1…40和j=雙份測定中的1和2)。
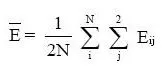
2.3 線性回歸分析及可信度判斷
將數(shù)據(jù)導入Excell2007進行線性回歸與散點圖分析,通過線性回歸得到直線回歸方程和相關系數(shù),結(jié)果見附表1和附表2。由附表1可知:Cobas6000與Hitachi7600相同的40項檢測項目中,有4項:鈣、鎂、氯和二氧化碳相關系數(shù)R2<0.95;由附表2可知:Vitros350(干化學)與Hitachi7600相同的16項檢測項目中,有3項:白蛋白、鈉和氯相關系數(shù)R2<0.95;當r2<0.95時,按照EP9A2要求則必須分析更多的樣品以擴大數(shù)據(jù)濃度分布范圍,然后再重新分析全部數(shù)據(jù)。如果x的取值范圍無法擴大,則可采用EP9A2文件6.2節(jié)中描述的分部偏倚法代替回歸方法來評價平均偏倚。
2.4 預期偏差的計算和可接受性能的評價兩種試劑間測定結(jié)果的相關系數(shù)R2>0.95時,回歸統(tǒng)計的斜率和截距均可靠,可用回歸統(tǒng)計的方法計算預期偏差及進行可接受性偏倚分析。根據(jù)附表1和附表2中的各檢測項目的直線回歸方程,計算各項目在醫(yī)學決定水平xc處測定結(jié)果的預期偏差或相對偏差,并評估臨床可按接受性。本研究發(fā)現(xiàn),Cobas6000與Hitachi7600間有7個檢測項目相對偏差大于可接受水平,見附表3;Vitros350(干化學)與Hitachi7600間有5個檢測項目預期偏差或相對偏差大于可接受水平,見附表4。
3 討論
為確保不同檢測系統(tǒng)間檢測同一生化項目的結(jié)果具有一致性,需每年進行至少2次儀器比對試驗[4]。本研究對三個檢測系統(tǒng)(包含干化學和濕化學)中所有相同的檢測項目進行了全面的結(jié)果對比和偏倚評估。結(jié)果顯示,三個檢測系統(tǒng)各自精密度均較高,各自室內(nèi)質(zhì)控及室間質(zhì)評結(jié)果均良好,能滿足臨床要求,但不同檢測系統(tǒng)間尚存在一定的偏差。特別是干化學Vitros350與Hitachi7600之間,酶學指標ALT、AST、ALP兩檢測系統(tǒng)間相對偏差達到30%以上,遠遠超出了1/2 CLIA88要求的上限(見附表4)。據(jù)EP9A2文件規(guī)定:“如果兩種方法存在顯著偏倚,但仍相信待評方法更特異,則不要拒絕待評方法,在常規(guī)應用前收集新的臨床數(shù)據(jù)(如建立新的參考范圍)。應注意實驗室要建立兩種方法之間的允許差異的標準,當比較兩種方法的允許誤差時不一定單獨應用醫(yī)學允許誤差的標準來判斷精密度是否可接受”[5]。由此可知,為避免干化學Vitros350與Hitachi7600個別項目檢測結(jié)果不一致給臨床帶來的不便和混淆,必須在檢驗報告中明確注明檢測方法,并建立不同的正常參考值系統(tǒng);如有可能,應清晰界定3臺儀器的檢測標本范圍,如:干化學Vitros350僅用于急診標本的檢測,Hitachi7600用于門診標本的檢測,Cobas6000用于住院部標本的檢測,這樣在一定程度上能夠有效降低不同檢測系統(tǒng)間帶來的系統(tǒng)誤差,方便臨床一線進行結(jié)果對比。兩個不同的濕化學檢測體系間(Cobas6000和Hitachi7600),采用了同品牌的試劑、相同的定標和質(zhì)控體系及相近的SOP操作規(guī)程,但仍有7項指標超出了偏倚可接受水平(見附表3),且ALT、AST及ALP均是臨床生化中最主要的常規(guī)檢測項目。因此十分必要且必須對兩系統(tǒng)間存在的系統(tǒng)誤差因素進行排查,可能帶來的系統(tǒng)誤差因素包括:儀器使用年限、損耗程度等不同、比色杯洗凈能力不同導致本底不同等[6][7];但本實驗室最可能的因素來自于人員操作誤差,由于兩個檢測系統(tǒng)分別由不同的操作人員執(zhí)行,他們可能在質(zhì)控規(guī)則把握的嚴格程度上略有差異,雖然各自的質(zhì)控均在控,但仍有可能帶來顯著的系統(tǒng)誤差。因此加強對操作人員培訓,建立統(tǒng)一的且被嚴格執(zhí)行的室內(nèi)質(zhì)量控制體系和定期比對校準體系,十分必要且迫切。
綜上所述,按照EP9A2文件要求從相關性、預期偏差評估及與1/ 2 CLIA88比較等方面綜合分析不同儀器檢測同一項目結(jié)果間的準確性和不一致的可接受限,從不同角度評估檢測結(jié)果,有利于為臨床疾病診斷、療效觀察提供可靠保證。同一實驗室以不同檢測系統(tǒng)分析同一檢測項目時,應配備專門的、熟悉儀器的技術(shù)人員定期對不同檢測系統(tǒng)的結(jié)果進行分析、評價,對偏差超出臨床檢驗中心規(guī)定允許誤差的進行校正,使不同儀器測定結(jié)果具有較好的可比性和一致性,從而確保檢驗結(jié)果可滿足臨床需要。

