鎳鈦合金支架抑制單核巨噬細胞應答革蘭陰性菌脂多糖的研究*
羅海波,呂愛貞,盧 曉,富 寧,吳 砂,鄭 華
(1.廣州軍區解放軍第421醫院檢驗輸血科,廣州510310;2.南方醫科大學基礎醫學院免疫學教研室,廣州510515;3.南方醫科大學南方醫院心內科,廣州510515)
心血管狹窄引起的冠心病已經成為危及人類生命健康的主要疾病之一,向病變血管內置入金屬支架,成為目前治療冠狀動脈及其他外周動脈疾病有效的治療方法[1]。目前常用的材料有鉭、醫用不銹鋼及鎳鈦合金等。近年來發現,這些金屬材料支架會影響單核巨噬細胞功能,引發過敏反應[2]。但對單核巨噬細胞其他功能的影響卻未做深入研究。
單核巨噬細胞的重要功能之一就是抗感染,通過多種方式能識別多種病原微生物關鍵成分,從而發揮清除病原微生物的目的。脂多糖(lipopolysaccharide,LPS)是革蘭陰性菌細胞壁的重要組成部分,對細胞的生長與持續極為重要,單核巨噬細胞通過其表面Toll樣受體4(Toll like receptor 4,TLR4)-LPS識別革蘭陰性菌,誘發一系列的炎性反應及免疫應答[3]。本研究利用鎳鈦合金心血管支架(nickel-titanium stent,NTS)作用單核巨噬細胞系Raw264.7細胞,檢查其影響單核巨噬細胞應答LPS的能力及其胞內炎癥相關的信號通路改變,從而探討NTS對單核巨噬細胞抗感染能力,現報道如下。
1 材料與方法
1.1 材料 PE標記抗小鼠FasL、CD80、CD86抗體均購自美國Biolegend公司。小鼠IL-6、TNF-α的ELISA試劑盒均購自美國Biolegend公司。LPS購自美國Sigma公司。Lipofectamine 2000購自美國Invitrogen公司。Luciferase Assay購自美國Promega公司。pGL4.32-luc2P/NF-κκB-RE/Hygro Vector購自美國Promega公司。干擾素-γ(GAS)、干擾素刺激反應元件(ISRE)、信號轉導與轉錄活化因子(STAT3)信號通路質粒均購自美國Clontech公司。不完全培養基RPMI-1640及新生小牛血清均購自美國Gibco公司。胰蛋白酶購自廣州威佳科技有限公司。NTS為荷蘭Orbusneich公司產品。
1.2 方法
1.2.1 單核巨噬細胞培養 Raw264.7細胞用含10%新生小牛血清的完全培養基RPMI-1640在37℃、5%CO2孵箱中培養。
1.2.2 地塞米松(DX)刺激Raw264.7細胞 于Raw264.7細胞中加入10-6mol/L DX培養4d(DX-Raw264.7細胞)。
1.2.3 NTS刺激Raw264.7細胞及DX-Raw264.7細胞 調整細胞密度為1×106/mL,于培養的Raw264.7細胞及DXRaw264.7細胞中加入NTS培養4d。
1.2.4 LPS刺激經支架作用后的Raw264.7細胞及DXRaw264.7細胞 于經NTS作用后的Raw264.7細胞及DXRaw264.7細胞中加入LPS培養24h,收集細胞培養上清液,磷酸鹽緩沖液(PBS)洗2遍待檢。
1.2.5 流式細胞儀檢測 調整細胞密度為1×106/mL,分別標記抗體PE-FasL、PE-CD80。4℃孵育30min,PBS洗2遍,加入0.5mL PBS重懸,流式細胞儀進行分析。
1.2.6 細胞因子檢測 根據小鼠IL-6、TNF-α的ELISA試劑盒說明書檢測Raw264.7細胞及DX-Raw264.7細胞培養上清液中IL-6和 TNF-α。
1.2.7 信號通路活化檢測 鋪板,將每孔的細胞密度調整為1×105/mL,按Lipofectamine 2000說明書將pGL4.32[luc2P/NF-κκB-RE/Hygro]Vector、pTA-GAS-luc、pTA-ISRE-luc和pTA-STAT3-luc信號通路活化質粒轉染各組Raw264.7細胞及DX-Raw264.7細胞,24h后收集細胞裂解液,熒光素酶試劑盒進行檢測。
1.2.8 根據不同處理方式分組 分為:對照空白組,單純NTS組,單純LPS作用組,NTS作用后LPS反應組,RAW264.7組:單核細胞系264.7,DX-Raw264.7組:DX作用單核細胞系。
1.3 統計學處理 采用SPSS16.0統計軟件進行分析,所用的統計學方法為t檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 NTS作用后LPS對Raw264.7及DX-Raw264.7細胞表面共刺激分子的影響 NTS作用后經過LPS刺激時,Raw264.7細胞CD80的表達明顯高于LPS單獨刺激組,差異有統計學意義(P<0.05)。而DX預處理組,NTS影響差異無統計學意義(P>0.05),見圖1。
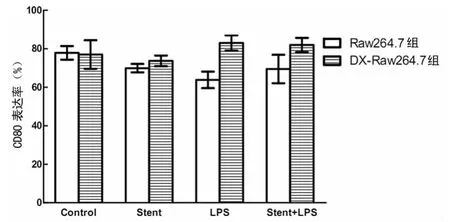
圖1 NTS作用后LPS對Raw264.7及DX-Raw264.7細胞表達CD80的影響
2.2 NTS作用后LPS對單核巨噬細胞Raw264.7合成促炎癥因子的影響 在NTS單獨作用下,Raw264.7組分泌IL-6及TNF-α明顯高于空白對照組,但經NTS作用后,應對LPS刺激時Raw264.7組分泌IL-6明顯低于LPS單獨刺激組。但Raw264.7組經過DX事先處理后,各組IL-6的分泌差異無統計學意義(P>0.05),而且NTS與LPS對單核巨噬細胞的影響都明顯受到了抑制,弱于Raw264.7組,差異有統計學意義(P<0.05),見圖2。
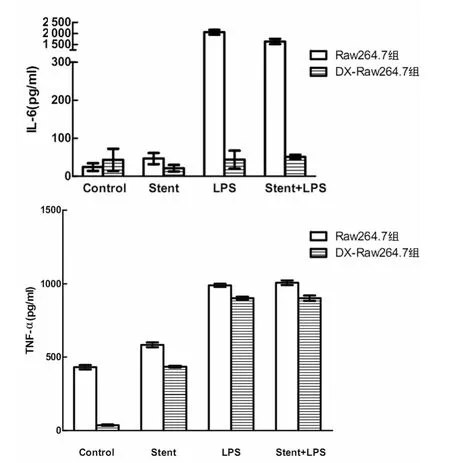
圖2 NTS作用后LPS對Raw264.7細胞及DX-Raw264.7細胞分泌IL-6及TNF-α的影響
2.3 NTS作用后LPS對單核巨噬細胞Raw264.7細胞表面FasL類分子表達的影響 經NTS作用后,LPS誘導的Raw264.7細胞FasL的表達明顯低于LPS單獨刺激組,差異有統計學意義(P<0.05)。但Raw264.7細胞經過DX事先處理后,DX-Raw264.7細胞經NTS單獨刺激后,FasL的表達明顯低于空白對照組,經LPS單獨刺激后,FasL的表達明顯高于空白對照組,而低于NTS與LPS共同刺激組,差異有統計學意義(P<0.05)。在LPS單獨刺激下,DX-Raw264.7組表面FasL的表達明顯高于Raw264.7組,在NTS與LPS共同刺激下,DX-Raw264.7組表面FasL的表達同樣明顯高于Raw264.7組,差異有統計學意義(P<0.05),見圖3。
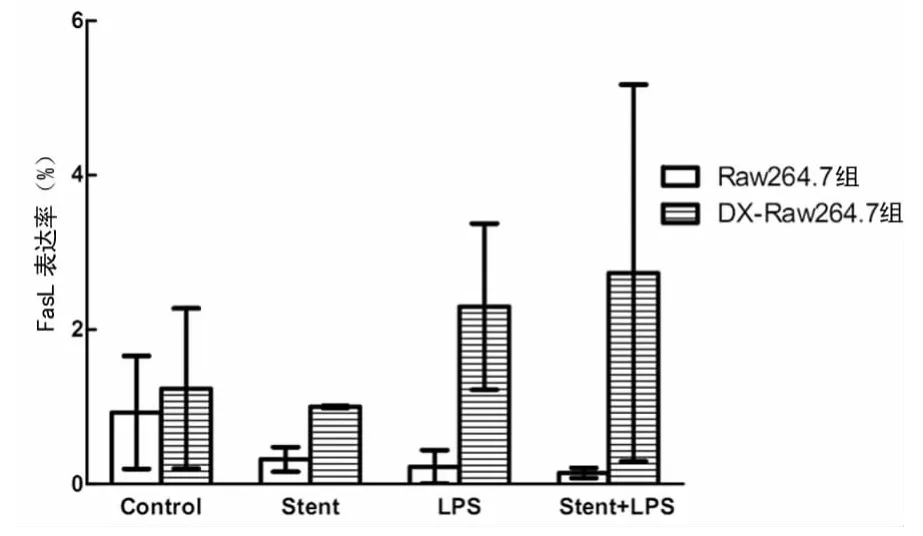
圖3 NTS作用后LPS對Raw264.7細胞及DX-Raw264.7細胞表達FasL的影響
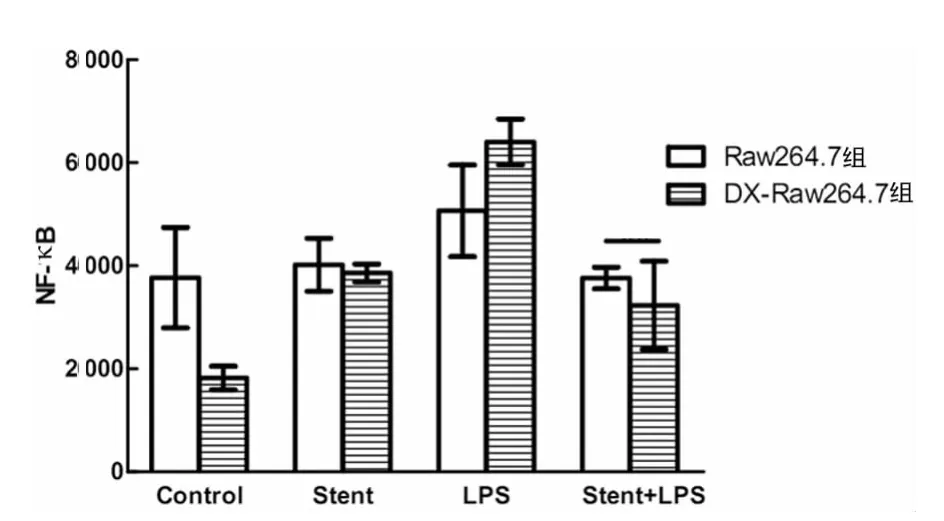
圖4 NTS作用后LPS對Raw264.7細胞及DX-Raw264.7細胞胞內NF-κB信號通路活化的影響

圖5 NTS作用后LPS對Raw264.7細胞及DX-Raw264.7細胞胞內GAS信號通路活化的影響
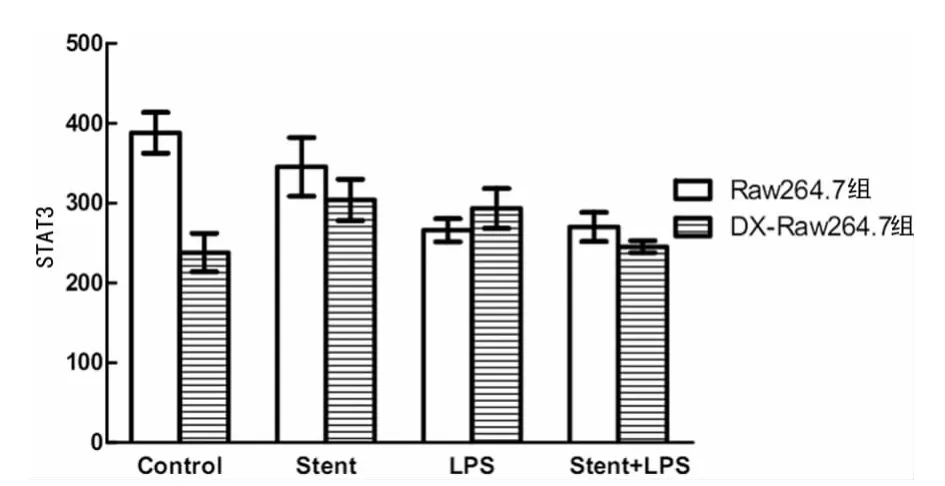
圖7 NTS作用后LPS對Raw264.7細胞及DX-Raw264.7細胞胞內STAT3信號通路活化的影響
2.4 NTS作用對Raw264.7細胞信號通路的影響。NTS作用后,明顯抑制LPS對NF-κB的活化作用,但LPS介導的GAS,ISRE及STAT3等通路無明顯影響。但Raw264.7細胞經過DX事先處理后,NTS單獨就可活化 NF-κB、GAS、ISRE及STAT3等一系列信號通路,但鎳鈦合金影響LPS介導的信號活化,DX-Raw264.7組與Raw264.7組差異有統計學意義(P<0.05),見圖4~7。
3 討 論
動脈粥樣硬化是心血管疾病死亡的重要原因之一,目前主要是通過向動脈狹窄部位植入金屬支架,使病變部位動脈保持血流暢通以達到治療疾病的目的[4]。然而,金屬支架作為一種外來異物,植入人體后會引起機體免疫功能發生改變。現已證實,金屬支架植入后,雖然通過機械張力短時間內改變血管狹窄,但由于金屬支架可刺激機體免疫細胞應答,局部形成炎性反應,造成支架周邊血管床炎癥,容易形成再狹窄,嚴重地影響了支架的作用[5]。對于支架材料的選擇與應用一直是一個難題。在本研究中,證實了在NTS單純作用下,基本上不引發單核巨噬細胞炎癥信號通路的活化,不產生炎癥因子,這點有利于進行術后恢復,這與文獻報道的鎳鈦合金支架作用處出現過敏性炎癥不同,由此似乎可以得到一種比較好的低免疫原性支架材料配比[6]。
單核巨噬細胞作為重要的吞噬細胞,對革蘭陰性菌的吞噬處理是其重要的免疫功能。LPS是革蘭陰性菌重要的胞壁組成成分,能與單核巨噬細胞表面TLR4分子結合,刺激免疫反應的發生。在哺乳動物體內,TLR4是LPS最主要的識別受體[7]。LPS從細菌中釋放出來后,會與血液中的LPS結合蛋白(LBP)結合,再與巨噬細胞表面的甘油磷酸肌醇結合蛋白CD14結合,接著LPS被轉移到TLR4胞外段 MD-2上,刺激巨噬細胞,使其發生一系列的反應[2]。本研究著重觀察鎳鈦合金影響單核巨噬細胞對LPS應答的影響,結果證實,NTS作用后,單核巨噬細胞應答LPS時,其表面的殺傷性標志FasL及促炎癥因子IL-6的表達都明顯低于無支架作用時,說明NTS抑制了Raw264.7細胞對LPS的免疫應答,表明NTS可能會抑制單核巨噬細胞對革蘭陰性菌的應答。對于單核巨噬細胞,當其通過TLR4與LPS結合后,會活化巨噬細胞內的NF-κB通路[8]。分泌多種促炎癥細胞因子,如IL-6、TNF-α等,引起一系列的炎性反應[9-10]。而鎳鈦合金明顯地抑制了這種LPS介導的NF-κB活化,降低了炎性反應。除此以外,對于感染,干擾素也是重要的抵抗因素,筆者關注了GAS或ISRE,這兩種與干擾素產生密切相關的信號通路的活化嚴格控制了干擾素的產生[11],本研究中發現他們都沒受到影響,由此證實鎳鈦合金無法影響Ⅰ型及Ⅱ型干擾素的產生。
DX為糖皮質激素的一種,具有抗炎、抗過敏等多種藥理作用,被臨床廣泛使用,在避免支架植入后狹窄中經常使用,現在已經將緩釋DX涂層應用于支架的報道減輕局部炎性反應[12]。在本研究中,DX可以明顯改變NTS的作用。DX單獨作用就可以明顯降低促炎癥因子及相關炎癥信號分子的活化,而鎳鈦合金對LPS介導的NF-κb活化的抑制效應也得到了放大,同時還影響了ISRE及STAT3信號的活化,進一步地抑制了抗炎作用。所以,DX在支架干擾LPS應答方面會加強這種抑制效果,使機體更難應答LPS。
綜上所述,NTS可通過抑制單核巨噬細胞NF-κB活化阻礙LPS的免疫應答,而DX則會進一步放大這種抑制效應。此研究有利于從臨床應用角度探討NTS的應用。
[1]Nakazawa G.Stent thrombosis of drug eluting stent:pathological perspective[J].J Cardiol,2011,58(2):84-89.
[2]Kounis NG,Giannopoulos S,Tsigkas GG,et al.Eosinophilic responses to stent implantation and the risk of Kounis hypersensitivity associated coronary syndrome[J].Int J Cardiol,2012,156(2):125-132.
[3]Aerbajinai W,Lee K,Chin K,et al.Glia Maturation factor-γnegatively modulates TLR4signaling by facilitating TLR4endocytic trafficking in macrophages[J].J Immunol,2013,190(12):6093-6103.
[4]Cecchi E,Giglioli C,Valente S,et al.Role of hemodynamic shear stress in cardiovascular disease[J].Atherosclerosis,2011,214(2):249-256.
[5]Simon DI.Inflammation and vascular injury:basic discovery to drug development[J].Circ J,2012,76(8):1811-1818.
[6]Kounis NG,Giannopoulos S,Tsigkas GG,et al.Eosinophilic responses to stent implantation and the risk of Kounis hypersensitivity associated coronary syndrome[J].Int J Cardiol,2012,156(2):125-132.
[7]Rubinow KB,Wall VZ,Nelson J,et al.Acyl-CoA synthetase 1is induced by Gram-negative bacteria and lipopolysaccharide and is required for phospholipid turnover in stimulated macrophages[J].J Biol Chem,2013,288(14):9957-9970.
[8]Schilling JD,Machkovech HM,He L,et al.Palmitate and lipopolysaccharide trigger synergistic ceramide production in primary macrophages[J].J Biol Chem,2013,288(5):2923-2932.
[9]Zhang DY,Chen LL,Li SL,et al.Lipopolysaccharide(LPS)of Porphyromonas gingivalis induces IL-1beta,TNF-alpha and IL-6production by THP-1cells in a way different from that of Escherichia coli LPS[J].Innate Immun,2008,14(2):99-107.
[10]Ogawa Y,Tasaka S,Yamada W,et al.Role of Toll-like receptor 4in hyperoxia-induced lung inflammation in mice[J].Inflamm Res,2007,56(8):334-338.
[11]Yu JH,Zhu BM,Wickre M,et al.The transcription factors signal transducer and activator of transcription 5A(STAT5A)and STAT5Bnegatively regulate cell proliferation through the activation of cyclin-dependent kinase inhibitor 2b(Cdkn2b)and Cdkn1aexpression[J].Hepatology,2010,52(5):1808-1818.
[12]K?nig A,Leibig M,Rieber J,et al.Randomized comparison of dexamethasone-eluting stents with bare metal stent implantation in patients with acute coronary syndrome:serial angiographic and sonographic analysis[J].Am Heart J,2007,153(6):979.

