氟滅酸對豚鼠微動脈平滑肌細胞間縫隙連接的抑制作用*
張治平,司軍強,李新芝,李 麗,趙 磊,魏麗麗,于秀石,馬克濤△
(石河子大學醫(yī)學院:1.生理學教研室;2.病理生理學教研室,新疆石河子832002)
氟滅酸(flufenamic acid,FFA)是臨床常見的非甾體抗炎藥物,研究發(fā)現氟滅酸能夠阻斷Cl-通道[1-2]、調節(jié)非選擇性陽離子通道[3-4],還可以抑制培養(yǎng)的成纖維細胞和神經母細胞瘤細胞間的縫隙連接通道[5]。本實驗主要研究氟滅酸對急性分離的微動脈細胞間縫隙連接通道的電生理特性影響。許多組織和器官上都表達有縫隙連接存通道,是細胞間進行電化學信息通訊的直接途徑[6-7]。縫隙連接通道由相鄰的兩個細胞各提供一個連接子對接而成,每個連接子由6個不同或相同的連接蛋白(connexin,Cx)構成,縫隙連接通道的孔徑約1.5nm,允許相對分子量小于1KD的分子通過。目前發(fā)現超過20種Cx表達在不同的細胞[6,8]。
縫隙連接在維持人體正常生理功能中扮演著重要角色,在血管舒縮運動中更為突出[9-13]。調節(jié)血管舒縮運動的電、化學信息在平滑肌細胞和內皮細胞之間傳遞,以及平滑肌細胞的同步化都需要縫隙連接功能和結構的完整性[9,14]。為了研究縫隙連接在生理和病理生理狀態(tài)下所發(fā)揮的作用,特異性縫隙連接阻斷劑是必不可少的。有報道發(fā)現在培養(yǎng)的細胞上氟滅酸能夠抑制細胞間的縫隙連接通訊[5],但在急性分離的血管段標本上尚未見相關報道。本實驗采用微動脈段全細胞膜片鉗技術在急性分離的腦動脈(brain?artery,BA)和腸系膜動脈(mesenteric artery,MA)上,研究氟滅酸對血管平滑肌細胞間縫隙連接通道電生理特性的影響,現報道如下。
1 材料與方法
1.1 材料 實驗所用豚鼠(新疆維吾爾自治區(qū)疾病控制中心動物飼養(yǎng)科提供,動物質量符合一級標準)雌雄不限,體質量約200~300g,麻醉狀況下放血處死,迅速取出腸系膜和腦,置于生理鹽溶液中,生理鹽溶液成分如下:NaCl 138.0mmol/L,KCl 5.0mmol/L,CaCl21.6mmol/L,MgCl21.2mmol/L,Na-HEPES 5.0mmol/L,HEPES 6.0mmol/L,葡萄糖7.5mmol/L。生理鹽溶液中迅速取出BA和MA。所用藥物用生理鹽溶液配制,通過開關控制藥物灌流標本,保持灌流速度、溫度和其他成分不變。所用藥物有:氟滅酸由Sigma公司提供,其余試劑均為國產分析純試劑。
1.2 方法
1.2.1 微動脈段標本制備 截取好的微動脈標本置于直徑35mm的培養(yǎng)皿中,血管微動脈長約0.4mm,直徑在40~80 μm之間,兩端用細鉑金片固定在培養(yǎng)皿底部,在37℃溫箱中用含有膠原酶A(1.5mg/mL)的生理鹽溶液處理15min,生理鹽溶液置換2次去除殘存膠原酶A,體顯微鑷下進一步去除附在微動脈上的結締組織。

表1 微動脈段上和單個平滑肌細胞的膜電生理特性的比較
1.2.2 單個平滑肌細胞制備 將微動脈置于細胞分離液中20min,細胞分離液成分為:NaCl 142.00mmol/L,KCl 5.00 mmol/L,CaCl20.05mmol/L,MgCl21.00mmol/L,Na-HEPES 4.00mmol/L,HEPES 5.00mmol/L,葡萄糖 7.50 mmol/L。將微動脈剪成幾段放入消化液后,在37℃溫箱中消化20~25min,消化液成分包括:木瓜蛋白酶0.75mg/mL,膠原酶Ⅰ1.00mg/mL,牛血清清蛋白3.75mg/mL,二硫蘇糖醇0.30mg/mL。1 000r/min離心6min后棄上清液,加入細胞分離液制成細胞懸浮液,如此反復替換3次后,將液體移至用多聚賴氨酸處理過的培養(yǎng)皿內,靜置30min使細胞貼壁。生理鹽溶液沖洗20min后進行全細胞膜片鉗實驗。
1.2.3 全細胞膜片鉗記錄 室溫條件下(22~25℃)標本持續(xù)灌注生理鹽溶液(0.2mL/min)進行全細胞膜片鉗實驗。記錄電極阻抗約為5MΩ,P-97拉制儀拉制。電極內液成分是:K-gluconate 130.0mmol/L,NaCl 10.0mmol/L,CaCl22.0 mmol/L,MgCl21.2mmol/L,HEPES 10.0mmol/L,EGTA 5.0mmol/L,葡萄糖7.5mmol/L。通過微操縱器接觸到細胞后給予負壓形成GΩ封接。補償電極電容后給予瞬時較強負壓或者電刺激擊破細胞膜形成全細胞膜片鉗,膜電流用10 kHz(-3dB)低頻濾過[15]。
1.3 統計學處理 采用SPSS16.0統計軟件進行分析,計量資料以s表示,組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 微動脈平滑肌細胞間的縫隙連接 微動脈段上和單個平滑肌細胞的細胞膜電生理特性(表1),MA和BA微動脈段上平滑肌細胞Cinput大約是消化分離的單個平滑肌細胞的10倍,Ginput大約是單個平滑肌細胞的20倍。
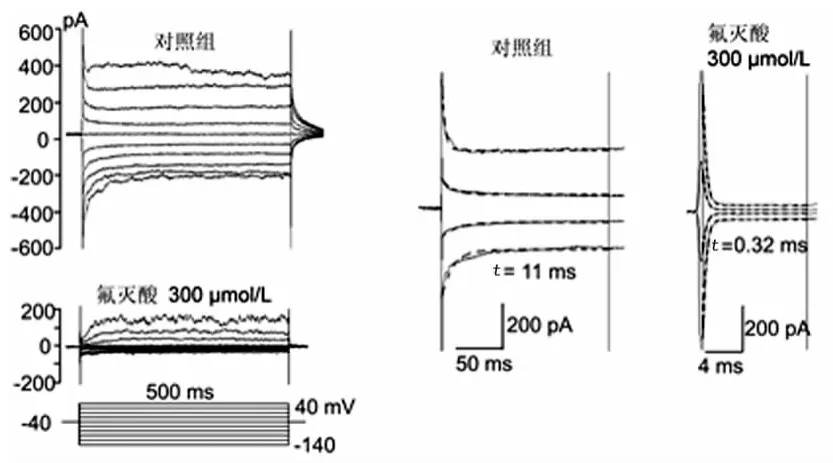
圖1 氟滅酸對微動脈平滑肌細胞間縫隙連接的抑制作用
2.2 氟滅酸抑制微動脈平滑肌細胞間的縫隙連接 應用氟滅酸前細胞膜電流幅度顯著大于應用氟滅酸(300μmol/L)后(圖1),細胞Rinput從0.32GΩ增加到2.15GΩ。表2總結了氟滅酸對微動脈段平滑肌細胞Cinput、Rinput和Ginput的影響,應用氟滅酸干預后記錄平滑肌細胞的Cinput、Rinput和Ginput與表1中單個細胞的數值十分接近。此外,應用單指數方程分別對氟滅酸干預和對照組記錄平滑肌細胞膜電容充放電過程進行擬合。結果發(fā)現,氟滅酸干預前擬合效果較差(r≤0.90),干預后擬合效果較好(r>0.98),細胞Cinput的充放電的時間常數也由11.00ms減少至0.32ms。
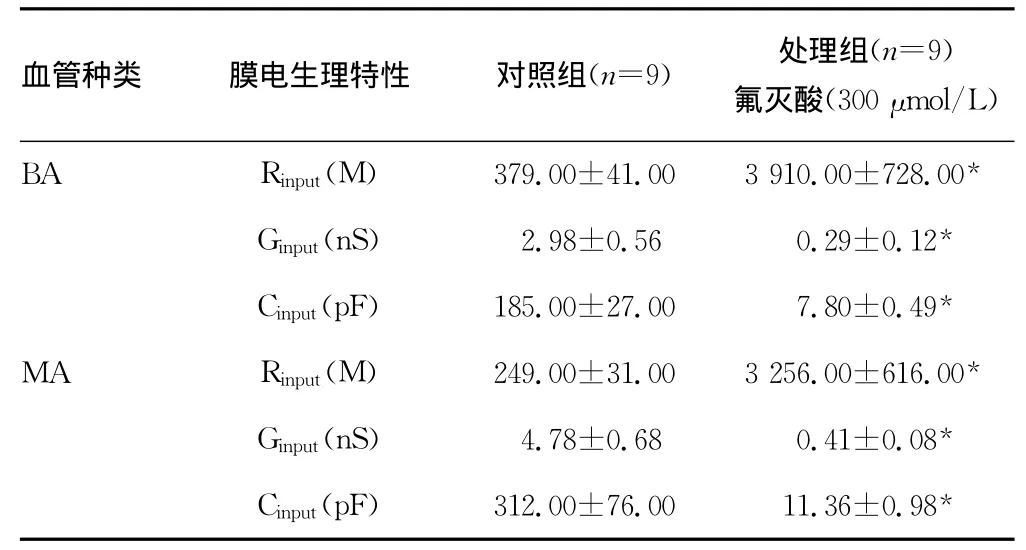
表2 氟滅酸對微動脈段上平滑肌細胞膜電生理特性的影響
應用斜坡電壓刺激顯示氟滅酸凈電流的電流/電壓(I/V)曲線呈線性(圖2),且微動脈段上記錄平滑肌細胞的靜息電位與翻轉電位點十分接近,提示氟滅酸主要抑制相鄰細胞間縫隙連接通道。
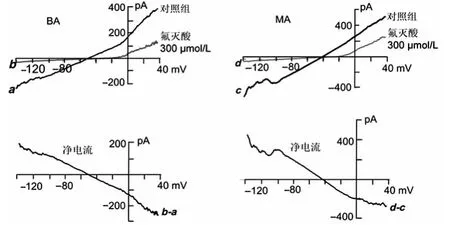
圖2 氟滅酸凈電流的I/V曲線
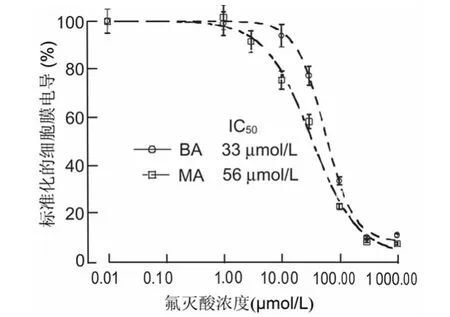
圖3 氟滅酸濃度依賴的抑制微動脈上平滑肌細胞膜電導
2.3 氟滅酸濃度依賴的抑制微動脈平滑肌細胞間縫隙連接氟滅酸可以濃度依賴性的抑制微動脈上平滑肌細胞間縫隙連接(圖3),氟滅酸(1~1 000μmol/L)能夠濃度依賴的減少微動脈段上平滑肌細胞的Ginput。經繪制曲線發(fā)現氟滅酸抑制BA和MA細胞間縫隙連接通道的IC50分別為33和56μmol/L,氟滅酸抑制兩種微動脈細胞間縫隙連接通道的差異無統計學意義(P>0.05)。
3 討 論
本實驗在BA和MA上通過以下3個方面得以證實氟滅酸可以可逆和濃度依賴的抑制細胞間縫隙連接通訊:(1)氟滅酸能夠增加微動脈段上平滑肌細胞的Rinput至單個平滑肌細胞水平;(2)氟滅酸可以減小微動脈段上平滑肌細胞Cinput值和Ginput值接近于單個細胞;(3)氟滅酸后能夠降低細胞膜充放電時間至單個細胞水平,且單指數方程能夠較好的擬合[16-17]。結果提示,當氟滅酸的濃度≧300μmol/L時BA和MA微動脈段上平滑肌細胞間的縫隙連接通道可以被完全抑制。此外,氟滅酸對BA和MA兩種微動脈細胞間縫隙連接通道的抑制作用無統計學差異,提示相同的連接蛋白表達在上述兩種微動脈。
Harks等[18]報道在健康大鼠腎成纖維細胞和過表達Cx43的SKHep1細胞上氟滅酸可以阻斷細胞間的縫隙連接通訊,IC50是40μmol/L,當濃度大于或等于250μmol/L時氟滅酸可以完全阻斷細胞間的縫隙連接通訊。此結果與本實驗的結果一致。血管微動脈主要表達Cx37、Cx40、Cx43和Cx45,其中平滑肌細胞上主要表達Cx37、Cx43和Cx45,內皮細胞上主要表達Cx37、Cx40和Cx43[13]。本實驗結果提示,在 MA和BA微動脈上平滑肌細胞間縫隙連接通道可能是由Cx43和其他幾種連接蛋白組成的異聚體。另有文獻報道,在N2A神經母細胞瘤上氟滅酸能夠非選擇性阻斷由Cx26、Cx32、Cx40、Cx43、Cx46和Cx50分別組成的縫隙連接通道[19]。
縫隙連接是相鄰細胞間的連接通道排列而組成的一種特殊膜結構,能夠允許某些離子以及相對分子質量小于1×103的分子自由通過,是細胞間進行物質交換和信息通訊的途徑[20]。縫隙連接與血管緊張度的調節(jié)密切相關,通過縫隙連接電化學信號的直接交流,使血管能夠保持電和機械活動的同步性,對刺激信息作出同步性的反應,保證血管舒縮功能的一致和穩(wěn)定。病理情況下,傷害性信息也能夠相鄰細胞間存在的縫隙連接通道進入正常細胞,進而使正常細胞出現病理性改變[9],如果提前應該縫隙連接阻斷劑阻斷異常細胞與正常細胞間的縫隙連接通道,則傷害性信息不會傳遞至正常細胞。Saltman等[21]發(fā)現在心肌梗死的動物模型上提前應用了縫隙連接阻斷劑庚醇,心肌梗死的面積顯著降低。因此,縫隙連接阻斷劑將會是治療心腦血管疾病非常重要的工具。
[1]Duran C,Thompson CH,Xiao Q,et al.Chloride channels:often enigmatic,rarely predictable[J].Annu Rev Physiol,2010,72:95-121.
[2]Hartzell C,Putzier I,Arreola J.Calcium-activated chloride channels[J].Annu Rev Physiol,2005,67:719-758.
[3]Hill K,Benham CD,McNulty S,et al.Flufenamic acid is a pH-dependent antagonist of TRPM2channels[J].Neuropharmacology,2004,47(3):450-460.
[4]Saleh SN,Albert AP,Peppiatt CM,et al.AngiotensinⅡactivates two cation conductances with distinct TRPC1 and TRPC6channel properties in rabbit mesenteric artery myocytes[J].J Physiol,2006,577(Pt 2):479-495.
[5]Juszczak GR,Swiergiel AH.Properties of gap junction blockers and their behavioural,cognitive and electrophysiological effects:animal and human studies[J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33(2):181-198.
[6]McCracken CB,Roberts DC.Neuronal gap junctions:expression,function,and implications for behavior[J].International review of neurobiology,2006,73:125-51.
[7]Sohl G,Maxeiner S,Willecke K.Expression and functions of neuronal gap junctions[J].Nat Rev Neurosci,2005,6(3):191-200.
[8]Tran CH,Welsh DG.Current perspective on differential communication in small resistance arteries[J].Can J Physiol pharmacol,2009,87(1):21-28.
[9]Figueroa XF,Isakson BE,Duling BR.Connexins:gaps in our knowledge of vascular function[J].Physiology(Bethesda),2004,19:277-284.
[10]Griffith TM.Endothelium-dependent smooth muscle hyperpolarization:do gap junctions provide a unifying hypothesis[J].Br J Pharmacol,2004,141(6):881-903.
[11]Sandow SL.Factors,fiction and endothelium-derived hyperpolarizing factor[J].Clin Exp Pharmacol Physiol,2004,31(9):563-570.
[12]Jiang ZG,Nuttall AL,Zhao H,et al.Electrical coupling and release of K+from endothelial cells co-mediate AChinduced smooth muscle hyperpolarization in guinea-pig inner ear artery[J].J Physiol,2005,564(Pt 2):475-487.
[13]Figueroa XF,Isakson BE,Duling BR.Vascular gap junctions in hypertension[J].Hypertension,2006,48(5):804-811.
[14]Segal SS.Regulation of blood flow in the microcirculation[J].Microcirculation,2005,12(1):33-45.
[15]陳新燕,司軍強,李麗,等.18β甘草次酸對 Wistar大鼠和自發(fā)性高血壓大鼠腦微動脈平滑肌細胞縫隙連接的影響[J].中國應用生理學雜志,2013,29(2):181-184.
[16]Lindau M,Neher E.Patch-clamp techniques for time-resolved capacitance measurements in single cells[J].Pflugers Arch,1988,411(2):137-146.
[17]de Roos,AD,van Zoelen EJ,Theuvenet AP.Determination of gap junctional intercellular communication by capacitance measurements[J].Pflugers Arch,1996,431(4):556-563.
[18]Harks EG,de Roos AD,Peters PH,et al.Fenamates:a novel class of reversible gap junction blockers[J].J Pharmacol Exp Ther,2001,298(3):1033-1041.
[19]Srinivas M,Spray DC.Closure of gap junction channels by arylaminobenzoates[J].Mol Pharmacol,2003,63(6):1389-1397.
[20]Mese G,Richard G,White TW.Gap junctions:basic structure and function[J].J Invest Dermatol,2007,127(11):2516-2524.
[21]Saltman AE,Aksehirli TO,Valiunas V,et al.Gap junction uncoupling protects the heart against ischemia[J].J Thoracic Cardiovascular Surg,2002,124(2):371-376.

