缺氧誘導滋養細胞自噬參與子癇前期發病的實驗研究*
秦興發,張 華△,漆洪波,陳國慶,馬海霞
(1.重慶醫科大學附屬第一醫院產科 400016;2.廣東省深圳市婦幼保健院婦產科 518000)
子癇前期是重要的妊娠期高血壓疾病之一,目前發病機制仍不明確。自噬是細胞在不利于自身生長的環境下,自我吞噬細胞成分并將其消化成小分子物質,最終供細胞在缺氧、感染等惡劣環境下生長,介導細胞逃逸死亡[1],但過度自噬可導致Ⅱ型程序性細胞死亡[2]。最近有學者研究發現,滋養細胞自噬在重度子癇前期發病機制中發揮著極為關鍵的作用[3],本研究以滋養細胞株HTR-8/SVneo為研究對象,擬觀察缺氧誘導滋養細胞自噬的發生情況,并分析子癇前期胎盤組織中自噬分子的變化,為進一步解釋子癇前期發病機制提供新的理論依據。
1 材料與方法
1.1 材料 滋養細胞株HTR-8/SVneo由重慶醫科大學細胞與組織工作研究室提供。胎牛血清為杭州四季青有限公司產品,PI染料為江蘇碧云天生物技術有限公司產品,RPMI-1640為美國GIBIO公司生產,PCR引物由大連生工合成。SP免疫組織化學檢測試劑盒、DAB顯色試劑盒均購自北京中山生物有限公司,LC3-Ⅱ兔抗人一抗購自美國Santa Cruz公司。激光共聚焦顯微鏡為日本Olympus產品,PCR相關儀器為美國Bio-Rad公司產品。
1.2 方法
1.2.1 細胞分組與缺氧培養 滋養細胞株HTR-8/SVneo采用含10%胎牛血清的RPMI-1640培養液進行培養,使用0.25%胰酶進行消化傳代。細胞分為3組:正常氧濃度組(20%O2、5%CO2、75%N2);低氧濃度Ⅰ組(8%O2、5%CO2、87%N2);低氧濃度Ⅱ組(2%O2、5%CO2、93%N2),培養48h。
1.2.2 激光共聚焦顯微鏡檢測 將滋養細胞株HTR-8/SV-neo接種于蓋玻片上置于6孔板中,制作細胞玻片,細胞分組同1.2.1,培養48h后收集細胞,后經固定后加入磷酸鹽緩沖液(PBS)稀釋的兔抗人LC3-Ⅱ單克隆抗體(一抗1∶500),4℃冰箱孵育過夜,次日清洗后加入FITC標記的山羊抗兔IgG(二抗1∶200),室溫避光孵育30min,用10g/mL吖啶橙染液和Rnase A室溫下染色細胞30min,置于激光共聚焦顯微鏡下觀察。
1.2.3 Q-PCR檢測LC3-Ⅱ mRNA的表達 細胞培養48h后提取各組 HTR-8/SVneo細胞的總 RNA,按 RT試劑盒說明書反轉錄為cDNA后,應用Q-PCR技術檢測LC3-Ⅱ mRNA的表達情況。LC3-Ⅱ基因的引物序列:上游5′-CAG GAG ACG TTC GCG ATG AAA TTG TCA-3′;下游5′-TGA CAA TTT CAT CGC GGA CGT CTC CTG-3′。內參β-actin引物序列:上游5′-ATG GAA GCT GCT GGA ATC CAT-3′;下游5′-CCT TGC TCA TAC GGT CAG CAA TAC-3′。反應總體系20μL,運用2-ΔΔCt法進行數據分析。
1.2.4 胎盤組織LC3-Ⅱ免疫組織化學染色 選擇30例重度子癇前期患者胎盤,年齡21~34歲,均于孕34~36周采取剖宮產術終止妊娠,另取30例社會因素行剖宮產術足月妊娠孕婦作為實驗對照組,年齡24~37歲;術中胎兒娩出后,即取胎盤組織用于石蠟包埋后切片,進行常規HE染色與SP法免疫組化染色,其中PBS代替一抗作為陰性對照,LC3-Ⅱ一抗濃度為1∶200,山羊抗兔二抗濃度為1∶300。結果評判采用Fromowitz綜合評分法,根據細胞質黃色顆粒的量,每張切片在高倍鏡下隨機盲取5個視野,共計數1 000個滋養細胞中的陽性細胞數量。
1.3 統計學處理 采用SAS9.1統計軟件進行分析,計量資料采用表示,組間比較采用單因素方差分析,計數資料率表示,組間比較采用χ2檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 激光共聚焦顯微鏡檢測結果 正常氧濃度組HTR-8/SVneo細胞在激光共聚焦顯微鏡下見細胞大小均勻,染色一致,均呈現綠色,而低氧濃度Ⅰ組則見27%細胞呈現出細胞質紅色,部分細胞質內可見點狀紅色,而低氧濃度Ⅱ組可見79%細胞質均呈現紅色,部分細胞質內可見大片點狀染色物質,見圖1。
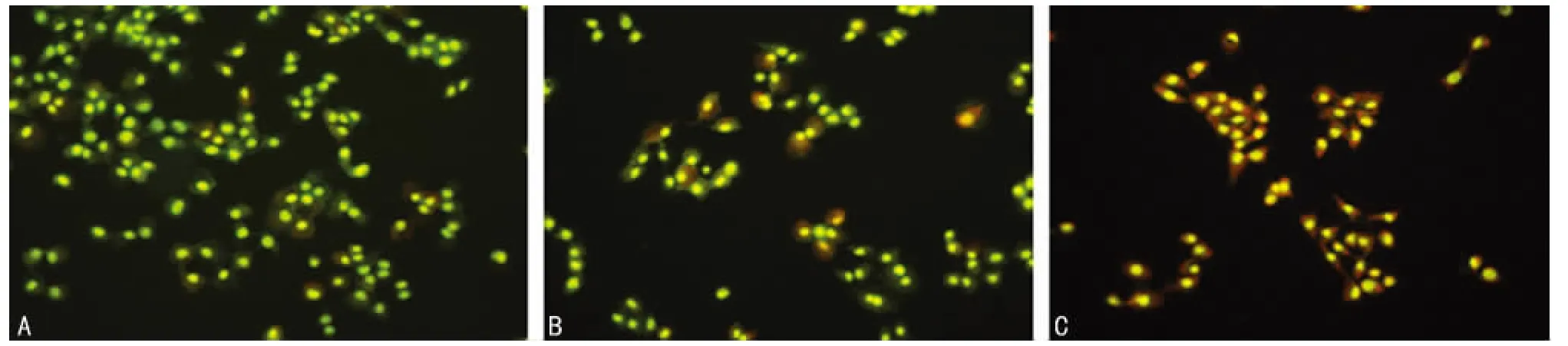
圖1 不同氧濃度處理48h后的HTR-8/SVneo細胞(激光共聚焦×300)
2.2 PCR結果 低氧濃度組HTR-8/SVneo細胞經處理48h后,細胞內LC3-Ⅱ mRNA表達量明顯上升,均高于正常氧濃度組,其中低氧濃度Ⅱ組細胞的LC3-ⅡmRNA低于低氧濃度Ⅰ組,差異有無統計學意義(P<0.05),見圖2。
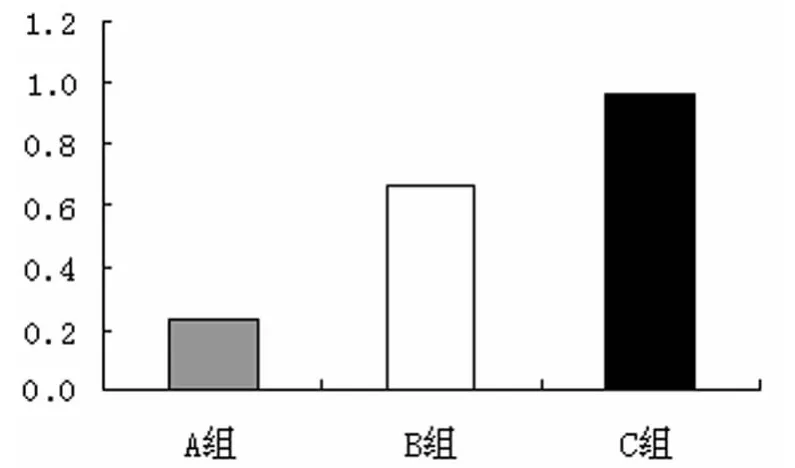
圖2 3組HTR-8/SVneo細胞經處理48h后LC3-ⅡmRNA相對表達量

圖3 正常胎盤與重度子癇前期滋養細胞Beclin-1、LC3-Ⅱ免疫組織化學染色
2.3 免疫組織化學結果 LC3-Ⅱ蛋白在實驗組胎盤組織中表達明顯,棕黃色顆粒遍布于兩種滋養細胞的細胞質中,部分呈黃色塊狀分布,而細胞核內無表達(圖3),少部分正常滋養細胞胞質中,偶見有淡黃色顆粒形成,實驗組整體陽性率為67.12%,而對照組整體陽性率為9.14%,兩者差異有統計學意義(P<0.05)。
3 討 論
作為妊娠期常見并發癥之一,子癇前期常造成孕產婦全身各細胞、組織、器官嚴重甚至不可逆轉的損傷,從而誘發心力衰竭、腎衰竭、全身多器官功能衰竭等嚴重的并發癥,臨床治療效果并不理想,常嚴重影響孕產婦和圍生兒的健康[4-6]。因此,預防和治療子癇前期是產科的重要任務之一,為制訂子癇前期更好的臨床防治策略,必須明確其發病機制。本病發病機制復雜,伴隨諸多基因及相應蛋白表達變化,其明確的發病機理至今仍未完全闡明,目前對子癇前期發病機制的解釋主要集中在滋養細胞病變,但滋養細胞受到何種因素的影響,發生何種具體病變從而參與子癇前期發病,目前仍然值得深入研究。
自噬是最近發現的細胞自我吞噬現象,研究表明,自噬現象與多種疾病均有密切關系,因而自噬已成為醫學科學與生命科學研究領域的研究熱點之一[7]。在不利于細胞生長的環境中,如缺氧、藥物影響,電離輻射等環境下,細胞能啟動程序性自我吞噬,即表達大量自噬相關分子,在細胞內形成自噬膜狀結構,不斷的包圍細胞質內物質,最終形成類圓形的雙層膜結構體,即自噬體。自噬體與細胞質內溶酶體結合,形成自噬性溶酶體,后者包括諸多消化酶,遂將自噬體所吞噬的自我物質在細胞內消化,將蛋白質等生命大分子降解為小分子物質,此類小分子物質為細胞在緊急情況下提供內源性直接生化反應的底物,包括產生能量,合成新的生命分子,以使細胞在不利于生長的環境中繼續保持生命[8]。然而,當自噬程度過于嚴重,細胞自我吞噬的物質過多或吞噬了細胞生長關鍵分子時,將導致細胞死亡,因此自噬對細胞而言,具有雙重生物學作用,即適度自噬有利于細胞生長,而過度自噬則可導致細胞死亡。
本研究表明,體外缺氧可誘導滋養細胞發生自噬,而重度子癇前期胎盤組織中,也可檢出明顯的自噬發生率。大量研究表明,子癇前期患者胎盤缺血缺氧嚴重,細胞常處于氧化應激狀態,而這種環境可促使自噬發生[9-10]。當胎盤絨毛膜滋養細胞發生過度自噬時,將導致滋養細胞死亡。由于滋養細胞一半遺傳物質來源于父系,因此細胞自噬所致的細胞裂解,將釋放出具有父源性物質的部分,而這部分物質作為抗原,可誘發母體免疫反應,從而使母體血液淋巴細胞被激活,進而攻擊滋養細胞,滋養細胞受損將導致胎盤著床過淺、微細梗死灶、小面積早剝點等。從而導致胎兒與母體營養交換障礙,進而導致子癇前期患者胎兒宮內一系列發育問題。本研究應用激光共聚焦檢測的方法,證實了經缺氧處理后,滋養細胞可發生明顯的自噬,這也為自噬與子癇前期發病關系的研究奠定了一定的理論基礎。
激光共聚焦顯微檢測是自噬研究的重要手段[10-11],由于自噬體本身呈現酸性,與細胞質物質及細胞質內其他亞細胞器的酸堿度不一致,因此在染料染色后所呈現的顏色也不同,而普通熒光顯微鏡波長有限,不能很好地區分兩種不同顏色的物質成分,因而也不能很好地將自噬體與亞細胞器等正常結構區別開來,而激光共聚焦顯微檢測則很好地解決了這一問題。同時LC3是自噬的標志物之一,其中LC3-Ⅰ是LC3的細胞質形式,通過翻譯后修飾轉變為LC3-Ⅱ。而LC3-Ⅱ是自噬體膜構成的關鍵蛋白[12-13]。本研究激光共聚焦顯微檢測結果與LC3-Ⅱ的PCR測試結果相符合。因此,激光共聚焦顯微檢測是自噬研究的重要形態學方法之一,隨著自噬研究的廣泛開展,激光共聚焦顯微檢測也必將得到進一步發展及價值體現,將激光共聚焦顯微檢測技術應用于子癇前期重度的發病機理和病理生理的應用研究,有利于探索子癇前期重度的臨床診療效果。
[1]Abounit K,Scarabelli TM,McCauley RB.Autophagy in mammalian cells[J].World J Biol Chem,2012,3(1):1-6.
[2]Lockshin RA,Zakeri Z.Apoptosis,autophagy,and more[J].Int J Biochem Cell Biol,2004,36(12):2405-2419.
[3]陳國慶,張華,漆洪波,等.滋養細胞自噬在重度子癇前期發病中的作用與分子機制[J].細胞與分子免疫學雜志,2012,28(3):294-296.
[4]Papageorghiou AT,Yu CK,Bindra R,et al.Multicenter screening for pre-eclampsia and fetal growth restriction by transvaginal uterine artery Doppler at 23weeks of gestation[J].Ultrasound Obstet Gynecol,2001,18(2):441-449.
[5]Plasencia W,Maiz N,Bonino S,et al.Uterine artery Doppler at 11+0to 13+6weeks in the prediction of preeclampsia[J].Ultrasound Obstet Gynecol 2007,30(4):742-749.
[6]Yu CK,Smith GC,Papageorghiou AT,et al.An integrated model for the prediction of pre-eclampsia using maternal factors and uterine artery Doppler velocimetry in unselected low-risk women[J].Am J Obstet Gynecol,2005,193(1):429-436.
[7]Caldwell SA,Jackson SR,Shahriari KS,et al.Nutrient sensor O-GlcNAc transferase regulates breast cancer tumorigenesis through targeting of the oncogenic transcription factor FoxM1[J].Oncogene,2010,29(19):2831-2842.
[8]Yu J,Deshmukh H,Payton JE,et al.Array-based comparative genomic hybridization identifies CDK4and FOXM1alterations as independent predictors of survival in malignant peripheral nerve sheath tumor[J].Clin Cancer Res,2011,17(7):1924-1934.
[9]Matsui Y,Takagi H,Qu X,et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1in mediating autophagy[J].Circ Res,2007,100(6):914-922.
[10]Indelicato M,Pucci B,Schito L,et al.Role of hypoxia and autophagy in MDA-MB-231invasiveness[J].J Cell Physiol,2010,223(2):359-368.
[11]Han J,Pan XY,Xu Y,et al.Curcumin induces autophagy to protect vascular endothelial cell survival from oxidative stress damage[J].Autophagy,2012,8(5):812-825.
[12]Nakatogawa H,Ichimura Y,Ohsumi Y.Atg8,a ubiquitinlike protein required for autophagosome formation,mediates membrane tethering and hemifusion[J].Cell,2007,130(6):165-178.
[13]Kimura S,Noda T,Yoshimori T.Dissection of the autophagosome maturation process by a novel reporter protein,tandem fluorescent-tagged LC3[J].Autophagy,2007,3(5):452-460.

