黏度法測聚乙二醇相對分子質量的幾種情況討論*
何明 朱金 羅振揚
(南京林業大學理學院 江蘇南京210037)
在高分子結構與性能研究中,高分子的相對分子質量是不可缺少的重要參數。黏度法是聚合物相對分子質量測量的一種經典方法,也是高分子專業一個重要的本科實驗內容[1-3]。高分子溶液的黏度一方面與聚合物的相對分子質量有關,另一方面也決定于聚合物分子的結構形態和在溶劑中的擴張程度,因此,可用于研究高分子在溶液中的形態、高分子鏈的無擾尺寸、高分子鏈的柔性程度、支化高分子的支化程度、高分子與溶劑分子的相互作用以及高分子與高分子之間的相互作用等[4-5]。用烏氏(Ubbelohde)黏度計測量高分子相對分子質量的方法具有設備簡單、操作方便、適用范圍大、精確度好的優點,是常用的實驗技術,已在生產和科研中得到廣泛的應用[4-6]。
黏度法測定聚合物相對分子質量是基于Mark-Houwink經驗公式
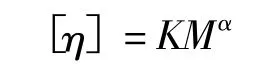
式中K、α為兩個常數,[η]稱為特性黏數,表示單位質量聚合物在溶液中所占流體力學體積的大小。分子鏈線團的密度越大、尺寸越大,則其內摩擦阻力越大,聚合物溶液表現出來的黏度就越大。對于給定聚合物在給定的溶劑和溫度下,特性黏數[η]的數值僅由給定聚合物的相對分子質量決定。實驗中可根據 Huggins方程和 Kraemer方程,分別用 ηsp/ρ-ρ和 lnηr/ρ-ρ作圖外推至 ρ→0,從共同截距可得[η][1-2]。然而研究發現,根據 ηsp/ρ-ρ和 lnηr/ρ-ρ外推至 ρ→0 作圖的方法很難得到兩條恰好交于縱坐標的直線,甚至出現兩條直線平行的情況。這種情況往往給學生和實驗教師造成困擾,因此不斷有學者對此問題進行討論[7-11]。本文根據近幾年用黏度法測聚乙二醇相對分子質量積累的學生實驗數據,就實驗中常出現的普遍問題進行數據分析與討論,并尋找問題來源,以期對黏度法測相對分子質量的理論學習和實驗教學有所幫助。
1 實驗方法
1.1 主要儀器及藥品
電子分析天平(BSA-224S-CW,北京賽多利斯儀器系統有限公司),烏氏黏度計(南京亞榮科學器材有限公司),恒溫水浴(可控溫25℃ ±0.1,南京桑力電子設備廠),聚乙二醇(PEG)10000(廣東汕頭市西隴化工廠)。
1.2 實驗方法
鑒于不同高分子實驗教材中選取的聚乙二醇濃度各有不同,因此本文分別用2g,4g,6g,8g,10g聚乙二醇樣品定容250mL水溶液作為實驗樣品進行對比。在25℃恒溫水浴中,用烏氏黏度計測出10mL PEG溶液的流出時間t,然后逐漸加入2mL,3mL,5mL,5mL,10mL水,測出不同濃度溶液的流出時間,最后測出10mL純水流出的時間t0。每次測試重復3次,時間誤差小于0.2s,取其平均值。
2 結果與討論
聚乙二醇溶液和純溶劑——水的流出時間分別用t和t0表示。根據高分子稀溶液理論,可以認為溶液的密度與純溶劑的密度相等,忽略動能校正項后,可以得到不同濃度溶液的相對黏度,再擬合直線延長交于縱坐標。下面根據實驗中廣泛出現的6種典型圖形,結合實驗數據進行分析,并討論其中的影響因素。
(1) ηsp/ρ-ρ與 lnηr/ρ-ρ完全無線性關系。
稱取2g聚乙二醇,配置成樣品。實驗表明其ηsp/ρ-ρ與lnηr/ρ-ρ的數據沒有線性關系,難以擬合成直線,且PEG溶液在黏度計中的流出時間基本在100s以下,ηr值多數小于1.2(ηr值小于1.2意味著溶液階梯稀釋的濃度的流出時間差較小)。根據Huggins方程和 Kraemer方程可知,只有在 ηr=1.2 ~2.0范圍內,ηsp/ρ-ρ和 lnηr/ρ-ρ才為線性關系[5]。因此,雖然黏度法的適用體系是高分子稀溶液體系,即分子鏈間不存在任何物理和化學作用的孤立線團狀態,但極稀溶液狀態在黏度法實驗測量中易產生誤差,造成結果偏差較大,數據難以擬合成直線方程。因此,必須通過提高溶液濃度以增加溶液流出時間差。
(2) ηsp/ρ-ρ與 lnηr/ρ-ρ交點在縱坐標左右兩側。
用同一支黏度計,將聚乙二醇樣品的質量濃度提高至4g/250mL(16g/L)后,從表1可以看出該樣品(PEG-4g-1)的流出時間和ηr值有所增加,圖1中顯示ηsp/ρ-ρ與lnηr/ρ-ρ兩條擬合直線的斜率相反,但并沒有相交于縱坐標軸,而是相交于縱坐標軸左側。以及增比黏度
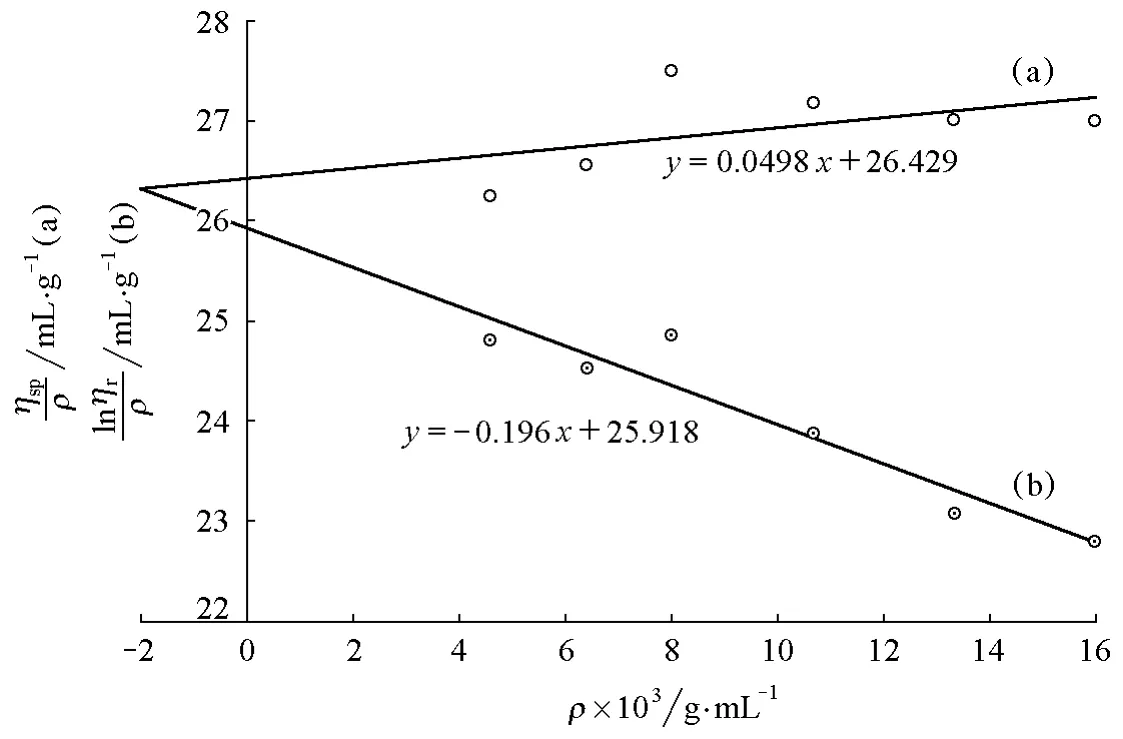
圖1 PEG-4g-1 的 ηsp/ρ-ρ(a)和 lnηr/ρ-ρ(b)圖
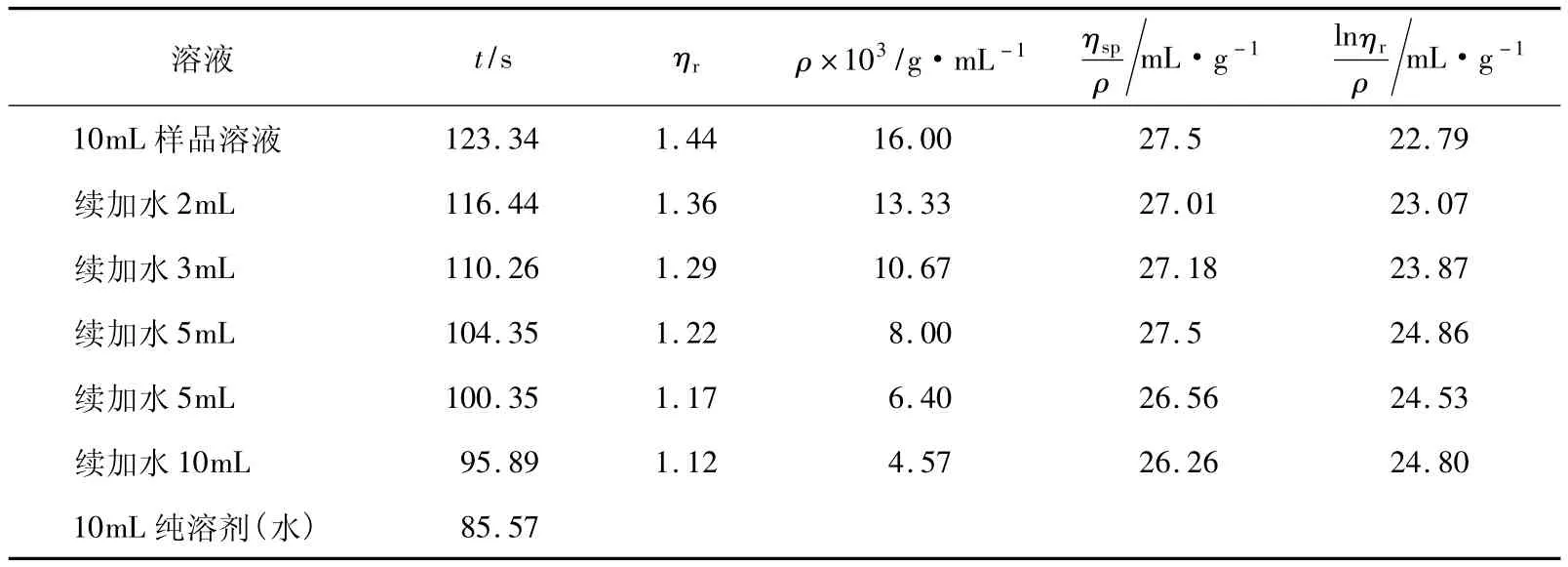
表1 PEG-4g-1的實驗相關參數
由于表1中仍然有ηr值小于1.2的數據,因此我們嘗試仍用同一黏度計,繼續增加聚乙二醇質量濃度至6g/250mL(24g/L)與8g/250mL(32g/L)(分別對應樣品(PEG-6g)和樣品(PEG-8g))。圖2所示的是樣品PEG-6g的擬合圖形,可以看出ηsp/ρ-ρ與lnηr/ρ-ρ的兩條擬合直線雖然也相交于縱坐標軸左側,但與圖1相比較交點更接近于縱坐標軸,其對應的實驗數據列于表2。
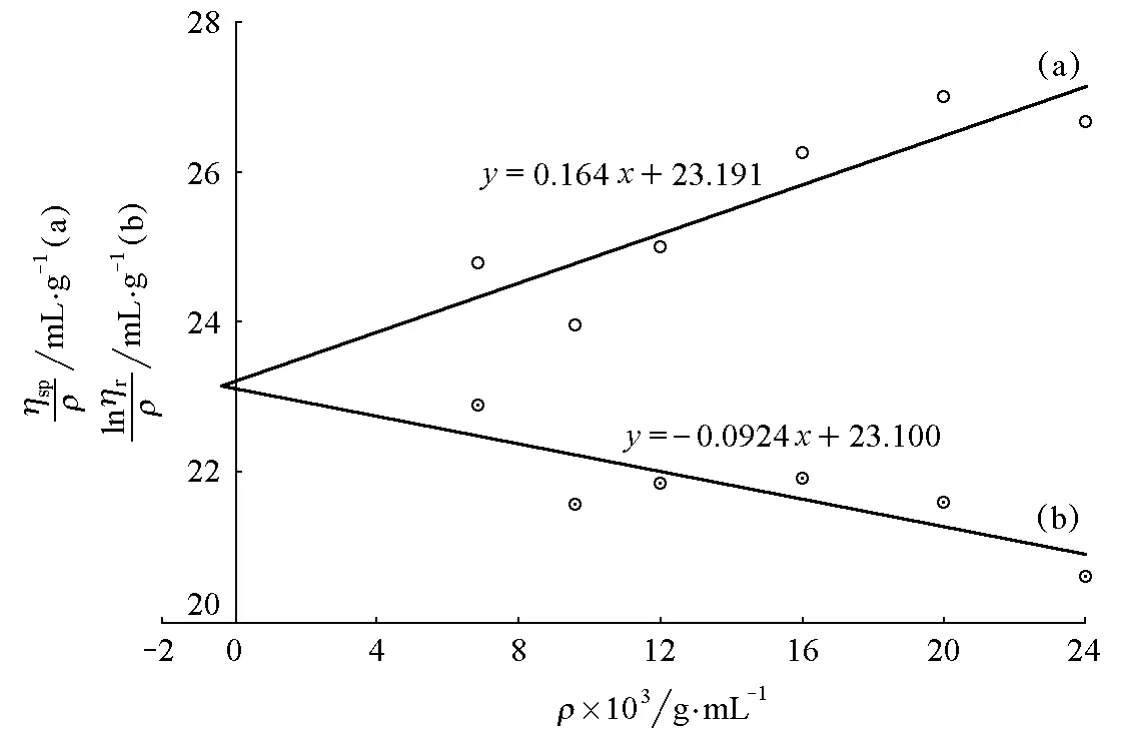
圖2 PEG-6g 的 ηsp/ρ-ρ(a)和 lnηr/ρ-ρ(b)圖
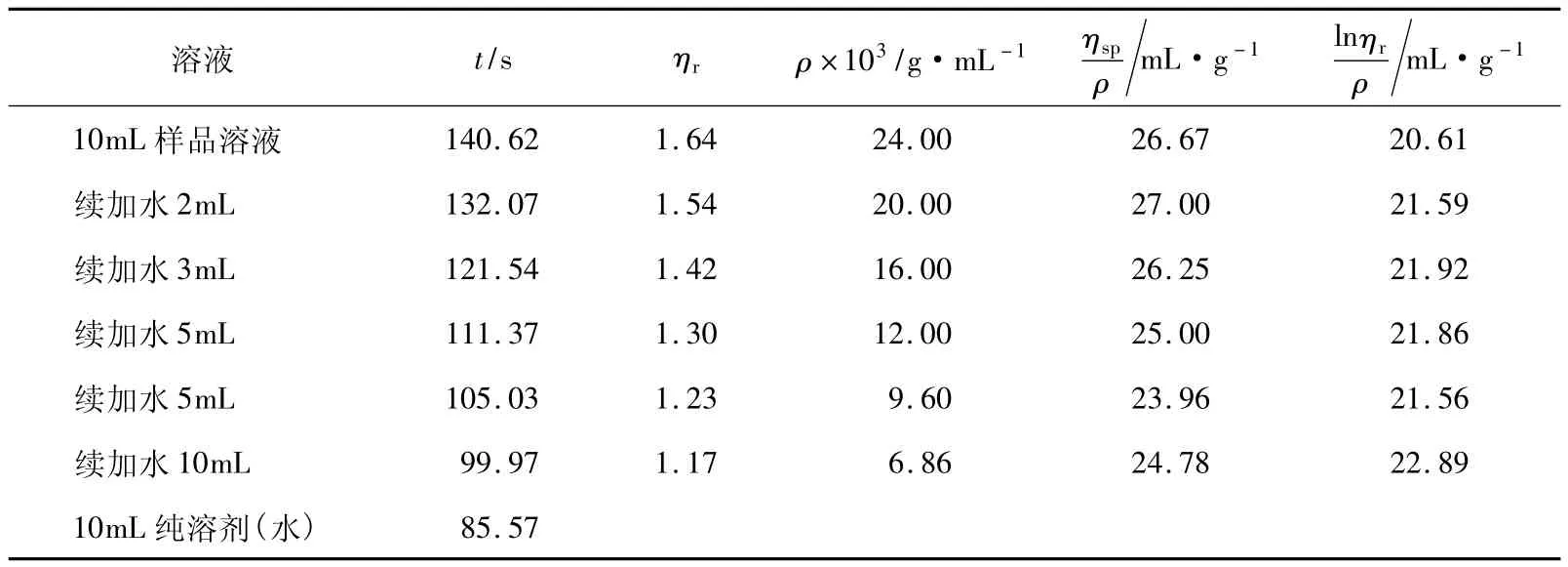
表2 PEG-6g的實驗相關參數
圖3所示的樣品PEG-8g的擬合圖形顯示ηsp/ρ-ρ與lnηr/ρ-ρ的兩條擬合直線相交于縱坐標軸右側,其對應的實驗數據列于表3。與樣品PEG-6g的數據相比,雖然ηr值均大于1.2,但結果并不理想。這是因為隨著樣品濃度的提高,該溶液體系已逐漸從稀溶液向亞濃溶液狀態轉變,即達到臨界交疊濃度[12],高分子鏈將發生纏結,此時特性黏數[η]已不能代表單一高分子鏈在溶液中的流體力學體積,與黏度法測量的理論基礎不相符。因此,可以通過此現象粗略判斷聚乙二醇樣品水溶液狀態下的臨界交疊濃度ρ*。此外,從這個趨勢也可以推斷出,當樣品的質量濃度在24g/L與32g/L之間時,兩條擬合直線可以相交于縱坐標軸。
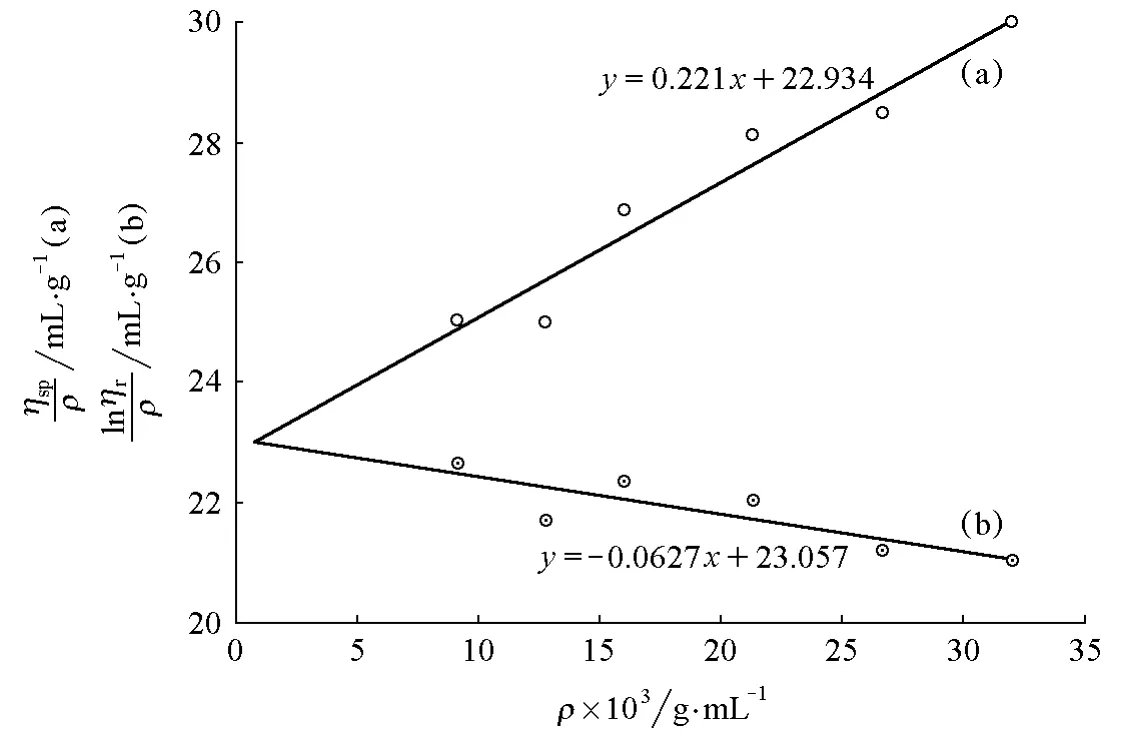
圖3 PEG-8g 的 ηsp/ρ-ρ(a)和 lnηr/ρ-ρ(b)圖
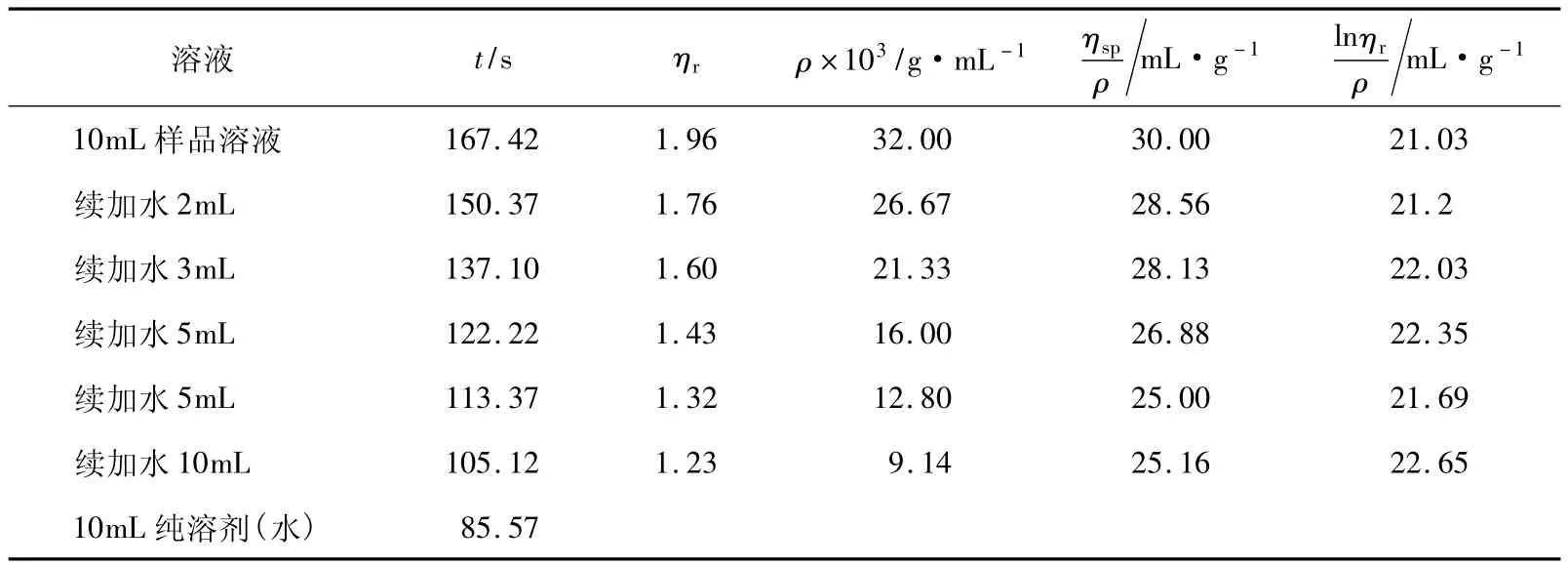
表3 PEG-8g的實驗相關參數
在實驗教學中,對于上述交點不在縱坐標軸的情況,若要通過特性黏數[η]計算黏均相對分子質量,一般取ηsp/ρ-ρ直線的截距作為[η]更合適,因為Huggins方程在推導時只用了一次近似處理。分別對上述樣品截取縱坐標后,根據Mark-Houwink方程計算,樣品PEG-4g-1,PEG-6g和PEG-8g的黏均相對分子質量分別為28682,22098和21417。雖然黏均相對分子質量和實際樣品PEG標注的數均相對分子質量沒有實際對比意義,但是考慮到PEG一般是通過離子聚合來制備,其相對分子質量分布相對比較均一,因此用樣品PEG-6g與PEG-8g得到的黏均相對分子質量更接近實際值。綜合擬合圖形情況,可以認為24g/L的聚乙二醇溶液比較適合黏度法測量。
(3) ηsp/ρ-ρ和 lnηr/ρ-ρ兩直線同向。
在實驗過程中,我們還會發現一些ηsp/ρ-ρ與lnηr/ρ-ρ擬合直線同向的情況。圖4所示的是另一組16g/L聚乙二醇配置的樣品(PEG-4g-2)用不同黏度計得到的實驗擬合圖形。可以看出,ηsp/ρ-ρ與lnηr/ρ-ρ兩條擬合直線斜率同為正值,與圖1完全不同。
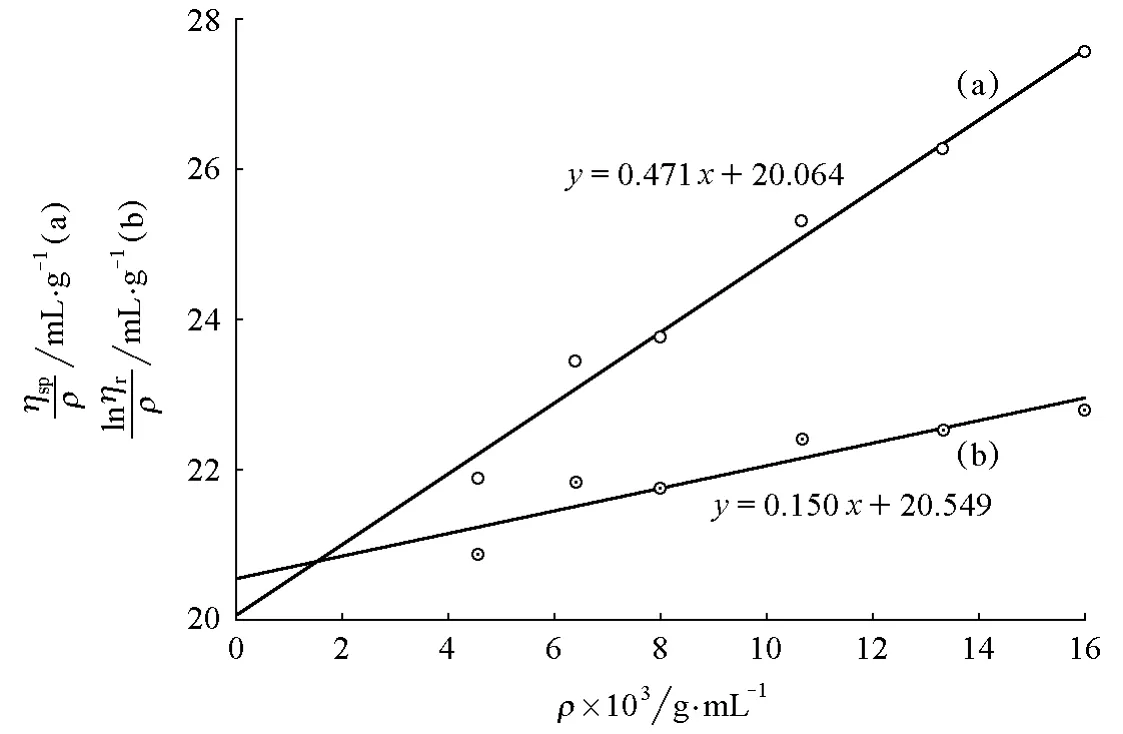
圖4 PEG-4g-2 的 ηsp/ρ-ρ(a)和 lnηr/ρ-ρ(b)圖
用表4中的實驗數據與相同質量濃度樣品的表1做比較,可知該黏度計的溶劑流出時間t0增大,這是由于毛細管直徑變小或長度增加等因素造成的,但其出現ηr小于1.2的數據點并沒有減少,這是造成實驗結果偏差的主要原因。
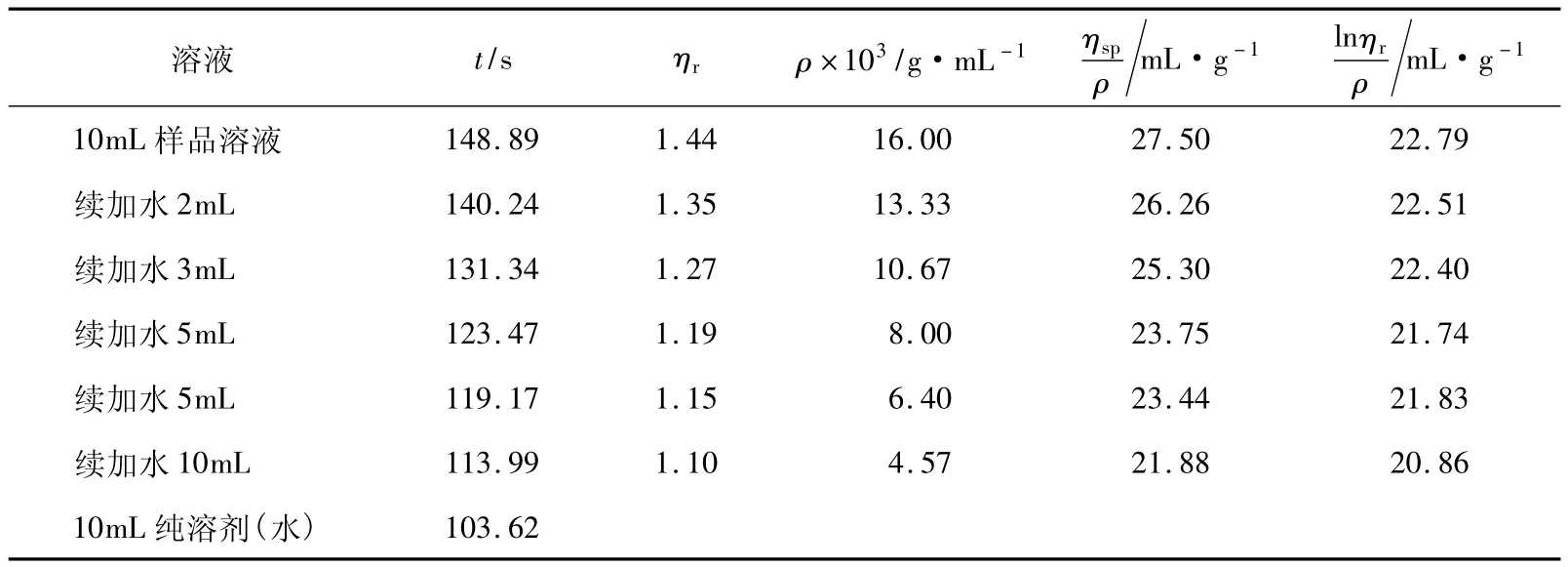
表4 PEG-4g-2的實驗相關參數
這里再選擇一組16g/L聚乙二醇配置的樣品(PEG-4g-3)進行分析。從圖5可看出,ηsp/ρ-ρ與lnηr/ρ-ρ兩條擬合直線趨勢與圖4相反,斜率同為負值,且在很大的范圍內不相交。從表5的樣品(PEG-4g-3)數據來看,出現ηr小于1.2的數據點也沒有減少,而在這兩種擬合直線趨勢不正確的情況下是無法計算得到樣品相對分子質量的。
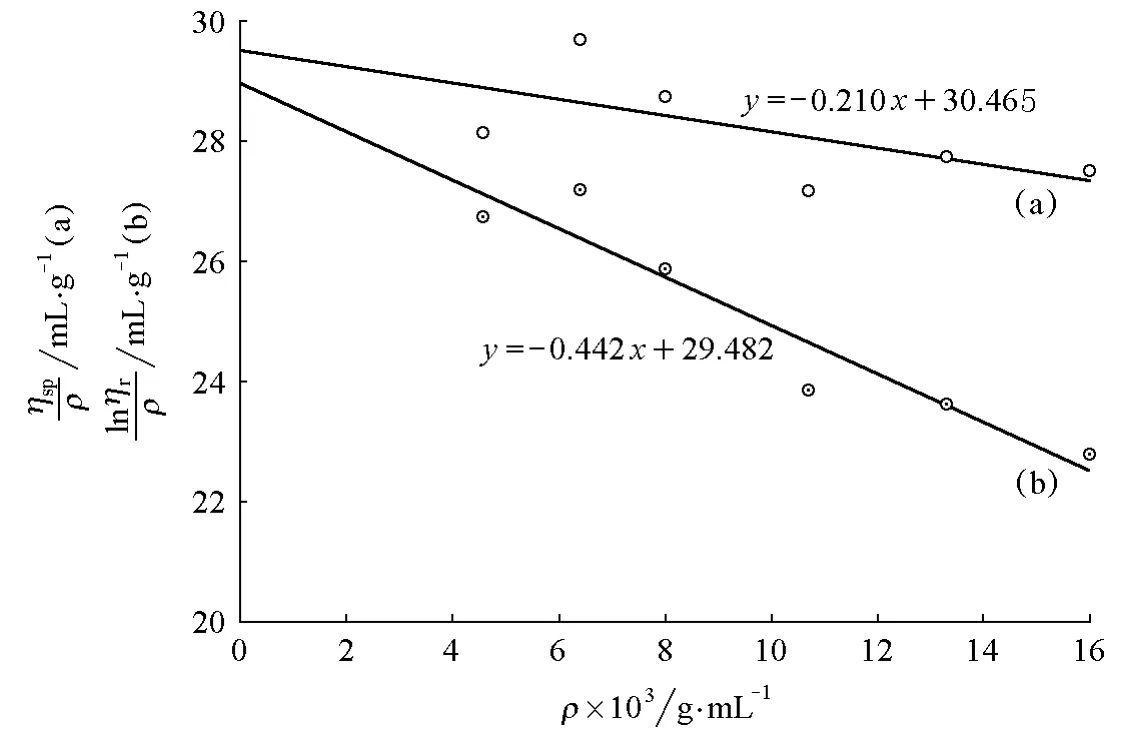
圖5 PEG-4g-3 的 ηsp/ρ-ρ(a)和 lnηr/ρ-ρ(b)圖
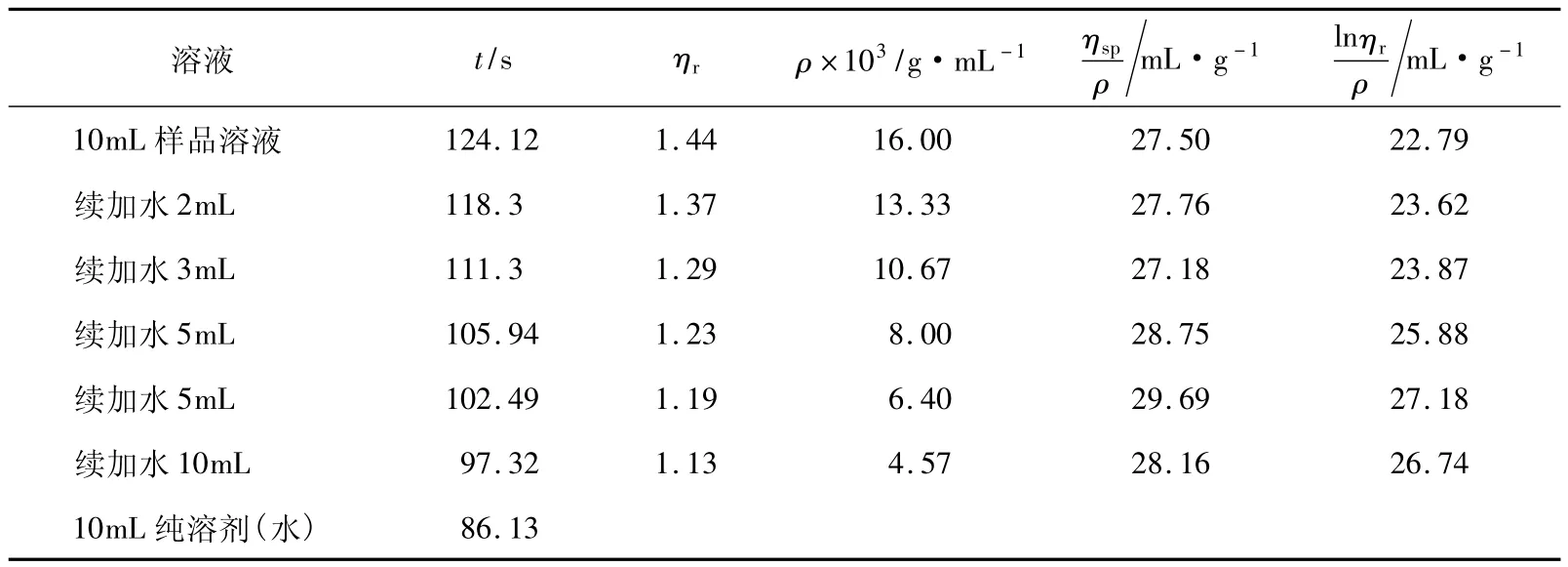
表5 PEG-4g-3的實驗相關參數
從上述對于PEG-4g的3種圖形情況的討論,以及對更多的實驗樣本比較發現,擬合直線同向的情況幾乎都發生在16g/L或更低的質量濃度,因此可以認為,這是由于所選取聚乙二醇樣品的相對分子質量在測量范圍(104~107)的下限,樣品質量濃度過低,很容易出現ηr值小于1.2的數據點較多的情況,這是造成實驗偏差的主要原因。此外,從對泊肅葉(Poiseuille)方程精細動能校正的相關研究可以發現,在進行修正計算時,儀器常數X值對計算結果有較大影響,而X的值主要依賴于黏度計的V,R和h等參數[6-7],所以黏度計的構造因素對實驗結果也不可忽視。
因此,在濃度范圍選擇不當的情況下,黏度計的構造因素以及其他非系統誤差(如黏度計每次濃度切換時毛細管的清洗,黏度計垂直程度等)對實驗結果的影響就能表現出來,而擬合圖形對實驗數據非常敏感,測量數據中往往小數點后一位的變化就會改變圖形趨勢,造成難以分析的情況。
3 結語
在高分子物理實驗中,通過黏度法測量PEG相對分子質量時,對應不同級別相對分子質量的樣品,需要確定其合適的樣品濃度范圍,使ηr值盡可能大于1.2,但也不能高于臨界交疊質量濃度ρ*到達亞濃溶液狀態,這是得到ηsp/ρ-ρ與lnηr/ρ-ρ擬合直線正確趨勢的關鍵原因;同時也影響到擬合直線的交點位置,若擬合直線交點離縱坐標越近,計算得到的相對分子質量就越準確。當選擇測定濃度較低時,黏度計的構造因素以及其他非系統誤差對溶液流出時間的影響會比較明顯,呈現的結果也較為復雜,使相對分子質量難以測定。
[1]錢人元.高聚物的分子量測定.北京:科學出版社,1958
[2]張美珍.聚合物研究方法.北京:中國輕工業出版社,2008
[3]馮開才,李谷,符若文.高分子物理實驗.北京:化學工業出版社,2004
[4]金日光,華幼卿.高分子物理.第3版.北京:化學工業出版社,2007
[5]符若文,李谷,馮開才.高分子物理.北京:化學工業出版社,2005
[6]楊菊萍.高分子學報,2001(6):783
[7]施良和.化學通報,1962,1(1):45
[8]楊海洋,朱平平,任峰,等.化學通報,1999(5):47
[9]楊海洋,李浩,朱平平,等.化學通報,2002(9):631
[10]項尚林,余人同,王庭慰,等.實驗科學與技術,2009,7(5):37
[11]王麗梅.化學工程師,2010,179(8):18
[12]何曼君.高分子物理.第3版.上海:復旦大學出版社,2011

