以結構為主線結合對比法進行雜環化合物教學*
王蘭英 王云俠 李劍利
(西北大學化學與材料科學學院 陜西西安710069)
雜環化合物是數目最龐大的一類有機化合物。許多藥物屬于雜環化合物,對生命體系起著非常重要的作用。雜環化合物也是專業基礎課程有機化學中的一部分重要內容。但一方面由于有機化合物中的雜環化合物種類繁多,數目龐大,內容龐雜,學生一看到雜環就很抵觸;另一方面,目前在“少而精,博而通”的教學理念引導下[1],雜環化合物內容要在3~4學時內講授完。再加上介紹雜環化合物章節的時候已經接近期末考試,此時學生急于復習考試,焦躁不安,聽課效果很差。在這樣的背景下,如何在短時間內教給學生學習方法,使抽象枯燥,難于理解、記憶和接受的內容變得生動有趣且易于接受和掌握,并讓學生掌握雜環化合物的相關知識,提高課堂教學效果,是承擔有機化學課程教學的教師值得思考和研究的課題。下面在筆者多年教學實踐的基礎上,談談加強和提高雜環化合物教學的一些理念和做法。
1 以結構決定性質的理念分析雜環化合物的通性
雜環化合物可分為有芳香性的和沒有芳香性的。有芳香性的雜環化合物,即芳香雜環化合物,是雜環化合物章節主要討論的內容。芳香雜環化合物種類繁多,數目龐大,可根據環大小、雜原子的多少、單環和稠環等來分類[2-5]。針對數目龐大的芳香雜環化合物,理出一條思路并找出一種方法進行行之有效的教學,是雜環化合物教學的關鍵。多年的科學研究和教學研究使我們清楚地知道,進行化學科學研究的一個基本理念或核心思想是“結構決定性質,性質是結構的表現形式”。因此,我們在授課時從結構入手,分析雜環及其衍生物的結構特點,并由此推測其基本性質和反應。這樣就把種類繁多的雜環化合物的性質與反應有機地聯系起來,從總體上把握住雜環化合物的本質,舉例說明如下。
1.1 五元雜環吡咯、呋喃和噻吩的結構以及性質和反應
首先畫出吡咯、呋喃和噻吩的結構(圖1)。學生可以從圖中看出環上的原子均為sp2雜化,沒有雜化的p軌道側面重疊、交蓋形成了閉環共軛體系,屬平面結構;再向學生強調環上雜原子N,O和S的p軌道上各有一對電子參與環的共軛,π電子數為6,符合4n+2規則,具有芳香性,與比較熟悉的典型的芳香族化合物苯類似。由此可推測五元雜環化合物吡咯、呋喃和噻吩的主要反應是親電取代反應。
再將苯與五元雜環化合物吡咯、呋喃和噻吩的結構進行比較,苯屬6個原子6個電子的π體系,而吡咯、呋喃和噻吩屬于5個原子6個π電子的π體系,即五元雜環吡咯、呋喃和噻吩π電子云密度較苯大,所以五元雜環吡咯、呋喃和噻吩的親電取代活性大于苯。
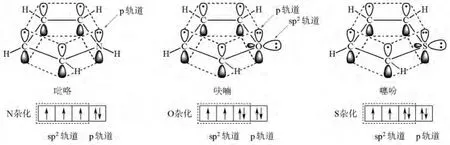
圖1 吡咯、呋喃和噻吩的結構
接著我們和學生一起對吡咯、呋喃和噻吩中雜原子的電負性大小、半徑大小進行分析:雜原子的吸電子誘導大小順序為:O>N>S;給電子共軛為:N>O>S;綜合結果:N貢獻電子最多,O其次,S最少。因此,五元雜環化合物吡咯、呋喃和噻吩的電子云密度及親電取代活性大小為:吡咯>呋喃>噻吩。
此外,由于吡咯環中N的沒有雜化的p軌道上有一對電子參與了環的共軛,使N周圍電子云密度降低,N—H的σ電子偏向N,所以吡咯環中N上的H有弱酸性,因此,吡咯能與強堿(如NaNH2,KNH2,RMgX)或堿金屬(如Na、K)作用。
1.2 五元雜環咪唑、噁唑和噻唑的結構以及性質和反應
咪唑、噁唑和噻唑實際上就是吡咯、呋喃和噻吩的3號CH分別換成N后得到的(圖2)。3個唑類化合物也有芳香性,能發生親電取代反應,只是由于N的電負性比C大,造成這3個唑類化合物咪唑、噁唑和噻唑的π電子云密度分別小于五元雜環吡咯、呋喃和噻吩,那么相應的親電取代反應活性也小。此外,學生還可從結構上看出,3個唑類化合物的3號N的sp2雜化軌道上有一對電子沒有參與環的共軛,既可提供接受質子的位置,也可提供接受帶正電的碳實體的位置,所以咪唑、噁唑和噻唑既具有堿性,又具有親核性。此外,咪唑1號N的給電子共軛和3號N的吸電子誘導使得咪唑的酸性大于吡咯,因此,咪唑既具有酸性,也具有堿性;也因此咪唑分子間能形成氫鍵。

圖2 咪唑、噁唑和噻唑的結構
1.3 六元雜環吡啶的結構以及性質和反應
吡啶的結構見圖3,它與苯相似,具有芳香性,可以發生親電取代反應;但由于N的吸電子作用,使其π電子云密度小于苯,其親電取代反應活性也小于苯,類似于硝基苯,所以吡啶只能在3位和5位發生鹵代、硝化和磺化,不易發生傅氏烷基化和傅氏酰基化反應。再由于N的吸電子共軛作用,使吡啶環2,4,6位的碳帶部分正電荷,若吡啶環2,4,6位上有鹵素,則鹵素容易被親核試劑取代,甚至吡啶環2位的負氫也可被強親核試劑取代(Chichibabin反應)。若吡啶環2,4,6位上有烷基,則烷基的α-H具有活性,其活性與甲基酮的α-H相同,能在酸或堿催化下發生親核反應(如與醛、酮發生親核加成,與鹵代烷發生親核取代,與羧酸酯發生親核加成-消除反應等)。從吡啶的結構中還可看出,吡啶N的sp2雜化軌道上有一對電子沒有參與環的共軛,因此,既可與質子結合而顯堿性,又可與帶正電的碳實體結合而具有親核性。

圖3 吡啶的結構
1.4 雜環親電取代反應中間體的結構以及親電取代反應位置選擇性[4-5]
用與推測取代苯發生親電取代反應的區域選擇性的相同方法,根據雜環親電取代反應所得中間體結構,可以推出親電取代反應主要發生在雜環上的位置(位置選擇性)。例如:對于五元單雜環吡咯、呋喃和噻吩(圖4),環中有兩種碳,當親電試劑進攻2位時,得到的中間體是由3個極限式結構共振雜化成的;而進攻3位得到的中間體則是由兩個極限式結構共振雜化成的。參與共振雜化的極限式結構越多,電子或電荷離域范圍越廣,雜化體中間體正離子越穩定。穩定的中間體正離子的過渡態勢能低,活化能小,反應速率快,因此五元單雜環親電取代反應容易在2位發生。

圖4 五元單雜環化合物的親電取代反應及其中間體結構

圖5 苯并五元雜環化合物的親電取代反應及其中間體結構
對于苯并五元雜環苯并呋喃、苯并噻吩和吲哚(圖5),親電試劑進攻電子云密度較大的五元雜環。當進攻2位時,得到帶有完整苯環的穩定極限式結構只有一個;而進攻3位時,得到帶有完整苯環的穩定極限式結構有兩個。參與共振雜化的穩定的極限式結構越多,中間體正離子越穩定;但中間體正離子穩定性還與正電荷所在原子的電負性大小有關。氧原子電負性大,氧原子帶正電荷很不穩定,氧原子相鄰碳原子上帶正電荷也不太穩定;氮原子電負性小,8電子的帶正電荷的氮相對于8電子的帶正電荷的氧來說是比較穩定的;而帶正電荷的硫原子的穩定性介于帶正電荷的氧和帶正電荷的氮之間。因此,苯并呋喃在2位上發生反應;吲哚在3位上發生反應;苯并噻吩可以在2位和3位上發生反應,而主要是在3位上發生反應。
對于喹啉(圖6),親電試劑進攻電子云密度較大的苯環。當親電試劑進攻5位或8位時,得到的中間體中有兩個能保留吡啶環穩定的極限式結構;而進攻6位或7位時,中間體中只有一個能保留吡啶環穩定的極限式結構參與共振。前者的中間體正離子穩定,過渡態勢能低,所以喹啉的親電取代反應發生在5位和8位。
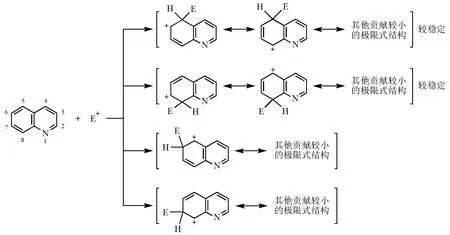
圖6 喹啉的親電取代反應及其中間體結構
同樣,我們根據反應得到的中間體結構的穩定性可以推出:吡啶的親電取代反應發生在3位和5位,親核取代發生在2位、4位和6位;喹啉的親核取代反應發生在電子云密度較小的吡啶環上,而且在2位和4位發生。
通過以上分析,學生可以根據雜環化合物的結構特點,對雜環化合物的性質、反應活性和反應的位置選擇性有較系統的了解,為后面的深入學習打下良好的基礎。
2 以對比法幫助學生理解雜環化合物的反應
對比法是將兩個或兩個以上的事物進行比較,找出其相同點和不同點,通過比較、鑒別,把不同的事物從內部有機地聯系起來。在教學中運用對比法可以使學生在面對新知識的學習時,能有效擺脫陌生感,迅速找到輕松入門的途徑,使抽象枯燥的難于理解、記憶和接受的內容變得生動有趣,一目了然且易于接受和掌握,提高學習效率;還可以加深學生對知識的理解,使概念明晰化,理論廣延化,點狀知識連續化,平面知識立體化。
在雜環化合物教學中,我們以結構為基礎,采用對比法組織教學,以電子結構理論分析、引導學生通過熟悉的化合物結構來推測雜環化合物具有的化學反應性。現舉例說明如下:
(1)與苯對比,分析五元雜環、六元雜環以及稠雜環的反應性。
通過分析雜環化合物與苯在結構上的差異,可知:①雜環化合物親電取代活性順序為:五元雜環吡咯、呋喃和噻吩>苯>吡啶,從而推出五元雜環吡咯、呋喃和噻吩能在較溫和的條件下發生親電取代反應,而六元雜環吡啶需在較強烈的條件下才能發生親電取代反應。如噻吩在室溫下即能與硫酸發生磺化反應,但在相同條件下苯卻很難發生反應;吡咯在低溫下,用比較溫和的非質子硝化試劑(如硝酸乙酰酯)可以進行硝化,苯需要用混酸(如濃硝酸加濃硫酸)在50℃才能反應,而吡啶用混酸在300℃反應1天才能得到極少的3-硝化吡啶。相反,吡啶不容易發生親電取代反應,但容易發生親核取代反應。如吡啶與氨基鈉反應生成2-氨基吡啶(即發生了2位負氫被氨基取代的親核取代反應)。②苯環上電子云分布均勻,其一元取代產物只有一種。而雜環類化合物由于環中含有雜原子,導致其上的電子云分布不均勻,故反應產物不只一種。如苯硝化其一元取代產物只有硝基苯,而吡咯硝化除了得到主要產物2-硝基吡咯外,還得到少量的3-硝基吡咯。
通過比較五元雜環(吡咯、呋喃和噻吩)、六元雜環(吡啶)和苯的結構,學生可進一步推測稠雜環化合物的反應性。當五元雜環與苯環稠合形成雜環化合物時,由于五元雜環的電子云密度大于苯環,所以其親電取代反應發生在五元雜環上;當六元雜環與苯環稠合形成雜環化合物時,六元雜環的電子云密度低于苯環,其親電取代反應發生在苯環上,而其親核取代反應發生在雜環上。如吲哚硝化發生在吡咯環上,得到3-硝基吲哚;喹啉硝化發生在苯環上,得到5-硝基喹啉和8-硝基喹啉;喹啉與氨基鈉在液氨中反應,得到2-氨基喹啉和4-氨基喹啉。
(2)對不同雜環化合物進行對比,分析各個雜環化合物的反應性。
比較各雜環化合物結構上的差異,以找出各雜環化合物的反應特點。例如五元雜環吡咯、呋喃和噻吩,由于所含雜原子不同,使其電子云密度大小不同,根據1.1節分析,其親電取代活性大小順序為:吡咯>呋喃>噻吩;它們與三氟乙酐反應的相對反應速率是:吡咯5.5×107,呋喃1.4×102,噻吩1。又如:五元雜環吡咯、呋喃和噻吩的芳香性(穩定性)不同,由離域能大小(吡咯87.8kJ/mol,噻吩121.3kJ/mol,呋喃66.9kJ/mol)可知,吡咯和噻吩的芳香性較強,而呋喃的芳香性較弱,具有一定的共軛二烯的性質,與親雙烯體可發生典型的共軛二烯反應——Diels-Alder反應,吡咯、噻吩則不容易發生此反應。再如:吡咯與吡啶分子中都含有一個雜原子N,且都是sp2雜化,吡咯中氮原子上的一對電子處于沒有雜化的p軌道上,參與了環的共軛,故不能與質子或帶正電荷的實體碳結合,沒有明顯的堿性、親核性;而吡啶氮原子上的一對電子處于sp2雜化軌道上,沒有參與環的共軛,可與質子及帶正電荷的實體碳結合,顯示堿性和親核性。
總之,可以在雜環化合物的教學中,以結構為主線,結合對比教學法進行講授,使學生在有限的時間里掌握學習雜環化合物的方法,培養學生運用所學知識分析問題和解決問題的能力。
[1]黑恩成.化工高等教育,2010(2):1
[2]李艷梅,趙圣印,王蘭英.有機化學.北京:科學出版社,2011
[3]胡宏紋.有機化學.第3版.北京:高等教育出版社,2006
[4]邢其毅,徐瑞秋,周政,等.有機化學.第2版.北京:高等教育出版社,2000
[5]VollhardtKPC,SchoreNE.有機化學:結構與功能.第4版.戴立信,席振峰,王梅祥等譯.北京:化學工業出版社,2006

