有機化合物的氫化學位移和酸度關系探討
樂傳俊 壯亞峰 朱少萍 葉文玲
(常州工學院理學院化工系 江蘇常州213022)
酸是化學中的重要概念。在現有的有機化學教材中,往往把酸放在序言中概述。實際上,酸概念在烯烴加成、醇脫水和縮合等有機反應中有著廣泛的應用,但由于有機化合物在結構上與無機化合物有著顯著的差別,從而導致學習者對該概念在有機化合物上的理解和應用產生了困難。如用pH能方便地區分各類無機化合物的酸性大小,但卻不能用pH對所有有機化合物進行酸度量。常見的酸滴定、電位測定法等也只能測量少量一定濃度范圍的有機化合物的pH。因此,目前主要采用酸離解常數(pKa)來表征有機化合物的酸強度。但從一些無機物的pH和pKa來看,兩者是存在差異的,故從理論上說,雖然目前廣泛采用pKa來度量有機化合物的酸度,但用其表達有機化合物的酸值是不準確的。
核磁共振波譜技術是解析有機化合物結構的強大工具,在有機化學教學中,我們往往會歸納各類化合物的氫化學位移值范圍,以便記憶和應用。然而,當我們帶著酸概念比較不同結構有機化合物中的一些氫化學位移值時,發現化學位移值大小也能在一定程度上反映出該有機化合物在相應溶劑中的酸性強弱(表1)。
事實上,在一般情況下,有機酸的酸性比醇大,而醇的酸性比烷烴大,相對應的化合物部分的氫化學位移由大變小;因此,有機化合物的氫化學位移和酸性就可能存在著某種關系。
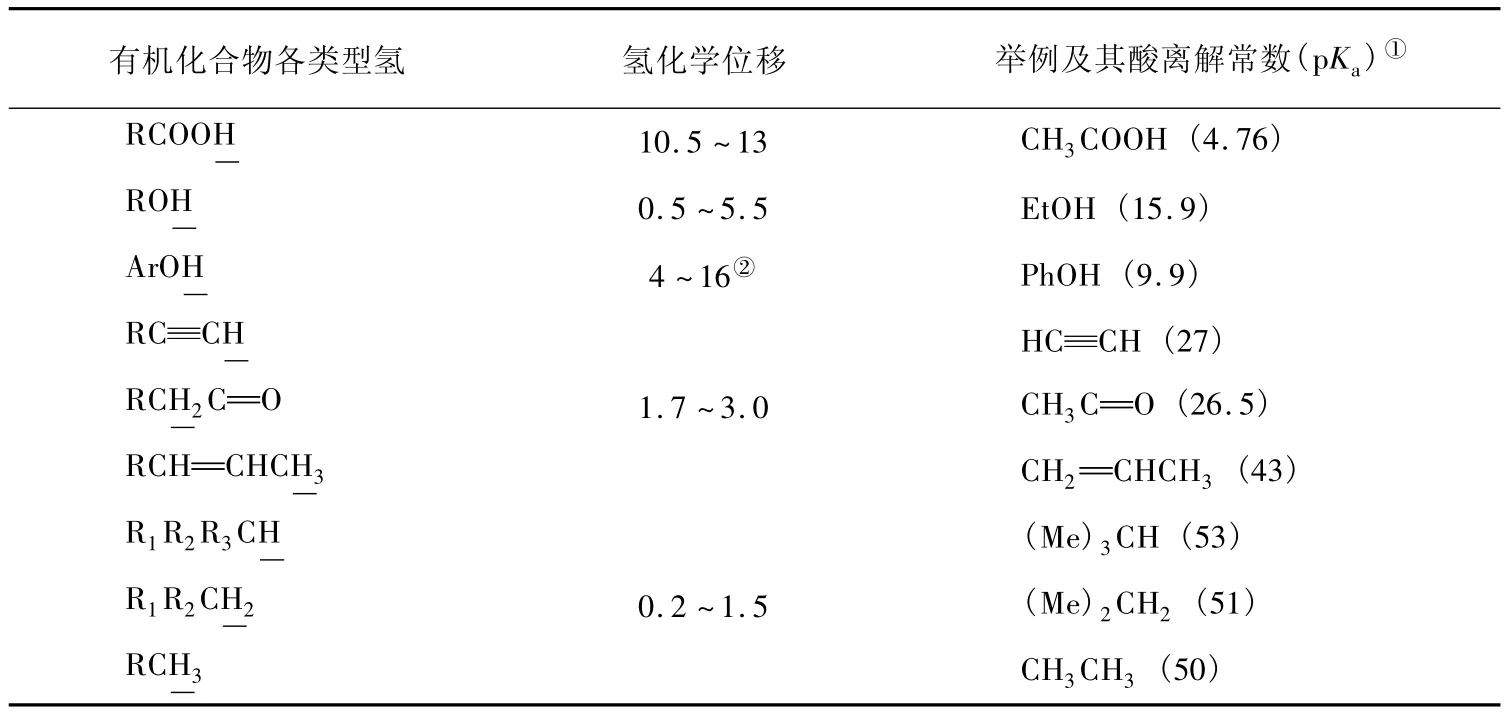
表1 不同類型有機化合物氫的化學位移和酸離解常數
1 理論基礎
為了更好地理解有機化合物中的氫化學位移與其酸性的關系,有必要在這里對相關的知識進行概括。
核磁共振是基于特定原子核在外加磁場作用下發生的共振,即發生能級躍遷,也就是原子核磁矩與外加磁場的夾角會發生變化。這種能級躍遷可以獲取核磁共振信號。在給定的外加磁場中,某種特定的原子核只吸收某一特定頻率射頻場提供的能量,這樣就形成了核磁共振信號。如果僅考慮某一個孤立的原子核如氫核,則該氫核即使在有機分子中分布于不同位置,也只會在核磁共振波譜圖的同一頻率處出現共振信號,這樣就不能區別不同結構環境中的氫核;但外加磁場會受核外電子的影響,不同環境中的核外電子情況不同,使不同環境的核在不同磁場強度處出現信號,即屏蔽效應。為了表示由于屏蔽效應引起的不同環境下的核在各磁場強度處的共振信號,引入了化學位移概念。化學位移是借磁場強度來表達的相對值概念,反映的是共振原子核所處環境的核外電子密度狀況,即屏蔽效應的程度,揭示的是原子所處環境的結構信息。
酸堿理論(如酸堿電離理論和酸堿質子理論)是屬于熱力學范疇的理論。質子理論認為,凡是能給出質子的分子或離子稱為酸,反之為堿;酸堿是成對的,屬共軛關系。對于弱酸,存在著電離平衡,平衡常數表示處于平衡狀態的幾種物質的濃度關系(更確切地說,是活度關系),可以應用化學平衡原理找到衡量酸堿強弱的定量量度(如pH)。而能涵蓋酸堿電離和質子理論的酸堿電子理論能從物質的化學結構組成上揭示其本質,接受電子對的是酸,相反為堿。這樣,化學位移δ和酸堿pH均反映著物質的化學結構信息。因此,可以用化學位移來研究有機化合物的酸堿平衡、酸性等熱力學問題。
2 氫化學位移與酸性關系的探討
下面從基本知識出發推導有機化合物的酸性和特定氫化學位移的定量關系。現假設一個有機化合物HA,其在一定溫度和溶劑下存在以下電離平衡:
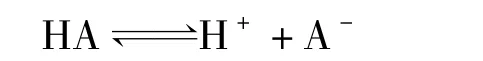
該有機物的電離平衡常數可表達為:
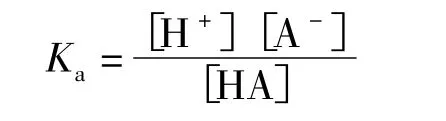
酸離解常數為:
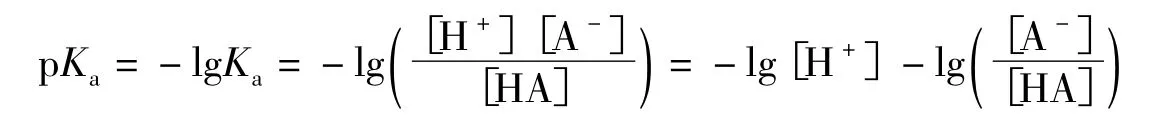
即:
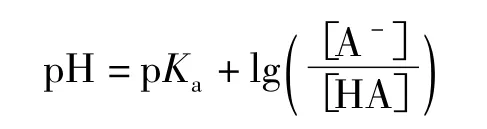
再回到化合物HA在溶液中的氫化學位移上。事實上,在溶液(包括非水溶劑)中測定有機物中某一個氫在核磁共振波譜圖上只顯示一個信號(偶合裂峰只是一個峰的分裂,整體上仍是來源于一個峰),這說明化合物HA的去質子化和A-質子化的交換反應速率是非常快的,以至于核磁共振儀對此測量的響應時間都無法把交換中是否含質子的物質區分開。因此,核磁共振的響應信號峰是在溶劑中與質子作用的各物種在快速質子交換時特定氫的平均響應信號,這個平均響應信號是和溶液中的各質子作用物種濃度相關的,可以用下式來表達:
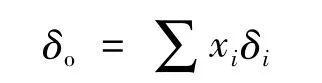
式中,δo是溶液中在核磁共振波譜上顯示的特定氫化學位移,xi和δi分別為溶液中的i物種的質量分數和某一特定氫的化學位移。
對于物質HA來說,有:
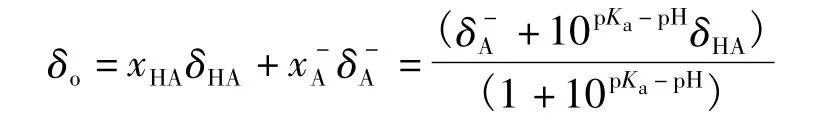
變化上式可得:

從式(1)可以看出,通過核磁共振儀測得HA在溶液中各相關物種中某個特定氫的化學位移值,就可以從pH或pKa計算出其中的另一個值,理論上可以測算出有機化合物中任何氫原子的酸值。由于高分辨率核磁共振儀的使用,使得用該法測定溶液酸值的精度越來越高。如二氯乙酸pKa的測定,首先,在pH分別為0.16和4.28的溶液(H2O/D2O)中可分別測得純HA和A-中非羧基氫的化學位移δHA和;接著用酸度計測得一定條件下的二氯乙酸的pH(也可通過核磁共振滴定獲得,參看文獻[4]);最后根據式(1)可精確求得二氯乙酸在特定條件下的pKa。這種方法可以用來測定超強酸的pKa(參看文獻[5]),從而擴大了該法的適用范圍。式(1)的使用條件和熱力學上的電離平衡常數一樣,受溫度、溶劑和壓力等的影響。
另外,pH和pKa并不是總保持正相關關系的。從式(1)可知δo值處于和間。當時,一定溫度、濃度和溶劑中所測得的pH隨所測得的δo增加而增加;當時則正好相反。因此,用pKa表達有機化合物的酸度是不準確的,存在著差值但由于有機物的電離常數往往很小,所以一定溶液中含量低,這樣就可以近似用pKa代替pH來度量酸度。但從有機反應復雜性來看,細小的酸值差可能會導致反應的進度和選擇性改變,甚至會改變反應的途徑。因此,精確度量酸值或酸離解常數是有意義的,因為熱力學參數pH和pKa從一定意義上說和化學位移δ一樣也能反映物質的結構信息。最后需要說明的是關系式中的特定氫化學位移往往不是對外表現酸性的氫化學位移,但兩者通過化學鍵聯系著;而對外表現酸性的氫的化學位移和其酸性的關系可通過酸堿電子理論和核磁共振原理得到定性解釋,因為酸值pH和化學位移δ屬于不同范疇的概念。
3 結論
有機化合物的pH和pKa是反映物質酸性等理化性質的重要熱力學參數。這兩個參數從嚴格意義上說是有差異的,不能用pKa完全代替pH來判斷有機化合物的酸值。對于指定物質,前者只與溫度有關,后者還與溶液濃度有關,且兩者之間可以通過核磁共振技術分別測量出有機化合物在溶劑中質子化和非質子化物種的特定氫化學位移后,用定量關系式進行轉化。這提供了溝通有機化合物的pH和pKa間關系的一個方法,對理解熱力學的pH或pKa及其內在聯系和表征有機化合物結構參數的化學位移都是很有意義的。這樣有利于學生理解和掌握與有機化學內容相關的知識,培養學生知識遷移和綜合創新能力。
[1]邢其毅,裴偉偉,徐瑞秋,等.基礎有機化學.第2版.北京:高等教育出版社,1993
[2]大連理工大學無機化學教研室.無機化學.第5版.北京:高等教育出版社,2006
[3]GiraltE,ViladrichR,PedrosoE.OrgMagnReson,1983,21(3):208
[4]SzakácsZ,H?geleG.Talanta,2004,62(4):819
[5]SommerJ,RimmelinP,DrakenbergT.JACS,1976,98(9):2671

