CA125、ADA、CEA、CRP聯合檢測對胸腔積液的鑒別診斷價值
劉妍麗 韓 丹 陸蘭英
臨床上胸腔積液十分常見,按積液的性質分為漏出液和滲出液。結核和惡性腫瘤均可引起滲出性的胸腔積液[1],且臨床表現很相近,但兩者的治療方式和預后差別很大,故對兩者的鑒別診斷對提高結核或腫瘤的預后有重大意義[2]。本研究旨在探究良惡性胸腔積液鑒別診斷的方法。
1 材料與方法
1.1 一般資料
良性組共60例,其中男性35例,年齡18~68歲,平均年齡(33.2±11.3)歲;女性25例,年齡20~57歲,平均年齡(34.7±10.4)歲。惡性組共60例,其中男性38例,年齡44~77歲,平均年齡(58.2±11.3)歲;女性22例,年齡46~79歲,平均年齡(62.7±10.4)歲。良性組經痰抗酸染色陽性及胸片檢查,確定肺結核并胸腔積液48例、12例血播型肺結核并胸腔積液。惡性組患者經病理學診斷為腺癌36例、鱗癌8例、腺鱗癌3例、未分型13例。所有患者起病到住院的時間為3個月~5年。
1.2 檢查方法
對120例患者均按常規步驟行胸腔穿刺,收集胸腔積液并立即在-20℃保存,1 h內進行檢測。檢測前室溫融化,CA125,CRP,CEA,ADA 4種指標集中進行檢測。ADA采用酶比色法,用ADA檢測試劑盒進行檢測,檢測范圍為5~100 U/L。CRP用免疫比濁法,用CRP檢測試劑盒,日立7600全自動生化分析儀檢測,檢測范圍為0.5~50 mg/L。CEA與CA125均用Elecsys 2010電化學發光全自動免疫測定儀測定,檢測范圍:CEA為0.05~80 ng/mL,CA125為5~200 U/mL。
1.3 統計學方法

2 結果
2.1 2組CA125、CRP、CEA、ADA的濃度比較
良性組與惡性組的CA125、CRP、CEA、ADA的濃度見表1,良性組的胸腔積液中的ADA和CRP濃度均顯著高于惡性組(P<0.001),而惡性組的胸腔積液中的CEA與CA125則顯著高于良性組(P<0.001)。
2.2 2組4種診斷指標的ROC工作曲線
良性組與惡性組中4種診斷指標的ROC工作曲線如圖1所示,相應的ROC曲線下面積(即診斷價值)如表2所示。其中,CRP、ADA在良性組中的診斷價值較高,CEA、CA125在惡性組中的診斷價值較高。
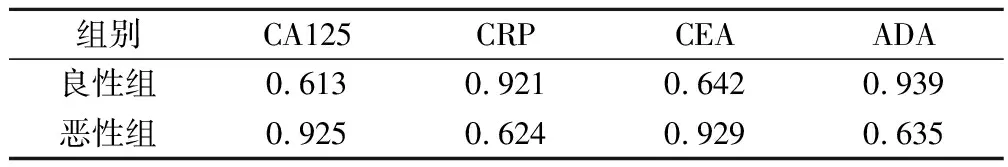
表2 2組CA125、CRP、CEA、ADA的診斷價值比較
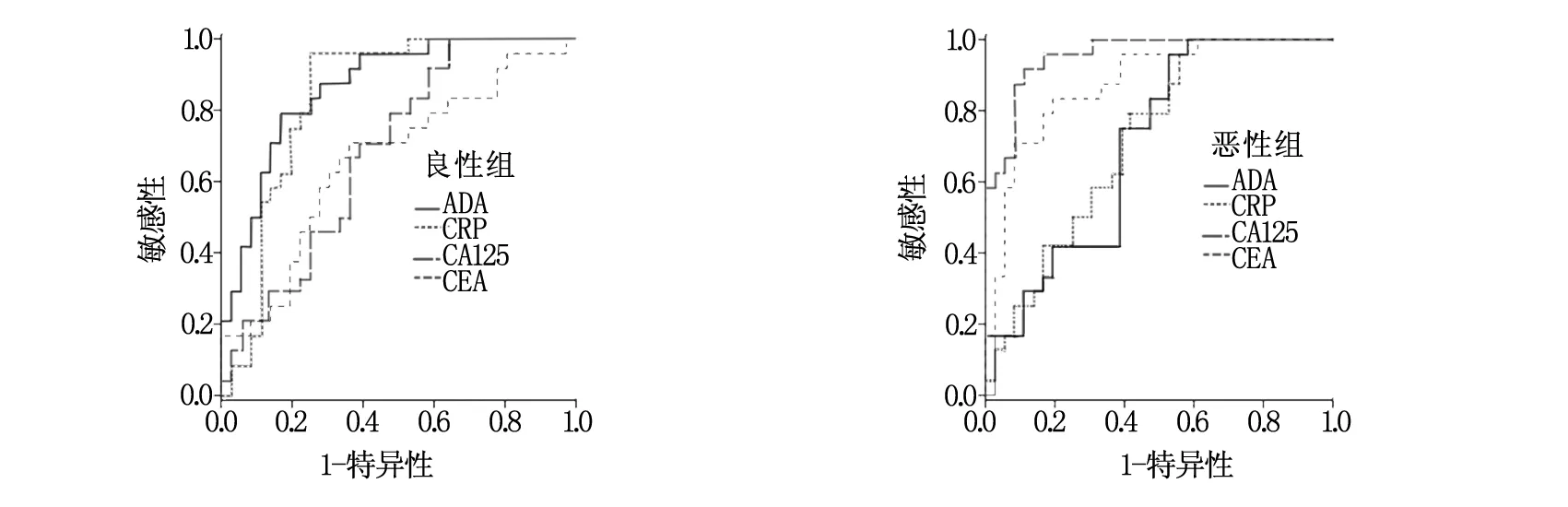
圖1 良性組與惡性組中4種診斷指標的ROC工作曲線
2.3 4種指標的最佳檢測水平及相應的敏感性和特異性
通過Youden指數測驗,得出4種物質的最佳檢測濃度分別為CA125為25.6 U/mL,CEA為10.5 ng/mL,CRP為4.2 mg/L,ADA為35.3 U/L。在良性組中,ADA和CRP的診斷敏感性高于CEA和CA125,且具有統計學意義。診斷特異性則4個指標間的差異均無統計學意義。在惡性組中,ADA、CRP的診斷敏感性高于CEA和CA125。CEA、CA125、ADA的診斷特異性均高于CRP,具有統計學意義。其相應的敏感性與特異性見表3。
2.4 CA125、CRP、CEA、ADA聯合檢測良性組與惡性組的優勢
以CRP>4.2 mg/L,ADA>35.3 U/L為標準診斷良性組的敏感性為85.0%,特異性為89.0%。以CRP>4.2 mg/L,ADA>35.3 U/L聯合CEA<10.5 ng/mL,CA125<25.6 U/mL為標準診斷良性組的敏感性和特異性提高到97.4%,92.9%。以CEA>10.5 ng/mL,CA125>25.6 U/mL為標準診斷惡性組的敏感性為71.2%、86.7%。以CA125>25.6 U/mL,CEA>10.5 ng/mL聯合CRP<4.2 mg/L,ADA<35.3 U/L診斷惡性組的敏感性提高到94.0%、95.5%。

表3 4種物質的最佳檢測水平與敏感性特異性比較/%
3 討論
胸腔積液是臨床上十分常見的癥狀之一,可由全身或胸部疾病引起。常見的胸腔積液主要是由結核性胸膜炎和惡性腫瘤侵犯胸膜引起,但這兩種疾病的治療方法和預后十分不同。目前,酶學和免疫學的指標對上述2種疾病的敏感性和特異性均達不到診斷要求[3]。而常規的金標準即影像學和病理學檢查只有病情發展到中晚期時才能確診。近年來,隨著對腫瘤標志物的深入研究,多項指標聯合鑒別診斷良惡性胸腔積液得到越來越多臨床醫生的關注。本文通過研究60例結核性胸腔積液患者和60例惡性腫瘤患者胸腔積液中的糖鏈抗原125(carcinoembryonic antigen 125,CA125)、C反應蛋白(c-reactive protein,CRP)、癌胚抗原(carcino-embryonicantigen,CEA)和腺苷脫氨酶(adenosine deaminase,ADA)的濃度來探究提高診斷準確度的方法。
結核性胸膜炎主要是由于結核桿菌進入胸膜腔,機體處于超敏狀態而引起的胸膜炎癥性疾病。結核性胸水中有大量的炎癥細胞、效應T細胞、蛋白質和纖維素[4]。
ADA是嘌呤核苷酸的代謝關鍵酶,可以催化脫氧腺苷核苷酸或腺苷核苷酸脫氨轉化為次黃嘌呤核苷酸或次黃嘌呤脫氧核苷酸。ADA酶廣泛分布于全身各組織中,其中以活化的T淋巴細胞含量最為豐富[5],故結核性胸膜炎中胸腔積液的ADA含量的增加與T細胞的活化有關,ADA酶在單核細胞與巨噬細胞中也有高表達的情況。結核性胸腔積液組的ADA升高的原因另一方面也可能與在IV型超敏反應中,單核細胞和巨噬細胞吞噬了結核桿菌,釋放ADA有關[6]。本研究發現良性組的ADA濃度顯著高于惡性組,ADA的最佳檢測水平為35.3 U/L,此時良性組的診斷敏感性為84.9%,特異性為88.6%。
CRP是1種急性期反應蛋白,參與炎癥與損傷反應,在炎癥、感染、外傷和腫瘤組織中,CRP的濃度會明顯增高。本研究也觀察到在炎癥急性期,CRP的濃度急劇上升[7]。結核性胸膜炎由于其多為滲出液且多為肺炎性胸腔積液,CRP的濃度就更加明顯升高。在腫瘤性胸腔積液中由于腫瘤大多浸潤性生長,炎癥程度不明顯,CRP低表達或不表達[8]。良性組的CRP濃度為(15.7±3.9)mg/L,顯著高于惡性組的(7.1±3.6)mg/L。CRP的最佳檢測水平為4.2 mg/L,此時良性組的診斷敏感性為92.3%,特異性為77.2%,故ADA與CRP對鑒別良性胸腔積液有很高的診斷價值。
惡性腫瘤轉移胸膜也會導致胸腔積液,其形成機制是多方面的,最主要的是因為腫瘤直接侵犯臟層和壁層胸膜以及腫瘤細胞侵犯淋巴系統導致淋巴管阻塞、淋巴回流受阻[8]。癌細胞在血道轉移時,會分泌腫瘤標志物沉積在胸腔積液中。目前臨床上常用的胸部腫瘤標志物包括NSE、CEA、CYFRA21-1等。
CEA是最常用的腫瘤標志物之一,其在肺腺癌中陽性率最高[9]。健康人血液中的CEA濃度極低,只有當體內細胞癌變時,其原先被抑制的基因活化,導致腫瘤細胞大量合成并分泌CEA,由于其分子量大,不易進入血液循環,故CEA常常沉積在腫瘤性胸腔積液中,其濃度的升高較血清中CEA濃度的升高快且更顯著[10]。本研究發現惡性組的CEA濃度為(47.6±11.9)U/L,顯著高于良性組的(8.7±4.0)U/L,其最佳檢測水平為10.5 ng/mL,此時惡性組的診斷敏感性為80.2%,特異性為88.9%。
CA125是粘液素族的1種多型糖蛋白,常用于乳腺癌的早期診斷,近年來有報道其在惡性腫瘤侵犯胸膜的過程中會高表達[11-12]。惡性組的CA125濃度為(63.5±15.3)mg/L,顯著高于良性性組的(25.6±14.9)mg/L,與之前的報道相符[13]。說明CEA、CA125對鑒別診斷惡性胸腔積液有很大的臨床價值。CA125的最佳檢測水平為25.6 U/mL,此時惡性組的診斷敏感性為71.3%,特異性為85.6%。
本研究在綜合以上結論的基礎上,對提高鑒別診斷結核性胸腔積液和腫瘤性胸腔積液的方法予以探究,結果發現聯合CA125、CRP、CEA、ADA檢測胸腔積液可以提高良惡性胸腔積液鑒別診斷的敏感度和特異度,可以有效避免傳統單一的項目檢測靈敏度和特異度不夠所帶來的漏診和誤診。在臨床工作中,也有大量其余檢查項目如總蛋白檢測,細胞角蛋白19片段抗原(cytokeratin 19 fragment antigen,CYFRA21-1)、神經元烯醇化酶(neuron specific enolase,NSE)的檢測等[14-15],聯合多種指標是否可以有效地提高鑒別診斷率,還需要進一步的研究與比較。
[1] 陳建清,康美玲,鐘小紅,等.TIL與順鉑治療惡性胸腔積液的療效比較〔J〕.實用癌癥雜志,2011,26(1):53-55.
[2] 朱 江,林飛英.重組人白細胞介素-2聯合順鉑治療癌性胸腔積液的臨床研究〔J〕.中國中西醫結合急救雜志,2010,17(5):314-315.
[3] 唐武平,劉海陽.香菇多糖聯合順鉑治療惡性胸腔積液32例臨床療效觀察〔J〕.實用癌癥雜志,2010,25(3):308-309.
[4] Roberts ME,Neville E,Berrisford RG,et al.Management of a malignant pleural effusion:British Thoracic Society pleural disease guideline 2010〔J〕.Thorax,2010,65(Suppl 2):ii32-ii40.
[5] 王 威,周未花,葉軍輝,等.肺癌和結核性胸腔積液/血清MCP-1及其受體CCR2的測定及臨床意義〔J〕.中國高等醫學教育,2012,2:142-143.
[6] 夏春偉,陳文萍,徐 玲,等.胸腔內注射順鉑及香菇多糖治療老年惡性胸腔積液的臨床觀察〔J〕.臨床肺科雜志,2011,16(2):225-226.
[7] 郝春成,葛曉峰.惡性胸腔積液的治療進展〔J〕.實用腫瘤學雜志,2009,23(2):192-196.
[8] 耿玉敏.良惡性胸腔積液的多指標聯合檢測〔J〕.中國藥業,2012,21(A02):110-111.
[9] Trapé J,Molina R,Sant F,et al.Diagnostic accuracy of tu-mour markers in serous effusions:a validation study〔J〕.Tumor Biology,2012,33(5):1661-1668.
[10] Guohui Z.The Diagnosis Value of Detecting Carbohydrate Antigen and Carcinoembryonic Antigen in Pleural Effusion〔J〕.Hebei Medicine,2011,17(6):117-118.
[11] Shiraha H.O1.1-Epithelial-mesenchymal transition in hepatocellular carcinoma〔J〕.Tumor Biol,2011,32(1):S5-S56.
[12] Huang WC,Tseng CW,Chang KM,et al.Usefulness of tu-mor marker CA-125 serum levels for the follow-up of therapeutic responses in tuberculosis patients with and without serositis〔J〕.Jpn J Infect Dis,2011,64(5):367-372.
[13] Liu J,Duan Y.Saliva:A potential media for disease diagnostics and monitoring〔J〕.Oral Oncology,2012,48(7):569-577.
[14] 方浩徽,郝紅星,黃雋敏,等.結核性與癌性胸腔積液的實驗室檢測比較研究〔J〕.臨床肺科雜志,2010,15(9):1220-1221.
[15] 陶 玉,吉志固,劉玉山,等.液基細胞學在對NSCLC胸腔積液癌細胞ERCC1等基因檢測中的應用〔J〕.實用癌癥雜志,2012,27(4):407-408.

