懸尾實驗實時檢測分析處理系統的研制及初步應用
孫秀萍,張曉萌,盧 聰,李翊華,劉新民
(1.北京協和醫學院比較醫學中心 中國醫學科學院北京協和醫學院實驗動物研究所,衛生部人類疾病比較醫學重點實驗室,國家中醫藥管理局人類動物模型三級實驗室,北京 100021;2. 中國醫學科學院 北京協和醫學院 藥用植物研究所 藥理毒理中心,北京 100193; 3.中國人民公安大學醫院,北京 100038; 4. 北京經緯華清醫療設備科技公司, 北京 100101)
懸尾實驗,是一種抗抑郁藥物活性篩選非常靈敏的行為學檢測方法[1],也可用于抑郁癥病理生理機制的研究[2]。因其快速、方便,自1985年提出至今,被廣為接受和應用[3]。該實驗是將動物頭部向下懸掛,動物為克服不正常體位,首先產生以逃避為導向的劇烈掙扎運動,在經過努力仍不能擺脫困境后,出現間斷性不動,顯示“行為絕望”狀態。絕大多數抗抑郁藥物都可以減少動物懸尾不動時間,而且作用與臨床療效顯著相關[4]。
早期懸尾實驗,以人工計時居多,工作量大,客觀性不強,不能定量分析動物的掙扎強度。隨著信息、計算機、電子工程等技術和藥理學的交叉融合,其自動化測量方法也逐漸發展起來。目前,國內外懸尾測試儀的原理有3種,包括力傳感器、視頻測量及紅外熱釋電原理。國內產品以視頻測量居多。視頻測量原理固然提供了更為直觀的顯示界面,但其測量誤差不容忽視,尤其實驗動物增至2只以上,視頻跟蹤的不準確性尤為突出。紅外熱釋電原理易受外界環境溫度和動物運動狀態的影響,外界環境溫度過低或動物運動遲緩時,經常出現誤判現象,導致結果不準確。國外產品大多為傳感器原理[5]。該原理具有更高的靈敏性和準確性。除“不動時間”這一指標外,動物的掙扎強度也成為抗抑郁藥效的評價指標之一。國外文獻經常用“功”值表示動物的掙扎強度[1]。與視頻及熱釋電原理相比,傳感器原理唯一可通過“功”指標對動物掙扎強度進行定量分析。國外產品均價格不菲,以測試6個樣本為例,價格在15~23萬人民幣不等。盡管國內懸尾儀器市場巨大,但價格因素大大限制了國外產品在國內的廣泛應用。基于以上原因,我們采用力傳感器原理,研制了懸尾實驗實時檢測分析處理系統,在硬件上進行了改進,實現了懸尾實驗的自動化,指標敏感而且豐富,滿足了多樣本篩選的需求,現已應用于抗抑郁藥物的篩選[6]。
1 材料和方法
1.1 硬件研制所需器材
計算機(9寸以上寬屏液晶顯示,奔騰雙核1.6G Hz以上,內存1G以上,40 G及其以上硬盤,三個以上USB接口,刻錄光驅);測試箱(灰白色鋁合金材料);傳感器;數據傳輸線,采集傳輸盒。
1.2 藥品
帕羅西汀 (paroxetine) 購自中國食品藥品檢定研究院提供,批號為100357-200301;丙咪嗪 (imipramine) 購自Sigma 公司,批號為010M01291V。上述藥物均于實驗前用蒸餾水溶解備用。
1.3 實驗動物
雄性C57BL/6J小鼠,20~24 g,SPF級,購自中國醫學科學院醫學實驗動物中心,動物許可證號【SCXK(京)2004-0001】。動物使用許可證號:SYXK( 京) 2008-0019。動物自由進食進水,維持12 h光照和12 h黑暗的晝夜節律。動物適應環境一周進行實驗。
1.4 實驗方法
1.4.1 硬件
采用力傳感器原理,采集動物在懸掛過程中產生的張力變化。懸尾箱的設計,考慮采集自然光線,并最大程度避免周圍環境對動物的干擾。在滿足技術和空間需求的基礎上,實現多樣本檢測。力求實現實驗動物同時懸掛的自動化,節省人力,并保證實驗數據的客觀性。
1.4.2 軟件
建立反映樣本活動程度的數據處理技術以及實時顯示處理技術。實驗完成,每個樣本的實驗數據和分析結果按二進制文件格式保存。除統計樣本的運動參數(運動時間和不動時間)外,本系統提出“功”的概念,采用特定測量方法和數據處理算法,使之真實反應動物的掙扎程度。
1.4.3 懸尾實驗實時檢測分析處理系統評價指標的驗證
1.4.3.1 運動閾值的確認和數據準確性驗證
C57BL/6J雄性小鼠50只,在測試房間適應1 h后,進行懸尾實驗。將膠布粘在小鼠尾端1 cm處,再通過膠布,將小鼠懸掛于傳感器下方的掛鉤上。檢測懸尾箱、懸尾控制單元及計算機的連接,開啟計算機,打開懸尾測試軟件,進行實驗各項參數設置,將實驗時間設為6 min。通過調節固定手柄,降低橫梁,將動物呈半懸掛狀態懸掛,升高橫梁,動物呈完全懸掛狀態,點擊采集按鈕,開始實驗。運動閾值取16.8、26.8、36.8三個值,同時進行人工不動時間的統計。采用SPSS 16.0,首先觀察散點圖是否存在線性相關,再進行相關分析。
1.4.3.2 抗抑郁陽性藥對“不動時間”及“功”指標的驗證
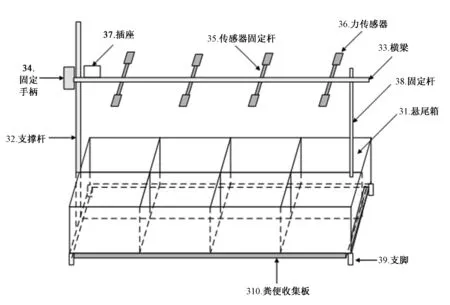
圖1 懸尾實驗實時檢測分析處理系統示意圖
C57BL/6J小鼠隨機分為3組,即空白對照組(蒸餾水)、帕羅西汀組(10 mg/kg)、丙咪嗪組(10 mg/kg),每組10只。各組均給予0.2 mL/10g,單次給藥后 1 h 進行懸尾實驗。實驗方法同1.4.3.1。采用SPSS 16.0統計軟件進行分析。結果以均數±標準誤(mean±SEM)表示。采用單樣本K-S檢驗進行正態分布檢驗,正態分布數據采用單因素方差分析(One-Way ANOVA),不滿足正態分布的數據采用非參數檢驗。組間差異采用LSD(方差齊)或 Games-Howell(方差不齊)法,P< 0.05為有統計學意義。
2 結果
2.1 懸尾實驗實時檢測分析處理系統的建立
2.1.1 測試箱:測試箱由8個懸尾箱組成,尺寸為72× 36×16 cm(長×寬×高)。懸尾箱采用灰白色鋁合金材料制成,尺寸為18×18×16 cm (長×寬×高)。懸尾箱采用四周封閉、頂面開放的形式,既可避免周圍環境干擾,又可采集自然光線。懸尾箱體設計緊湊,節省空間。通過旋轉固定手柄,調節懸尾桿高度,實現多樣本同時懸掛。開始實驗前,將懸尾桿降至最低,動物通過掛鉤懸掛于傳感器下方,此時,動物前肢著地,處于半懸掛狀態。所有動物懸掛完畢后,調節固定手柄,使懸尾桿上升至所需高度,此時,所有動物同時處于完全懸掛狀態。懸尾實驗實時檢測分析處理系統見圖1。
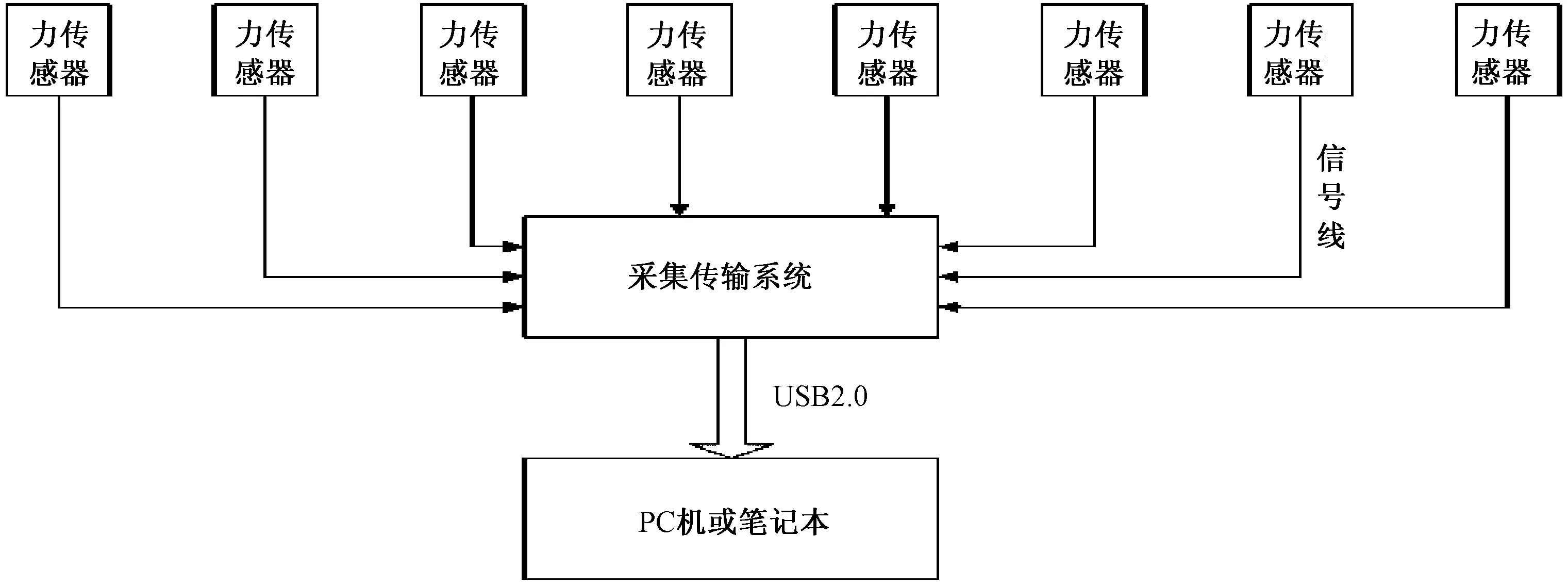
圖2 信號采集傳輸示意圖
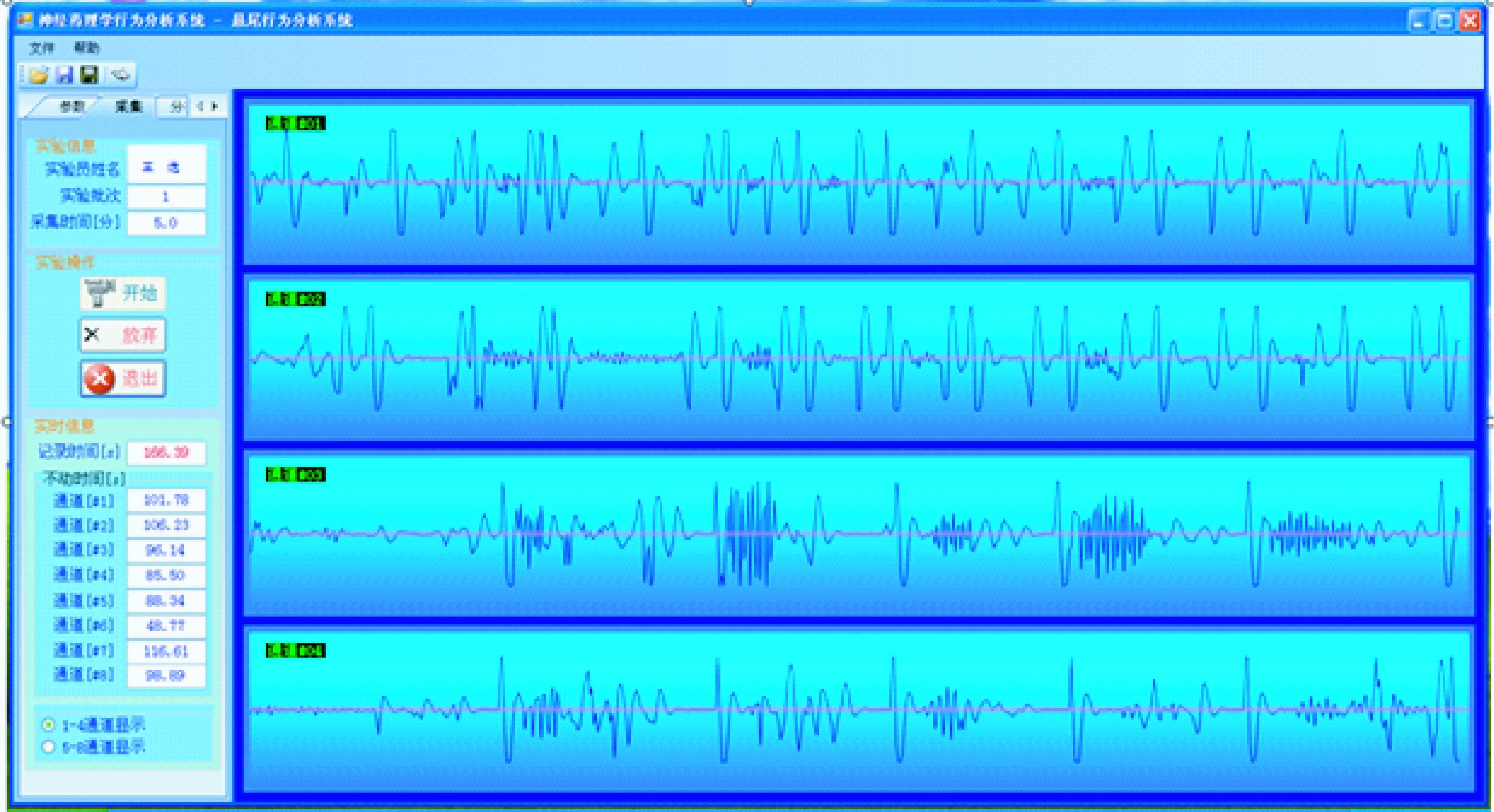
圖3懸尾實驗實時檢測分析處理系統軟件界面圖
2.1.2 傳感器與信號調理單元:8個傳感器固定于橫梁兩側,分別對應8個懸尾箱。傳感器的輸出經過增益調整、濾波處理送至采集傳輸盒。
2.1.3 采集傳輸裝置:
采集傳輸盒采集信號調理單元的輸出信號,數字化后送往PC機。采集傳輸過程如下(圖2)
2.2 軟件設計
軟件系統包括實驗基本參數設置、實驗數據采集和實驗數據分析三大部分。
實驗基本參數設置完成后,開始實驗。軟件讀取數字化處理后的原始數據,以波形及數字的形式,實時顯示八只懸尾小鼠的運動時間和不動時間。本系統除了可以提取傳統指標“不動時間”外,還可以提取“功”值,用于反應動物的掙扎強度。實驗結果以Excel的形式生成,便于用戶在Excel、SPSS、SAS等分析統計軟件中作進一步分析處理。同時,軟件可進行波形回放;閾值可調,從而實現結果再分析。軟件界面圖如圖3所示。
2.3 懸尾實驗實時檢測分析處理系統評價指標的驗證
2.3.1 運動閾值的確認和數據準確性驗證
運動閾值為16.8、26.8、36.8時,人工計時與懸尾測試軟件的相關系數見表1。當運動閾值為26.8時,人機相關系數(person correlation)最大,為0.94,雙側P=0.000,具有統計學意義。對此進行了10余次數據驗證,結果類似,證明懸尾測試軟件能準確真實的反應動物的懸尾行為。

表1 人工計時與懸尾測試軟件的相關系數
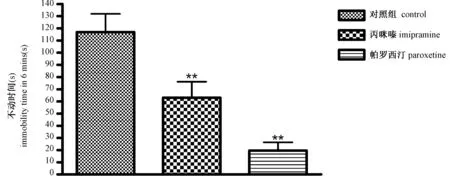
圖4 丙咪嗪、帕羅西汀對懸尾不動時間的影響(mean±SEM,**P < 0.01,與正常組比較)
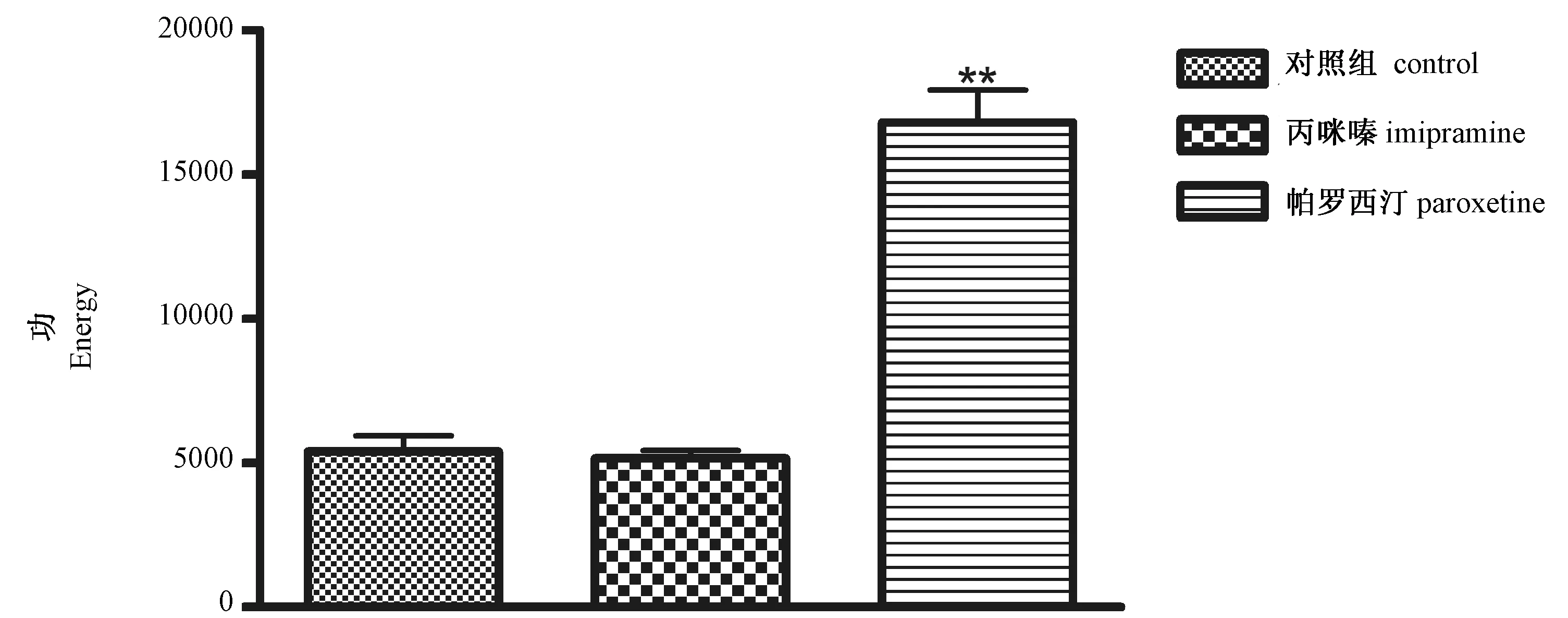
圖5 丙咪嗪、帕羅西汀對小鼠懸尾狀態下“功”值的影響(mean±SEM,**P < 0.01,與正常組比較)
2.3.2 陽性藥對“不動時間”及“功”指標的驗證
由圖4可見,與對照組比較,丙咪嗪、帕羅西汀可顯著縮短懸尾不動時間(P< 0.01)。
圖5結果顯示,與對照組比較,帕羅西汀可顯著增加懸尾小鼠“功”值(P< 0.01)。
3 討論
本研究提供了一套具有自主知識產權的適用于小鼠的懸尾實驗實時檢測分析處理系統。該系統以傳感器為原理,具有高度靈敏性和穩定性,并建立了反應小鼠掙扎強度的“功”指標,填補了國內以傳感器為原理的懸尾測試儀研發的空白。
目前,國內外懸尾測試儀的原理有三種,包括傳感器、視頻原理及紅外熱釋電原理。視頻原理,經常采用質心跟蹤的方法,但對懸尾實驗并不合適。因為動物在懸吊過程中,會產生以逃避為導向的運動,但質心變化可能并不明顯,質心跟蹤的方法顯然不能有效識別動物的“動”和“不動”狀態。識別鼠足,是簡單、有效的跟蹤方法,但要求動物腹部必須始終對準攝像頭。另外,動物掛在懸尾箱內,對背景光的強度和穩定性有一定要求,并且需要避免反光。其次,一般情況下,攝像頭距離懸尾箱30 cm左右,跟蹤效果比較理想,但僅限于一個樣本的觀察。增加攝像頭和懸尾箱的距離,可以增加樣本數,即跟蹤兩個或兩個以上的動物。但隨著攝像頭和懸尾箱距離的加大,識別效果變差。廣角鏡頭也不能有效解決這一問題。由此可見,視頻跟蹤的原理,并不適于懸尾儀器的研發。Juszczak[7]曾于2006年發表懸尾視頻分析的文章,但此后,視頻跟蹤的原理在國外并未大規模應用于懸尾儀器。紅外熱釋電原理則易受外界環境溫度和動物運動狀態的影響,外界環境溫度過低或動物運動遲緩時,經常出現誤判現象,導致結果不準確。傳感器原理能夠檢測到極微小的張力變化(如動物呼吸、胃腸蠕動等引起的張力變化),具有極高的靈敏性和穩定性,不受動物狀態、背景光的限制,在空間允許的情況下,可用于多樣本檢測,非常適于動物懸尾運動狀態的跟蹤。因此,我們選擇了力傳感器原理研制本系統,并通過閾值設定等方式,取得了敏感、穩定的指標。
懸尾實驗,主要用于抗抑郁藥物的篩選。因此,必須滿足多樣本要求。同時,實現多樣本同時懸掛也是亟待解決的問題。本系統通過橫梁的自動升降,解決了這一問題,節省了人力,并保證了實驗數據的客觀性。另外,建立自然光線下安靜、穩定的實驗環境,是保證行為學實驗數據可靠性的先決條件。國內外的懸尾儀器產品,懸尾箱的設計均為側面開放,動物易受周圍環境的干擾。本系統懸尾箱采用四周封閉,頂面開放的形式,既避免了周圍環境的干擾,同時,又可采集自然光線,保證了實驗數據的可靠性。除統計樣本的運動參數(運動時間和不動時間)外,本系統提出了“功”的概念,用于反應動物的掙扎強度,從而更細致地反應抗抑郁藥物的藥效。
保證懸尾實驗實時監測分析處理系統數據的準確性,是該儀器研發最為重要的環節之一。通過人機數據相關性分析對系統提供的數據進行相關性驗證,是儀器研發最為基本和最為重要的工作[8]。通過SPSS相關性統計分析,我們發現,當運動閾值設為26.8時,人機相關系數達94%,雙側P=0.000,具有統計學意義,說明懸尾測試軟件能準確真實的反應動物的懸尾行為。
丙咪嗪為三環類抗抑郁藥物,經常作為陽性藥應用于抑郁癥相關的實驗研究[9]。帕羅西汀為5-羥色胺重攝取抑制劑,具有高效、強力的抗抑郁作用,可顯著縮短懸尾實驗動物不動時間[10]。本研究發現,丙咪嗪和帕羅西汀的抗抑郁作用在懸尾實驗實時檢測分析處理系統中可得到良好體現,驗證了該系統的有效性。帕羅西汀還使小鼠“功”值增加,即增強懸尾小鼠的掙扎強度,顯示了其強有效的抗抑郁作用。丙咪嗪未表現出該作用。
綜上所述,基于傳感器原理,研制了懸尾實驗實時監測分析處理系統,實現了懸尾實驗的自動化,客觀化,重復性好,人機數據高度相關,指標敏感,并增加了“功”和“功率”等反應懸尾動物掙扎強度的指標,使抗抑郁藥物活性評價更加細致,可推廣應用于抗抑郁藥物篩選和抑郁癥病理機制的研究。
參考文獻:
[1] Cryan JF, Mombereau C, Vassout A. The tail suspension test as a model for assessing antidepressant activity: review of pharmacological and genetic studies in mice [J]. Neurosci Biobehav Rev, 2005,29(4-5):571-625.
[2] Lu X, Ross B, Sanchez-Alavez M, Zorrilla EP,etal. Phenotypic analysis of GalR2 knockout mice in anxiety- and depression-related behavioral tests [J]. Neuropeptides, 2008,42(4):387-97.
[3] Steru L, Chermat R, Thierry B,etal. The tail suspension test: a new method for screening antidepressants in mice [J]. Psychopharmacology (Berl), 1985,85(3):367-70.
[4] Jacobsen JP, Nielsen EO, Hummel R,etal. Insensitivity of NMRI mice to selective serotonin reuptake inhibitors in the tail suspension test can be reversed by co-treatment with 5-hydroxytryptophan [J]. Psychopharmacology (Berl), 2008,199(2):137-50.
[5] Liu X, Gershenfeld HK. Genetic differences in the tail-suspension test and its relationship to imipramine response among 11 inbred strains of mice [J]. Biological Psychiatry, 2001,49(7):575-81.
[6] 孫秀萍, 李騰飛, 石哲, 等. 人參總皂苷和遠志總苷配伍對小鼠抗抑郁作用[J]. 中國比較醫學雜志, 2012,22( 6):30-6.
[7] Juszczak GR, Sliwa AT, Wolak P,etal. The usage of video analysis system for detection of immobility in the tail suspension test in mice [J]. Pharmacol Biochem Behav,2006,85(2):332-8.
[8] 王瓊, 買文麗, 李翊華, 等. 自主活動實時測試分析處理系統的建立與開心散安神鎮靜作用驗證[J]. 中草藥, 2009,40(11):1773-1779.
[9] Cunha MP, Machado DG, Bettio LEB,etal. Interaction of zinc with antidepressants in the tail suspension test [J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2008,32(8):1913-20.
[10] Varty GB, Cohen-Williams ME, Hunter JC. The antidepressant-like effects of neurokinin NK1 receptor antagonists in a gerbil tail suspension test [J]. Behav Pharmacol, 2003,14(1):87-95.

