新發高致病性禽流感H5N1病毒的致病性、傳播力研究及進化分析
袁 靜,許黎黎,鮑琳琳,呂 琦,李楓棣,于 品,秦 川
(中國醫學科學院醫學實驗動物研究所,衛生部人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,北京 100021)
流感是由流感病毒引起的一種急性呼吸道傳染病,它通過飛沫傳播,能在短時間內迅速蔓延。1997年香港首次報道了18例人感染高致病性H5N1禽流感病例,其中6例死亡,感染的臨床特征包括驟然發熱和上呼吸道感染等典型流感癥狀,許多病人出現嚴重并發癥,主要有肺炎、胃腸道癥狀、肝酶升高和腎衰[1]。其后,全球已經有15個國家和地區相繼出現了人禽流感病例和有限的人際間傳播報道[2]。時至2011年底,世界衛生組織(WHO)共累計接收人感染H5N1病例報告584例,死亡345例,病死率接近60%[3],遠高于2003 年全球嚴重急性呼吸綜合癥(SARS)疫情時11%的總體死亡率。鑒于甲型流感病毒高度變異和2009年出現的新型甲型H1N1流感全球大流行,高致病性禽流感H5N1病毒仍然是引起全球流感大流行疫情的潛在病原之一,散在出現的人際間傳播事件表明H5N1病毒一旦突破物種間屏障而在人群中流行,必將成為世界各國所面臨的巨大公共衛生威脅之一,將會給人類的生存和發展帶來災難性打擊。
2011年底,香港再度爆發禽流感,死亡的紅嘴鷗證實感染禽流感H5N1病毒, 并且其基因序列與同期深圳死亡患者高度同源,此次疫情再次提醒我們,在環境選擇壓力下,禽流感H5N1病毒不斷的抗原漂移現象可能隨時導致其跨越物種屏障,從而實現對人群的感染。因此,加強對新發H5N1病毒感染性及傳播力的研究,對于防范可能發生的禽流感疫情,具有非常重要的現實意義。
本文擬對2011年底香港死亡紅嘴鷗所攜帶的、與深圳死亡患者分離株高度同源的H5N1病毒進行感染性評價,證實其是否確實具有在人類細胞中增殖的能力,并對該毒株體外基于細胞水平的復制能力以及體內基于小鼠模型的毒力與致病性進行研究,與迄今為止毒力最強的H5N1毒株A/Shenzhen/406H/2006及WHO推薦的禽流感H5N1疫苗制備株A/Vietnam/1194/2004進行比較。同時,設立攻毒組與同居組,對新發H5N1病毒能否在小鼠群體間傳播進行評測,從而對新病毒的傳播力進行研究。此外,通過對病毒的HA基因進行測序及序列分析,構建病毒的進化樹,分析其分子遺傳進化地位。研究結果對于應對未來可能出現的禽流感疫情具有非常重要的現實意義。
1 材料和方法
1.1 材料
1.1.1 病毒: 本研究所使用毒株詳情參見表1,均由香港大學陳洪霖教授惠贈。體外細胞感染實驗及體內動物攻毒實驗都按照WHO指導原則在ABSL-3實驗室中進行。
1.1.2 細胞:犬腎細胞MDCK、人肺腺癌細胞A549、及小細胞肺癌細胞NCI-H446均于本課題組保存。
1.1.3 實驗動物:5周齡SPF級雌性BALB/C小鼠由醫科院醫學實驗動物研究所提供(合格證號:SCXK(京)2006-0009)(實驗室許可證號:ILAS-PC-2012-002)。
1.2 方法
1.2.1 體外(Invitro)細胞感染實驗:細胞在含有10%胎牛血清的DMEM(Invitrogen)中培養,將102TCID50的病毒液接種于培養在直徑35 mm培養板內的單層細胞中,37℃吸附60 min,加入10 mL無血清培養基、含TPCK的胰蛋白酶(0.5 μg/mL)和雙抗。分別在感染細胞后12,24,36,48,56,72 h收集250 μL病毒上清液,3000 r/min離心10 min,取上清通過Real-time PCR測定病毒核酸載量。
1.2.2 體內(Invivo)小鼠感染實驗:每組12只小鼠分為組1(8只)及組2(4只)。將小鼠按0.02 mL/g比例肌注三溴乙醇麻醉后,通過滴鼻途徑對小鼠進行攻毒,每只小鼠接種102TCID50病毒液50 μL。組1小鼠連續觀察14 d,記錄臨床表征和死亡率。組2小鼠在攻毒后第5天,安樂后取肺組織,通過Real-time PCR測定病毒核酸載量。
表1 本研究中所使用的高致病性禽流感H5N1病毒詳情
1.2.3 小鼠同居實驗:18只小鼠隨機分配于兩個鼠盒中,每盒9只,其中3只標記后通過滴鼻途徑進行攻毒,另外6只同籠飼養。第一盒同居小鼠于攻毒后5,8,11 d各安樂2只,取肺組織,測定病毒核酸載量及滴度。第二盒同居小鼠于攻毒后14,21,28 d各摘除2只小鼠的眼球獲取血清,通過血凝抑制實驗及微量中和實驗測定抗體效價。
1.2.4 Real-time PCR:小鼠肺組織研磨成勻漿,從上清液中提取RNA(Qiagen),溶于30 μL Diethyl pyrocarbonate(DEPC)處理過H2O中,保存于-80℃。取8 μL RNA進行逆轉錄cDNA的合成,加入到總體積為20 μL,含有200 U Superscript Ⅲ逆轉錄酶((Invitrogen)的反應體系中。實時熒光定量PCR檢測體系為20 μL,包括10 μL 2× SYBR Green熒光染料Mix (ABI),各1 μL 10 μmol/L的正向和反向引物(NP-688F: 5′-ttccaaacagcagcacaaag-3′, NP-817R:5′-tatgggccaatgatcctctc-3′),2 μL cDNA模板和6 μL無RNA酶的H2O。熱循環條件,94℃ 3 min,94℃ 30 s,58℃ 30 s,72℃ 30 s,35個循環。每個循環結束后讀取熒光值。
1.2.5 血凝抑制實驗(HI):先用Receptor-destroying enzyme(RDE)酶處理血清,1份血清加入3份RDE酶工作液,37℃水浴12~16 h后56℃滅活30 min。將1份濃縮火雞血和10份RDE酶工作液處理過的滅活血清(200 uL)充分混勻,4℃放置1 h,重懸后1200 r/min離心5 min,取上清,向其中加入2.5倍血清體積的PBS溶液即得到工作血清。96孔V型板除第一列(共八列)外,每孔加入25 μL的PBS,在第一,二,八列每孔加入25 μL工作血清,從第二列移取25 μL,由第二到第七列對倍稀釋,每孔加入25 μL新調制的4HA病毒液(最后一列除外),充分混勻,室溫靜置40 min,每孔加入1%火雞血50 μL,室溫靜置30 min觀察結果。將96孔V型板垂直豎起,觀察孔底紅細胞滑下速度,待對照孔內紅細胞自由下滑呈淚滴狀時讀結果,紅細胞下滑速度與對照相同者為完全抑制,完全抑制時的血清最高稀釋度即抗體效價。
1.2.6 微量中和實驗(MN):將攻毒后14、21、28 d的小鼠血清放在60℃水浴鍋中滅活30 min,之后在96孔板中將待檢血清用維持液稀釋為1∶8、1∶16、1∶32……1∶1 024。將稀釋好的血清100 μL/每孔分別與100 μL 102TCID50的病毒等量混合,37℃孵育1 h。將血清-病毒混合液接種于培養在96孔培養板內的單層MDCK細胞中,經3天培養觀察細胞病變(CPE),同時吸取上清每孔50 μL,加入1%的火雞血50 μL,混勻,靜止30 min進行復核實驗。
1.2.7 基因測序、比對、及進化樹構建:病毒HA基因分為相互重疊的三段利用高保真PCR系統進行擴增(KOD plus,TOYOBO),所用引物序列為:HAF1(1~22): 5′-atggagaaaatagtgcttctt-3′;HAR1(651-671): 5′-ctctggttaagtgttgatgtc-3′; HAF2(481~502): 5′-agaaatgtgatatggcttatca-3′; HAR2(1201~1221): 5′-ctgagtgttcattttgtcaat-3′; HAF3(925~945): 5′-aacatacaccctctcaccatc-3′; HAR3(1693~1715): 5′-ctcacaaatttaaatgcaaattc-3′。擴增產物純化后(QIAGEN)外送測序(中美泰和)。利用CLUSTAL W (version 1.83)軟件對HA基因序列進行比對,利用MEGA5.0軟件基于HA蛋白序列構建Neighbor-joining進化樹,校驗值(bootstrap)設為500。
1.2.8 數據統計分析:病毒核酸載量和滴度的數據處理運用SPSS 11.5軟件包中DUNCAN及LSD法進行ANOVA單因素方差分析。
2 結果
2.1 新發H5N1毒株07035對人源肺細胞的感染性研究
將102TCID50的07035毒株分別感染人肺腺癌細胞A549及小細胞肺癌細胞NCI-H446,在感染細胞后12,24,36,48,56,72 h收集病毒上清液,取上清測定病毒核酸載量。結果顯示,07035病毒可在A549細胞中有效復制,拷貝數從12~72 h呈持續增長態勢(P<0.05),而其在NCI-H446中并不能增殖(圖1),說明07035病毒在體外對人源肺細胞具有一定程度的感染性。

圖1 07035毒株體外在人源肺細胞中的復制曲線。(A)A549細胞;(B)NCI-H446細胞
2.2 細胞水平(In vitro)病毒復制能力比較
將102TCID50的新發H5N1病毒07035、迄今為止毒力最強的SZ株、及WHO推薦的禽流感疫苗制備株VN分別感染MDCK細胞。病毒復制動力學結果顯示,07035毒株在MDCK細胞中于56 h.p.i達到復制峰值,同時,從感染后12~72 h,07035在MDCK細胞中的復制能力較SZ與VN株稍低,但與后兩者并不存在顯著性差異(P>0.05)(圖2)。
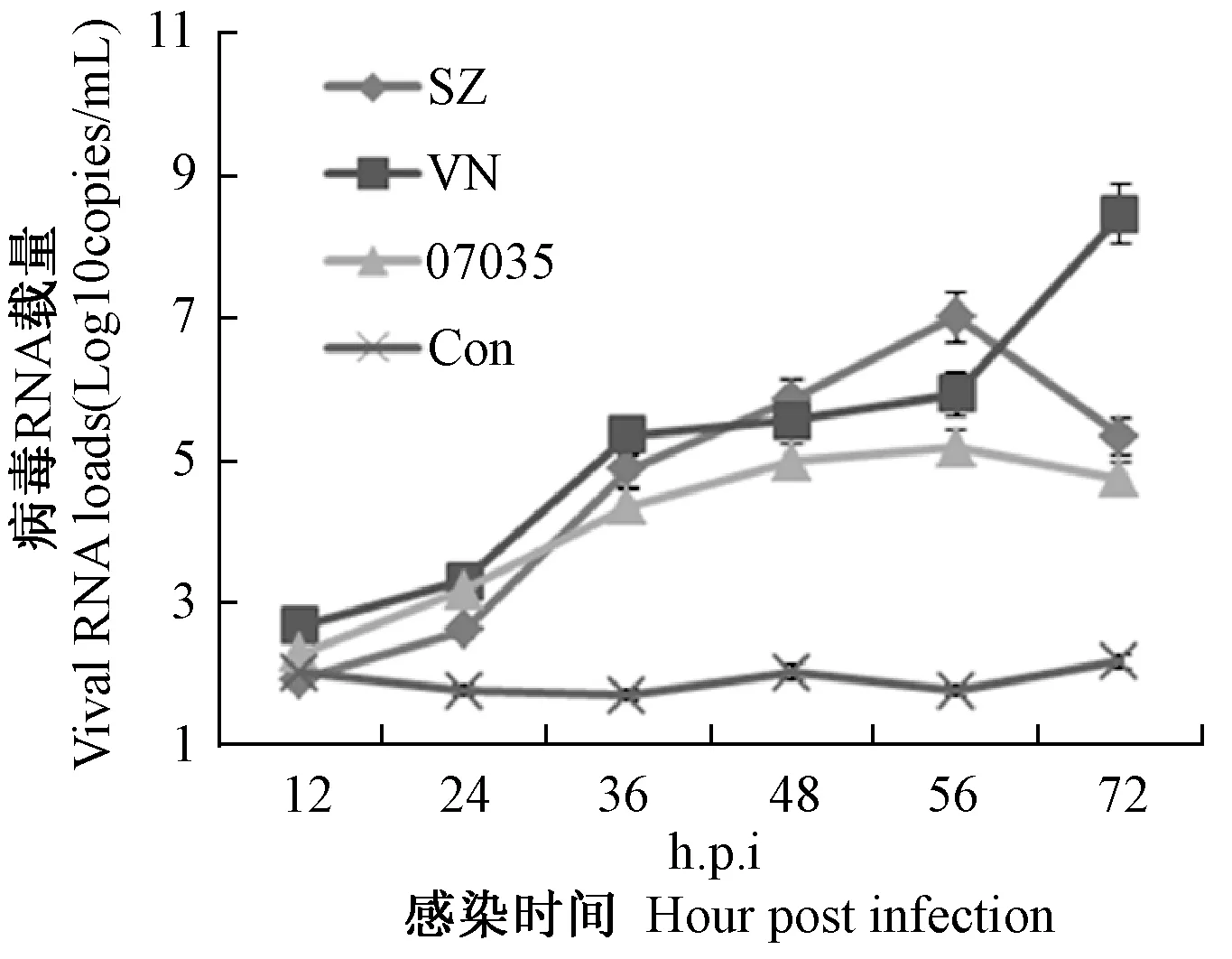
圖2 07035毒株與SZ及VN株在MDCK細胞中復制能力比較
2.3 小鼠體內(In vivo)病毒毒力及致病性比較
將102TCID50的07035、SZ、及VN分別對BALB/c小鼠攻毒,通過觀察小鼠的存活率,體重變化情況,肺組織中病毒核酸載量等,來對病毒的毒力及致病性進行比較。小鼠攻毒后連續觀察14 d,其中感染SZ及VN株的小鼠100%死亡,而07035感染后小鼠仍有12.5%存活(圖3)。SZ與VN感染的小鼠平均存活天數顯著低于07035感染的小鼠(圖4)。由圖5可見SZ株感染的小鼠體重下降最為顯著,其次為VN株,下降最少的為07035感染的小鼠。同時,Real-time PCR結果可見SZ與VN感染的小鼠肺組織病毒核酸拷貝數顯著高于07035感染的小鼠(P<0.01)(圖6)。因此,新發禽流感H5N1病毒07035對小鼠的致病性較目前毒力最強的SZ株及WHO推薦的疫苗制備株VN較弱,在進化的過程中暫未發生導致致病性增強的正向選擇事件。
圖3 102 TCID50的07035、SZ、VN株感染小鼠后的存活曲線
圖4 102 TCID50的07035、SZ、VN株感染小鼠后的平均存活天數
圖5 102 TCID50的07035、SZ、VN株感染小鼠后的體重變化曲線

圖6 102 TCID50的07035、SZ、VN株感染小鼠后第5天肺組織攜帶病毒核酸拷貝數
2.4 新發H5N1毒株07035在小鼠群體間的傳播力研究
每盒9只小鼠中3只被攻毒的小鼠于感染后9 d內全部死亡,同居小鼠第5天及第8天肺組織檢測不到病毒核酸載量,而第11天兩只同居小鼠中的一只經Real-time PCR檢測為陽性,拷貝數為6×108copies/mL。將PCR產物外送測序證實其與攻毒毒株07035 100%同源。此外,將該同居小鼠的肺組織上清接種MDCK細胞,傳至第二代時出現典型CPE現象,測定其滴度為104.86TCID50。然而,同居小鼠第14,21,28天的血清經血凝抑制實驗及微量中和實驗檢測,其結果均為陰性。以上結果證實07035毒株可在小鼠群體間進行有效傳播,但誘發機體體液免疫保護程度較弱。
2.5 新發H5N1病毒的遺傳進化分析
對07035的HA基因進行分段高保真PCR后外送測序,序列拼接后已提交至Genbank數據庫中,登陸號為JQ922566。與WHO禽流感H5N1監測網絡提供的各進化分支(Clade)代表株進行序列多重比對后,構建了HA蛋白的分子遺傳進化樹(圖7)。結果證實07035的進化地位屬于2.3.2.1,為近兩年來的主流流行Clade。值得注意的是,與07035最為同源的毒株A/Guangxi/1/2009分離自我國廣西一名因接觸病死禽類而感染H5N1并導致死亡的18歲男孩體內。
3 討論
圖7 基于HA蛋白序列的分子遺傳進化樹
流感病毒特異性受體末端的N-乙酰基神經氨酸(又稱為唾液酸)可與半乳糖以α2,3或α2,6鍵的方式結合,所形成的受體分別命名為α2,3唾液酸受體或α2,6唾液酸受體。通常情況下,人源流感病毒識別α2,6唾液酸受體,而禽源病毒識別α2,3唾液酸受體[4]。Shinya等[5]報道人呼吸道組織切片從鼻腔至終末和呼吸細支氣管主要表達α2,6唾液酸受體,除鼻腔粘膜個別上皮細胞偶爾表達α2,3唾液酸受體外,其他部位缺乏α2,3唾液酸受體,相反,下呼吸道的呼吸細支氣管與肺泡之間連接部的非纖毛立方細胞以及肺泡細胞表達α2,3唾液酸受體為主。因此理論狀態下禽流感H5N1病毒并不具備在人際間通過空氣經上呼吸道傳播的能力。然而,目前仍有少量H5N1在人際間傳播的散發案例的報道[6-9]。本研究中將攻毒鼠與健康鼠同籠飼養,健康鼠獲得了感染,說明新發H5N1病毒可在小鼠群體間通過接觸而傳播。有學者曾用1997年的人(A/HK156/97)及雞(A/Chicken/Hong Kong/258/97)H5N1分離毒株感染豬及小鼠,并將健康的豬及小鼠分別與攻毒動物同籠飼養,結果同籠飼養的豬、小鼠均未發生感染[10]。也有人用2.5 × 104TCID50的VN株感染家貓,并將健康家貓與感染貓同舍飼養,結果健康貓獲得感染,這可能與所使用的毒株以及攻毒劑量等有關,另一方面也提示經過進化后病毒的致病力及傳播力可能發生了變化[11]。H5N1病毒在禽類群體間擁有較明確的泄殖腔-口腔傳播途徑,而其在人類及哺乳動物之間能否進行傳播,至今仍存在爭議。2004年泰國動物園中大量虎發生H5N1感染,通過流行病學調查及病原學等研究認為病毒在老虎之間可能發生了水平傳播[12]。自1997年以來,H5N1呈現出致病力逐漸增強的態勢,體現在人感染后病死率的增加、病毒抗原特性的變化、內部基因的重排以及宿主范圍的擴大等,提示H5N1在人與人之間傳播的可能性大大增加,而近年來越南、泰國、印度尼西亞已出現H5N1病毒感染的家庭聚集現象[10, 13-17]。但也有人對此持反對意見,他們認為家庭成員所生活的環境、背景、生活習慣都基本相同,不能完全確定感染源,看護H5N1感染病人的護理員的血清抗體也均呈陰性[18-21]。 有學者擔心H5N1病毒是否與人流感病毒發生了基因重組,從而使傳播能力大大增強,設計了將H5NI病毒與引起1968年流感大流行的H3N2病毒雜交,雜交后的病毒能感染雪貂,但不能引起雪貂間的水平傳播,說明雜交后的病毒傳播力并沒有增強,同時也提示人流感病毒與禽流感病毒的重組并不像我們想象中的那么容易,可能是一個非常復雜的過程[20]。但是,2011年底,來自荷蘭的病毒學家Ron Fouchier和來自美國的病毒學教授Yoshihiro Kawaoka分別在某國際流感會議上扔下兩枚重磅炸彈——他們對禽流感H5N1病毒進行基因改造,培育出的H5N1病毒變種已具備在雪貂間通過空氣傳播的能力,并暗示也具備在人際間傳播的可能。說明H5N1病毒仍然是引起全球流感大流行疫情的潛在病原之一,加強對新發病毒感染性及傳播力監測具有重要的現實意義。
本實驗中健康鼠通過與攻毒鼠同籠飼養而獲得了感染,再次證實H5N1已具備在哺乳動物之間進行傳播的能力。傳播的可能途徑包括:空氣飛沫、糞口污染、身體接觸等多個方面,具體是通過何種方式進行傳播還有待進一步的研究。盡管本研究結果顯示新發 H5N1病毒07035對小鼠的致病性相比目前毒力最強的SZ株及WHO推薦的疫苗制備株VN較弱,在進化的過程中暫未發生導致致病性增強的正向選擇事件。但07035毒株可在小鼠群體間進行有效傳播且誘發機體體液免疫保護程度較弱的結果值得高度關注。尤其是與07035最為同源的毒株A/Guangxi/1/2009分離自我國廣西一名因接觸病死禽類而感染H5N1并導致死亡的18歲男孩體內,而且07035病毒在體外對人源肺細胞還具有一定程度的感染性,都說明新發禽流感H5N1病毒07035存在潛在傳給人的威脅。若病人同時受人類流感病毒及禽流感病毒感染,就有可能成為病毒的“混合爐”,并存在產生在人群間傳播能力的高致病性新型重組病毒的可能性。一旦出現這種情況,即意味著將會給人類的生存和發展帶來災難性打擊的流感大疫情的爆發。
參考文獻:
[1] Yuen KY, Chan PK, Peiris M, et al. Clinical features and rapid viral diagnosis of human disease associated with avian influenza A H5N1 virus. Lancet 1998;351:467-471.
[2] Maines TR, Szretter KJ, Perrone L, et al. Pathogenesis of emerging avian influenza viruses in mammals and the host innate immune response. Immunol Rev 2008;225:68-84.
[3] WHO. http://www.who.int/influenza/human_animal_interface/H5N1_cumulative_table_archives/en/index.html. 2012.
[4] Ito T, Couceiro JN, Kelm S, et al. Molecular basis for the generation in pigs of influenza A viruses with pandemic potential. J Virol 1998;72:7367-7373.
[5] Shinya K, Ebina M, Yamada S, et al. Avian flu: influenza virus receptors in the human airway. Nature 2006;440:435-436.
[6] Buxton Bridges C, Katz JM, Seto WH, et al. Risk of influenza A (H5N1) infection among health care workers exposed to patients with influenza A (H5N1), Hong Kong. J Infect Dis 2000;181:344-348.
[7] Tran TH, Nguyen TL, Nguyen TD, et al. Avian influenza A (H5N1) in 10 patients in Vietnam. N Engl J Med 2004;350:1179-1188.
[8] Ungchusak K, Auewarakul P, Dowell SF, et al. Probable person-to-person transmission of avian influenza A (H5N1). N Engl J Med 2005;352:333-340.
[9] Wang H, Feng Z, Shu Y, et al. Probable limited person-to-person transmission of highly pathogenic avian influenza A (H5N1) virus in China. Lancet 2008;371:1427-1434.
[10] Herfst S, Schrauwen EJ, Linster M, et al. Airborne transmission of influenza A/H5N1 virus between ferrets. Science 2012;336:1534-1541.
[11] Maher JA, DeStefano J. The ferret: an animal model to study influenza virus. Lab Anim (NY) 2004;33:50-53.
[12] van Riel D, Munster VJ, de Wit E, et al. Human and avian influenza viruses target different cells in the lower respiratory tract of humans and other mammals. Am J Pathol 2007;171:1215-1223.
[13] Sorrell EM, Wan H, Araya Y, et al. Minimal molecular constraints for respiratory droplet transmission of an avian-human H9N2 influenza A virus. Proc Natl Acad Sci U S A 2009;106:7565-7570.
[14] Imai M, Watanabe T, Hatta M, et al. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature 2012;486:420-428.
[15] Munster VJ, de Wit E, van den Brand JM, et al. Pathogenesis and transmission of swine-origin 2009 A(H1N1) influenza virus in ferrets. Science 2009;325:481-483.
[16] Maines TR, Jayaraman A, Belser JA, et al. Transmission and pathogenesis of swine-origin 2009 A(H1N1) influenza viruses in ferrets and mice. Science 2009;325:484-487.
[17] Yen HL, Lipatov AS, Ilyushina NA, et al. Inefficient transmission of H5N1 influenza viruses in a ferret contact model. J Virol 2007;81:6890-6898.
[18] Hu J, Zhao K, Liu X, et al. Two highly pathogenic avian influenza H5N1 viruses of clade 2.3.2.1 with similar genetic background but with different pathogenicity in mice and ducks. Transbound Emerg Dis 2012;60:127-139.
[19] Marinova-Petkova A, Georgiev G, Seiler P, et al. Spread of influenza virus A (H5N1) clade 2.3.2.1 to Bulgaria in common buzzards. Emerg Infect Dis 2012;18:1596-1602.
[20] Choi JG, Kang HM, Jeon WJ, et al. Characterization of clade 2.3.2.1 H5N1 highly pathogenic avian influenza viruses isolated from wild birds (mandarin duck and Eurasian eagle owl) in 2010 in Korea. Viruses 2013;5:1153-1174.
[21] Tung DH, Van Quyen D, Nguyen T, et al. Molecular characterization of a H5N1 highly pathogenic avian influenza virus clade 2.3.2.1b circulating in Vietnam in 2011. Vet Microbiol 2013;165:341-348.

