新型聚方酸菁功能材料的合成及其性能研究*
陳淑偉,詹豪強
(西華師范大學化學化工學院化學合成與污染控制四川省重點實驗室,四川南充 637009)
·研究論文·
新型聚方酸菁功能材料的合成及其性能研究*
陳淑偉,詹豪強
(西華師范大學化學化工學院化學合成與污染控制四川省重點實驗室,四川南充 637009)
以對苯二酚為起始原料,經Wittig-Horner等反應合成了主鏈結構的二吡咯化合物(5a和5b);5a或5b與方酸經聚合反應合成了兩種新型聚方酸菁材料BPEBP(6a)和BPVOD(6b),其結構和性能經1H NMR,13C NMR,IR,MS,TG,UV-Vis和FL表征。結果表明:6a和6b的初始分解溫度分別為282.0℃和293.8℃; λmax分別位于732 nm和865 nm;λem分別位于478 nm和428 nm。
對苯二酚;Wittig-Horner反應;聚方酸菁;合成;熱性能;光學性能
聚方酸菁材料與其他具有近紅外吸收性質的無機材料相比,在書寫性能和信噪比上占有一定優勢,在GaAIAs二極管激光器的輸出范圍內有很強吸收。與普通菁類染料相比,聚方酸菁材料具有更好的耐光、耐熱牢度,不易光褪色,易溶于有機溶劑,適用于成本低廉的旋轉涂布法制膜[1]。由于其獨特的吸收和熒光性質,聚方酸菁材料引起研究人員的廣泛關注,已在非線性光學、發光場效應晶體管、太陽能電池[2-3]等領域得到應用。近年來研究發現,聚方酸菁在近紅外有強烈吸收、較強的熒光性質及較低的能帶[4],具有廣泛的應用空間。
本文以對苯二酚為起始原料,經Wittig-Horner等反應,合成了主鏈結構的二吡咯化合物(5a和5b);5a或5b與方酸經聚合反應合成了兩種新型聚方酸菁材料BPEBP(6a)和BPVOD (6b)(Scheme 1),其結構和性能經1H NMR,13C NMR,IR,MS,TG,UV-Vis和FL表征。結果表明:6a和6b的初始分解溫度分別為282.0℃和293.8℃;λmax分別位于732 nm和865 nm; λem分別位于478 nm和428 nm。
1 實驗部分
1.1 儀器與試劑
X-4型數字顯微熔點儀(溫度未校正);島津UV-2550型紫外可見分光光度計;Bruker SF-400 Hz型核磁共振儀(CDCl3為溶劑,TMS為內標); Nicolet-6700型紅外光譜儀(KBr壓片);DMAX/ Ultima IV型X-射線衍射儀;Bio TOF Q型質譜儀。
1,4-二羥基-苯乙二醚(1)按文獻[5]方法合成;其余所用均為分析純,成都科龍化工試劑廠,其中溶劑按常規方法處理,四氫呋喃使用前重蒸。
1.2 合成
(1)1,4-二丁基-苯乙二醚(2)的合成[6]
在單口燒瓶中依次加入DMF 50 mL,1 5.0 g (25.3 mmol),氫化鈉3.0 g(0.125 mol)和溴代正丁烷7.5 g(54.7 mmol),攪拌下于90℃反應12 h。冷卻至室溫,倒入100 mL水中(析出白色沉淀),靜置2 h,抽濾,濾餅用氯仿溶解,用無水硫酸鈉干燥,蒸除溶劑,干燥得白色固體2 4.1 g,產率52.3%,m.p.23℃~25℃;1H NMR δ:6.85 (s,4H,ArH),4.06(t,J=4.2 Hz,4H,OCH2),3.75(t,J=4.4 Hz,4H,CH2O),3.52 (t,J=6.6 Hz,4H,OCH2),1.61(t,J=7.0 Hz,4H,CH2),1.38(t,J=7.4 Hz,4H,CH2),0.92 (t,J=7.4 Hz,6H,CH3);13C NMR δ:153.1,115.6,71.4,69.3,68.1,31.7,19.3,13.9。
(2)3的合成[15](以3a為例)
在反應瓶中依次加入冰醋酸100 mL,2 1.77 g(5.7 mmol),多聚甲醛0.69 g(22.8 mmol)及溴化鈉4.7 g(45.6 mmol),攪拌使其溶解;緩慢滴加濃硫酸1.24 mL(22.8 mmol)的冰醋酸(20 mL)溶解,于50℃反應10 h。冷卻,倒入200 mL水中(析出白色沉淀),靜置2 h,抽濾,濾餅用氯仿溶解,用無水硫酸鈉干燥,蒸除溶劑后經硅膠柱層析[洗脫劑:A=V(EA)∶V(PE)=1∶15]純化得淡黃色固體3a 1.88 g。
用1代替2,用類似方法合成淡黃色液體3c。
3 a:產率66.78%,m.p.34℃~35℃;1H NMR δ:6.92(s,2H,ArH),4.55(s,4H,CH2Br),4.19(t,J=4.8 Hz,4H,ArOCH2),3.84(t,J=4.8 Hz,4H,OCH2),3.59(t,J= 6.4 Hz,4H,OCH2),1.65(m,4H,CH2),1.45 (m,4H,CH2),0.95(s,6H,CH3);13C NMR δ: 150.9,128.1,115.5,71.4,69.2,69.1,31.8,28.5,19.3,13.9。
3 c;1H NMR δ:6.88(s,2H,ArH),4.52 (s,4H,ArCH2),4.46(t,J=4.8 Hz,4H,OCH2),4.22(t,J=4.8 Hz,4H,OCH2),2.12 (s,6H,CH3)。
(3)4的合成[7](以4a為例)
在反應瓶中加入3a 1.82 g(3.68 mmol)和亞磷酸三乙酯2.45 g(14.74 mmol),攪拌下于160 ℃(回流)反應10 h。減壓蒸除過量亞磷酸三乙酯后經硅膠柱層析(洗脫劑:A=1∶2)純化得淡黃色油狀液體4a 2.10 g。
用類似方法合成白色固體4c。
4 a:收率93.75%;1H NMR δ:6.93(s,2H,ArH),4.07~4.09(t,J=4.8 Hz,4H,ArOCH2),3.98~4.06(m,8H,CH2),3.73~3.75(t,J=4.8 Hz,4H,OCH2),3.49~3.52(t,J=6.6 Hz,4H,OCH2),3.20~3.25(d,J=12 Hz,4H,PCH2),1.55~1.59(m,4H,CH2),1.35~1.41(m,4H,CH2),1.21~1.25(t,J=7.0 Hz,12H,CH3),0.90~0.94(t,J=7.4 Hz,6H,CH3);13C NMR δ: 150.6,120.1,71.3,69.3,68.9,61.9,31.8,26.9,25.6,19.2,16.3,13.9。
4 c:收率87.3%,m.p.24℃~26℃;1H NMR δ:6.94(s,2H,ArH),4.38~4.40(t, J=4 Hz,4H,OCH2),4.14~4.15(d,J=4.8 Hz,4H,OCH2),3.99~4.03(t,J=6.4 Hz,8H,CH2),3.17~3.22(d,J=20.4 Hz,4H,CH2),2.09(s,6H,CH3),1.21~1.25(t,J= 6.8 Hz,12H,CH3)。
(4)5的合成[8](以5a為例)
在反應瓶中依次加入干燥THF10 mL和氫化鈉0.24 g(1.0 mmol),攪拌0.5 h;緩慢滴加4a 0.61 g(0.1 mmol)的干燥THF(10 mL)溶液,待反應液變黃后,滴入N-正丁基-2-吡咯甲醛[7-8]0.45 g(0.3 mmol)的干燥THF(10 mL)溶液,滴畢,于室溫反應10 h。蒸除溶劑,加水100 mL,用乙酸乙酯(3×30 mL)萃取,合并萃取液,濃縮后經硅膠柱層析(洗脫劑:EA)純化得棕黃色固體5a 0.25 g。
用4c代替4a,用類似方法(洗脫劑:A= 4∶1)合成棕黃色固體5b 0.23 g。
5 a:收率41.4%,m.p.98℃~101℃;1H NMR δ:7.10(s,2H),7.15~7.19(d,J= 16.0 Hz,2H),7.01~7.05(d,J=17.2 Hz,4H),6.69(s,2H),6.51(s,2H),6.17~6.18 (t,J=2.8 Hz,2H),4.18~4.21(t,J=5.2 Hz,4H),3.98~4.02(t,J=7.2 Hz,4H),3.83~3.86(t,J=4.8 Hz,4H),3.57~3.60(t,J=6.4 Hz,4H),1.75~1.79(t,J=7.6 Hz,4H),1.58~1.65(m,4H),1.35~1.45(m,8H),0.95~0.99(m,12H);13C NMR δ:151.0,132.0,127.2,122.5,120.9,117.6,111.5,108.2,106.6,71.4,69.4,69.3,46.8,33.6,31.8,20.0,19.3,13.9,13.7;EI-MS m/z: 604.4{[M+H]+},627.3{[M+Na]+}。
5 b:收率46.6%,m.p.105℃~107℃;1H NMR δ:7.10(s,2H),7.00~7.04(t,J=4.8 Hz,4H),6.69(s,2H),6.51(s,2H),6.17(d,J=2.4 Hz,2H),4.16~4.17(d,J=4.4 Hz,2H),3.99~4.02(t,J=6.4 Hz,6H),1.72~1.78 (d,J=7.2 Hz,4H),1.33~1.39(t,J=7.6 Hz,4H),0.94~0.97(t,J=7.2 Hz,4H);13C NMR δ: 150.8,131.7,127.1,122.8,120.4,118.2,111.5,108.3,106.8,71.1,61.7,46.8,33.7,20.0,13.8;EI-MS m/z:493.3{[M+H]+},515.2{[M+Na]+}。
(5)6的合成[10-11](以6a為例)
在干燥單口燒瓶中加入混合溶劑[V(苯)∶V(正丁醇)=1∶3]50 mL,攪拌下加入5a 110 mg (0.19 mmol)和方酸21 mg(0.19 mmol),回流分水反應20 h。除去溶劑,加入石油醚50 mL(析出沉淀),過濾,濾餅干燥得墨綠色固體6a 0.13 g,收率99.2%。
用類似方法合成墨綠色固體6b 0.13 g,收率99.2%。
2 結果與討論
2.1 表征與性能
(1)IR
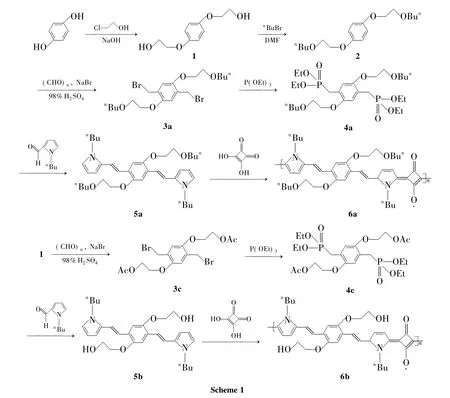
圖1為6a和6b的IR譜圖。由圖1可見,6a 和6b在3 430 cm-1處有一個寬而強的特征吸收峰,為方酸氧負離子與氫離子結合形成的羥基峰,但6b在該處的峰明顯比6a的峰強而寬,可能是6b的主體結構存在羥基的原因[5]。2 900 cm-1處為飽和C-H伸縮振動吸收峰;1 620 cm-1~1 630 cm-1處的強吸收峰為方酸發色團1,3-環丁二醇二價陰離子的穩定共軛結構的特征吸收峰[12];1 600 cm-1~1 450 cm-1處為芳環骨振動吸收峰;1 383 cm-1為雙鍵的特征吸收峰;1 000 cm-1以下的吸收峰歸屬各種C-H鍵的面內彎曲振動,6a在該區域的吸收峰明顯比6b強是由于支鏈上正丁基的原因。
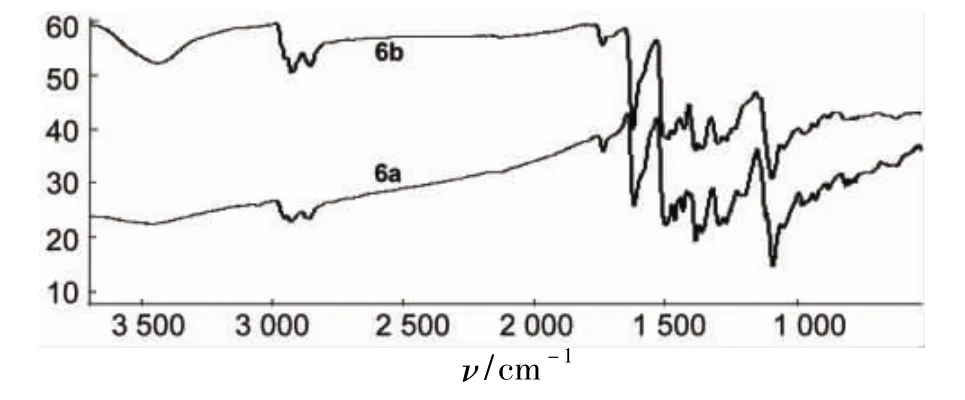
圖1 6a和6b的IR譜圖Figure 1IR spectra of 6a and 6b
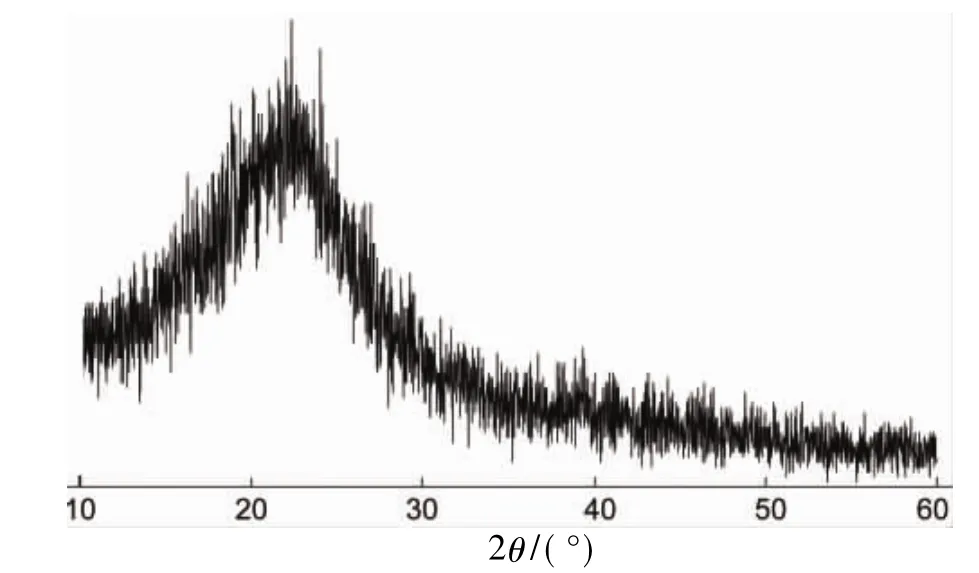
圖2 6a和6b的XRD圖Figure 2XRD patterns of 6a and 6b
(2)XRD
圖2為6a和6b的XRD譜圖。由圖2可見,6a和6b在21.96°和22.06°處出現了較強的衍射峰,表明6a和6b為非晶態結構[10],且結構類似。
(3)TG
圖3為6a的TG曲線。從圖3可以看出,6a 在282.0℃時側鏈開始分解。在溫度到達600℃時,6a分解完全,說明其具有良好的熱穩定性。
6 b的TG曲線與6a相似,初始分解溫度在293.8℃。
(4)UV-Vis
圖4為6a和6b的UV-Vis譜圖。從圖4可以看出,6b的最大吸收峰在723 nm,而6a的最大吸收峰在865 nm,該吸收峰為其特征吸收峰,由于6a的主體結構上連接的是丁基醚的基團而6b連接的是羥基,丁基醚的供電子性強于羥基所以6a的最大吸收峰強于6b,進而證明供電子性的強弱影響聚方酸菁的UV-Vis吸收。這兩種材料除最大吸收峰外還存在其他的吸收峰,原因是與剛性結構相關的高轉動態對Franck-Condon一些因素的影響和激發態的相互作用[10]。
圖3 6a的TG曲線Figure 3TG curve of 6a
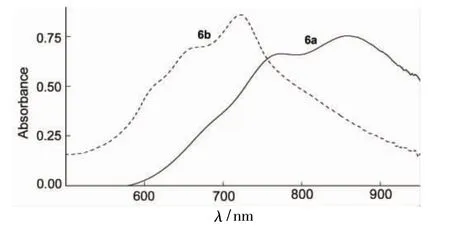
圖4 6a和6b的UV-Vis譜圖*Figure 4UV-Vis spectra of 6a and 6b*c 1×10-5mol·L-1,二氯甲烷為溶劑
(5)FL
圖5為5和6的FL譜圖。由圖5見,5a和6a的最大發射波長(λem)分別為478 nm和743 nm;5b和6b的λem分別為428 nm和736 nm。
從圖5還可以看出,6a和6b從單體結構到聚合物的FL吸收位置發生了很大變化。這是由于6a和6b分別在5a與5b的基礎上進一步引入方酸并進行了聚合,共軛體系增大,降低了LUMO 和HOMO的能壘,使發射峰發生了紅移,表現出較強的熒光性質;6a和6b的FL吸收峰位置沒有發生大的變化,由物質的結構可推知單體結構的變化對聚方酸菁的熒光性質影響不大。但主體結構5b與5a卻從428 nm變化到了478 nm,可推析丁基醚增加了單體結構的共軛性能,從而使其熒光發射峰的位置發生了較大的變化。
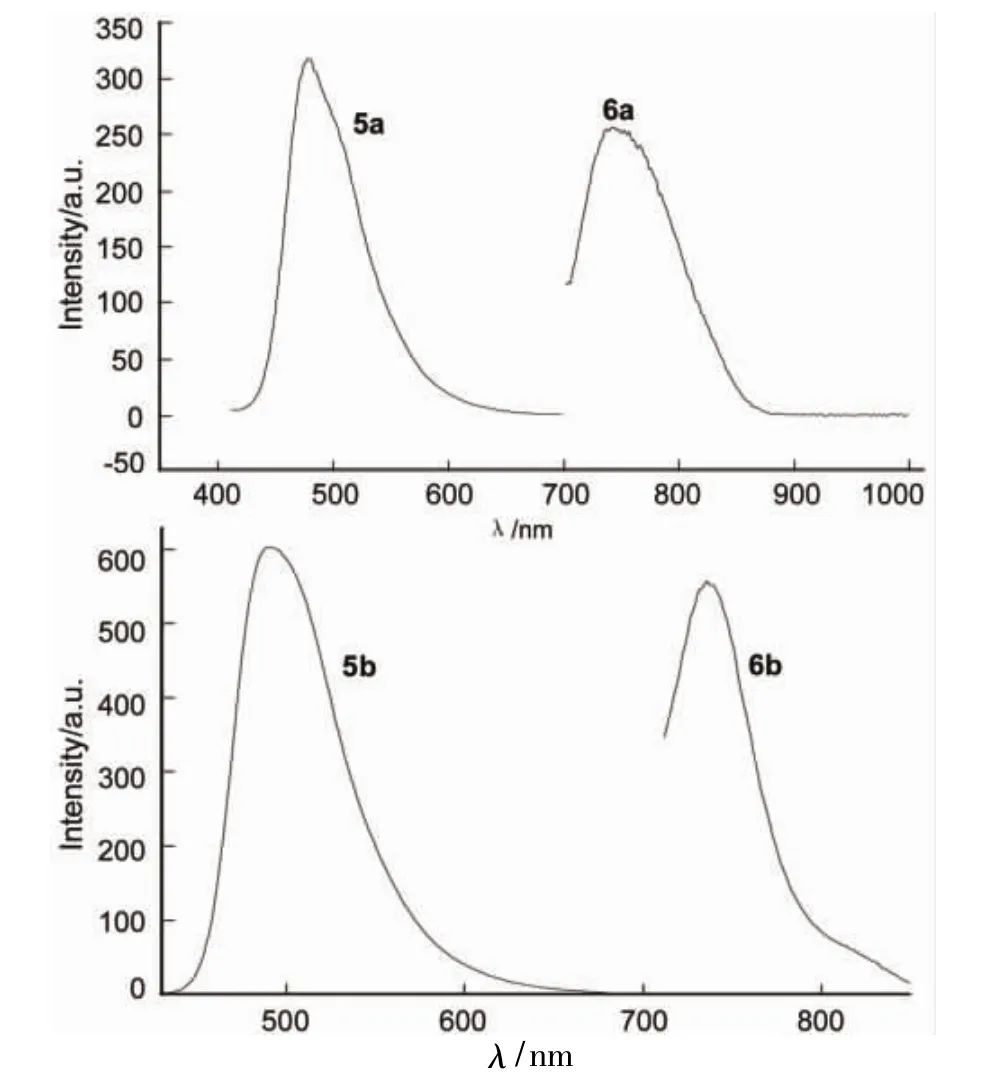
圖5 5和6的熒光發射光譜圖Figure 5Fluorescence spectra of 5 and 6
3 結論
以對二苯酚為原料成功合成了新型聚方酸菁材料(6a和6b)。6a和6b骨架上具有較好共軛結構;其聚集態結構為非晶態;在紫外吸收中在近紅外區中有較強吸收,并具有較好的熱穩定性,在太陽能電池及隱形材料上具有很好的發展空間。
致謝:感謝四川省教育廳自然科學重點項目(09ZA121)“聚方酸菁近紅外材料的工業合成”提供資金支持,感謝實驗室的老師和同學的大力幫助。
[1]鄧繼勇,龍有前,易斌.近紅外吸收功能染料的合成[J].染料和染色,2003,40(4):193.
[2]Volker SebastianF,Uemura S,Limpinsel M,et al.Polymeric squaraine dyes as electron donors in bulk heterojunction solar cells[J].Macromolecular Chemistry and Physics,2010,211(10):1098-1108.
[3]Luca beverina,Patrizio Salice.Squaraine compounds: Tailored design and synthesis towards a variety of material science applications[J].Eur J Org Chem,2010,(7):1207-1255.
[4]Ajayaghosh Ayyappanpillai.Chemistry of squarainederived materials:Near-IR dyes,low band gap systems,and cation sensors[J].Accounts of Chemical Research,2005,38(6):449-459.
[5]陳益釗,蔣青,李聚才,等.硝基苯氧乙酸和1,4-二羥乙基苯二醚制備方法的改進[J].化學試劑,1993,15(4):246-247.
[6]Zhang Hao-Qiang,Jiang Xi-Kui,LI Zhan-Ting.Supramolecular complexation behavior of novel cyclotriveratrylene derivatives with benzoate pendants with C60[J].Chinese journal of chemistry,2001,19(2): 147-153.
[7]Yang Wang gui,Xia Ping Fang,Wong Man Shing. Highly ordered assembly of π-stacked distyrylbenzenes by oligoadenines[J].Organic Letters,2010,12(18): 4018-4021.
[8]Chung S J,Zheng S J,Odani T Beverina L,et al.Extended squaraine dyes with large two-photon absorption cross-sections[J].J Am Chem Soc,2006,128(45): 14444-14445.
[9]Reichstein,Tadeus.Aldehyde syntheses.Comparison of the three simplest five-membered heterocyclic compounds[J].HelveticaChimicaActa,1930,13: 349-356.
[10]Eldo J Ajayaghosh A.New low band gap polymers: Control of optical and electronic properties in near infrared absorbing π-conjugated polysquaraines[J]. Chem Mater,2002,14(1):410-418.
[11]Ajayaghosh A,Eldo J.A new approach toward low optical band gap polysquaraines[J].Organic Letters,2001,3(16):2595-2598.
[12]Ajayaghosh A,Chenthamarakshan C R.Witterionic dye-based conducting polymers.Synthesis and optical properties of pyrrole-derived polysquaraines[J]. Chemistry of Materials,1997,9(3):644-646.
Study of the Synthesis and Performance of New Polysquaraine Materials
CHEN Shu-wei,ZHAN Hao-qiang
(Chemical Synthesis and Pollution Control Key Laboratory of Sichuan Province,College of Chemistry and Chemical Engineering,China West Normal University,Nanchong 637009,China)
The main chain structures of two pyrrole compounds(5a and 5b)were synthesized by Wittig-Horner reaction,and so on using 1,4-benzenediol as the starting material.Two new polysquaraine materials,BPEBP(6a)and BPVOD(6b),were synthesized by polymerization of squaric acid with 5a and 5b,respectively.The structures and performances were characterized by1H NMR,13C NMR,IR,MS,TG,UV-Vis and FL.The performance of 6a and 6b were as follows:The initial decomposition temperature were 282.0℃and 293.8℃;λmaxwere 732 nm and 865 nm;λemwere 478 nm and 428 nm,respectively.
1,4-benzenediol;polysquaraine;Wittig-Horner reaction;synthesis;thermal property; optical property
O626.13;O621.3
A
1005-1511(2014)03-0288-05
2013-01-06;
2014-01-19
四川省教育廳自然科學重點項目(09ZA121)
陳淑偉(1988-),男,山東濟南人,碩士研究生,主要從事功能高分子的研究。
詹豪強,博士,教授,E-mail:1276554568@qq.com

