AlH+離子A2∏態勢能函數的變分研究
劉國躍,廖碧濤,吳 英
(1.綿陽師院計算物理研究中心,綿陽621000;2.綿陽師院物理與電子工程學院,綿陽621000)
1 引 言
雙原子分子離子的正確勢能行為一直是原子與分子物理的重要研究課題,在大氣化學、星云介質、溶液化學、等離子體等研究中起著非常重要的作用[1].比如,離子的勢能行為可以有效地影響基于離子蒸汽的激光泵浦的效率,影響原子與離子間的低能散射截面和分子離子的結構研究等,航空航天技術、激光技術、等離子體技術的發展等也迫切需要分子離子的大量數據[2-4].實驗測量分子離子XY+的勢能數據會隨振動量子數升高而越來越困難,在重要的離解區和漸進區常常缺乏測量結果.量子力學從頭計算是研究雙原子分子離子XY+的勢能行為的重要方法之一,相關的成果報道較多[5,6].但是,有些量子力學從頭計算對原子實極化等重要物理效應處理不夠理想,有的計算選用的基函數和截斷點嘗試性居多物理意義并不很明確等,結果的準確性有時不是很高[7,8].從頭計算方法的結果是數值解,有時不能滿足象碰撞研究這類問題的需要,全程解析勢能函數仍然具有不可替代的作用.
鋁化物及其離子由于固體推進器和爆破中的應用,幾十年來一直受到人們的關注[9],1979年,L.B.Knight等人研究了AlH+自由基離子產生的有關化學反應[10],1982年,Ramsay等人采用紅外吸收光譜技術獲得了AlH+離子基態和低激發態的振轉光譜[11],1984年,Balfour等人采用氣相攝譜技術研究了AlH+離子基態X2∑+和低激發態 A2∏、C2∑+的振轉光譜[12],直到2011年,相關的研究仍有報道,Szajna等人都還在對AlH+離子基態X2∑+和低激發態A2∏進行光譜研究[13];Nguyen等人采用量子力學從頭計算研究了AlH+離子基態X2∑+和低激發態A2∏之間能級躍遷的光譜[14].但是,關于AlH+離子基態X2∑+和低激發態A2∏的勢能數據卻很缺乏,更沒有給出全程解析的勢能函數.本文采用研究雙原子分子離子XY+勢能函數的能量自洽法(Energy-consistentmethod for ion XY+,ECMI)研究了氫化鋁離子AlH+激發態A2∏的解析勢能函數.第二部分是對該方法的描述,第三部分是對氫化鋁離子AlH+激發態A2∏的具體應用,結論和討論放在第四部分.
2 雙原子分子離子XY+的ECMI勢和ECMI方法
帶電的雙原子分子離子XY+的電子結構與中性雙原子分子有所不同.中性雙原子分子失去一個電子就形成了雙原子分子離子XY+,電荷量的改變必然導致電子云的重新分布,電子之間、電子與核之間的相互作用隨之發生了變化,原來中性雙原子分子的Hamilton量中的Coulomb項發生了變化,原子實的極化、電子運動的總角動量、自旋與軌道耦合的情況等都會隨之改變.因此,帶電的雙原子分子離子XY+與中性雙原子分子的解析勢能函數是不同的,若采用中性分子的勢能函數,例如Morse 勢[15]和 Huxley-Murrell-Sorbie(HMS)勢[16,17]等來描述帶電的雙原子分子離子 XY+的勢能行為,有時會產生較大偏差甚至錯誤[18,19],應采用基于變分的雙原子分子離子XY+的能量自洽法(Energy-consistent-method for ion XY+,ECMI)ECMI研究雙原子分子離子XY+的解析勢能函數ECMI勢.
構建雙原子分子離子XY+解析勢能函數Uion(R)的基本物理思想就是在中性雙原子分子XY的勢能函數Umol(R)的基礎上加上變分可調的Coulomb修正項L(R)/R,考慮電子狀態改變造成的能量變化,雙原子分子離子XY+解析勢能函數ECMI勢具有下面的一般形式

這里,I是離化勢,如果選擇將勢井底部放在水平軸上,該常數可以從上述方程中舍去.
Vmol(R)是中性雙原子分子的勢能函數,它是雙原子分子離子XY+的ECMI勢的主體,它的解析形式與HMS勢相同,但要用孫衛國和馮灝用二階微擾理論的結果通過光譜數據求得三階和四階力常數[20]

再按照Huxleyh和Murrell提出的方案用如下的方程來確定展開系數[19]
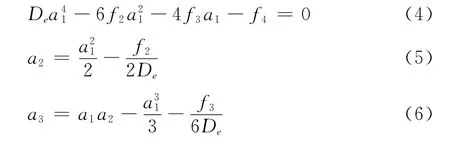
如此確定的HMS勢稱為MHMS勢UMHMS(R)
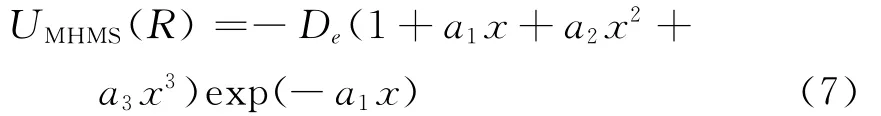
變分可調的Coulomb修正項的確定是困難的.首先,修正項L(R)/R必須在平衡核間距有極小值,即一階導數等于零;其次,修正項必須有良好漸近行為,且當核間距R很大時,修正項的值要趨于零;不能產生物理上不存在的拐點和錯誤發展趨勢,并對中性分子勢能函數MHMS勢可能產生的不足或不準確行為具有校正作用.下面的Coulomb變分修正項滿足了這些要求[18]

這里的λ是變分參數,要采用能量自洽法ECMI來確定.能量自洽法ECM是由孫衛國在1997年提出的根據能量自洽確定中性雙原子勢能函數中變分參數的方法[20,21],后來被改進和推廣成為雙原子分子離子XY+的能量自洽法ECMI[18],主要步驟是:
1)采用給定狀態下的雙原子分子離子XY+的一組基本數據(De,Re,ωe,ωeχe,αe),按照諧振子模型求出二階力常數f2,根據方程(2)和(3)求出三階和四階力常數f3和f4,再由方程(4)~(6)求得MHMS勢的展開系數{an},從而確定了勢能函數的主體MHMS勢.
2)給變分參數λ一個初始值,就給出了雙原子分子離子XY+的一個嘗試解Vion(R,λ),將其帶入徑向薛定諤方程(RSE),運用重歸一的Numerov方法求解,就得到了雙原子分子離子XY+在該電子狀態下的一組振動能級{Gv}.
3)將計算得到的振動能級Gv與實驗或精確理論得到的“真實”振動能級G’v進行比較.
4)如果求出的能級沒有收斂于“真實”能級,則調整變分參數λ,重復步驟(2)和(3),直到求出的能級收斂于“真實”能級,即|Gv-G’v|小于要求的精度,這時相應的λ就是所確定的變分參數值,雙原子分子離子XY+的勢能函數也就完全確定了,并稱為ECMI勢.
3 AlH+激發態A2∏的ECMI勢
采用雙原子分子離子XY+的能量自洽法ECMI研究了AlH+激發態A2∏的解析勢能函數ECMI勢.研究中,采用了原子單位,Eh=1Hartree=219,474.63067cm-1,a0=0.0529176719 nm.基本數據(De,Re,ωe,ωeχe,αe)、求出的力常數{fn}、展開系數{an}和最后確定的變分參數λ均列在表1中.

表1 AlH+離子激發態A2∏的基本數據、求出的力常數、展開系數和變分參數Table 1 Molecular ionic constants,force constants,expansion coefficients and variationalparameter for the exited state A2∏of AlH+
圖1是AlH+離子激發態A2∏的勢能曲線,為了便于比較,采用Le Roy R J在文獻[22]中提到并公布的程序計算出來的RKR數據(〇).Chien-Yu Lien等人采用MCSCF方法,分析了離解能和勢能行為,計算出的離解能明顯低于實驗數據,本文借用了給出的勢能數據(*)[13].由圖可見,這三種不同的勢能函數都很好描述了平衡核間距(Re=2.3506a0)附近的勢能行為,與基于實驗的RKR數據符合得很好.但從偏離平衡核間距不遠約的R=3.6a0開始,Morse勢(---)和 HMS勢(-· -)就開始低于RKR數據,并且隨著核間距的增加,差距越來越明顯,在離解區這樣的差異最大,HMS勢向離解極限收斂比Morse勢更慢;在給出的MCSCF數據范圍內,直到R=5.0a0,MCSCF數據與Morse勢是重合的,但核間距大于5.0a0時,MCSCF數據比Morse勢和HMS勢更低,表現出明顯低于正確離解極限的收斂行為,并且給出的數據非常有限,不能滿足許多研究的需要;而只有ECMI勢(——)一直與RKR數據符合得很好,并給出了全程的勢能數據,所以本文研究的全程解析勢能函數的確非常必要.

圖1 氫化鋁離子AlH+激發態A2∏的勢能曲線.〇代表RKR數據,﹡代表 MCSCF方法的數據,---代表 Morse勢,-· -代表 HMS勢,——代表ECMI勢,變分參數λ=0.763Fig.1 Potential energy curves(PEC)for the electronic state A2∏of AlH+ion.RKR data(〇),MCSCF data(﹡),the HMS potential(-·-),the Morse potential(- --),ECMI potential(——)withλ=0.763
4 結 語
本研究的結果表明,采用中性分子勢能函數描述氫化鋁離子AlH+激發態A2∏的勢能行為在平衡核間距附近幾乎是等價的,但隨著核間距的增大,會表現出不同程度的誤差.雙原子分子離子XY+的能量自洽法ECMI是研究氫化鋁離子AlH+激發態A2∏的勢能行為的好方法,得到的AlH+離子激發態A2∏態的全程解析勢能函數優于中性分子的Morse勢和HMS勢對該分子離子激發態勢能行為的描述.在漸近區和離解區,勢能數據對散射問題等不少研究非常重要和必須,而基于實驗的RKR數據卻沒有;理論方法MCSCF的數據也不完備,并且預計的離解極限與實驗結果差異明顯,只有ECMI勢給出了氫化鋁離子AlH+激發態A2∏正確的全程勢能數據和正確的理解極限,這對相關研究是必須的.
[1]Haridass C,Prasad C V V,Reddy S P.The comettail(A2Pi-X2S+)System of12C16O+:a reinvestigation[J].J.Mol.Spectrosc.,2000,199,180.
[2]Bellomonte L,Cavaliere P,Ferrante G.Alkali molecular ion energies and expectation values in a model-potential treatment[J].J.Chem.Phys.,1974,61,3215.
[3]Bardsley J N,Junker B R,Norcross D W,Pseudopotential calculations for Na2+,Na and Na2[J].Chem.Phys.Lett.,1976,37:502.
[4]Magnier S,Mollie P,Dulieu O,et al.Potential curves for the ground and excited states of the Na2molecule up to the(3s+5p)dissociation limit:results of two different effective potential calculations[J].J.Chem.Phys.,1993,98,7113.
[5]Bowler D R,Bush I J,Gillan M J.Practical methods for ab initio calculations on thousands of atoms[J].Int.J.Quantum.Chem.,2000,77:831.
[6]Cai Z L,Francois J P.Electronic sbsorption spectra of SiC-anion[J].J.Phys.Chem.,1997,A103:275.
[7]Müller W,Meyer W.Ground-state properties of alkali dimers and their cations(including the elements Li,Na,K)fromab initio calculations with effective core polarization potentials[J].J.Chem.Phys.,1984,80:3311.
[8]Sunil K K,lin J,siddiqui H,Siska P E,et al,theoreatical investigation of the a3a3∑+u,A1∑+u,c3∑+gand c1∑+gpotential energy curves of He2and He*(21S,23S)+ He scattering[J].J.Chem.Phys.,1983,78:6190.
[9]Lien C Y,Williams S R,Odom B.Optical pulse-shaping for internal cooling of molecules [J].Phys.Chem.Chem.Phys.,2011,13:18825.
[10]Knight L B,Martin R L,Davidson E R.ERS matrix isolation investigation of aluminum hydride radical cation-AlH+[J].J.Chem.Phys.,1979,71:3991.
[11]Ramsay D A,Sarre P J.High-resolution study of the A2P- X2S+band[J].J.Chem.Soc.Faraday Trans.Ⅱ,1982,78:1331.
[12]Balfour W J and Lindgren B,The A2Π-X2∑+system of AlD+and the C1∑-A1Πsystem of AlD[J].J.Phys.B:At.Mol.Phys.,1984,17 L861.
[13]Szajan W,Zachwieja M.High-resolution emission spectroscopy of A2P- X2S+system of AlH+[J].J.Mol.Spectroscopy.,2011,269:56.
[14]Nguyen J H V,Viteri C R,Hohenstein E G,et.al,Chllenges of laser-cooling molecular ions [J].New Journal of Phys.,2011,13:063023(http://www.njp.org).
[15]Morse P M.Diatomic molecules according to the wavemechanics.Ⅱ.Vibrational levels[J].Phys.Rev.,1929,34:57.
[16]Murrell J N,Sorbie K S.New analytic form for the potential energy curves of stable diatomic states[J].J.Chem.Soc.Faraday Trans.Ⅱ,1974 70:1552.
[17]Huxley P,Murrell J N.Ground-state diatomic potentials[J].J.Chem.Soc.Faraday Trans.Ⅱ,1983 79:323.
[18]Liu G Y,Sun W G,Feng H.Studies on the analytical energy function of diatomic molecular ion XY+using variational method[J].Science in China Ser.G,2004 47:154.
[19]Liu G Y,Sun W G,Feng H.The analytical potential energy function of groung state of halogen hydrogen ion HX+(X=F,Cl,Br,I)using the ion energy consistent method(ECMI)[J].J.At.Mol.Phys.,2007,24:57(in Chinese)[劉國躍,孫衛國,馮灝.用雙原子分子離子XY+的能量自洽發研究鹵化氫離子 HX+(X=F,Cl,Br,I)基態的勢能函數[J].原子與分子物理學報,2007,24:57]
[20]Sun W G,Feng H.An energy consistent method for potential energy curves of diatomic molecules[J].J.Phys.B.,1999,32:5109.
[21]Sun W G.The energy-consistent method for the potential energy curves and the vibrational eigenfunctions of stable diatomic states [J].Mol.Phys.,1997,92:105.
[22]Le Roy R J.Improved parameterization for combined istopomer analysis of diatomic spectra and its application to HF and DF[J].J.Mol.Spectrosc.,1999,194:189.

