甲氨蝶呤血藥濃度監測在兒童白血病中的應用研究
1.江西省贛州市婦女兒童醫院兒科,江西 贛州 341000;2.贛南醫學院第一附屬醫院血液科,江西 贛州 341000; 3.贛南醫學院藥學院,江西 贛州 341000
Abstract:ObjectiveTo explore the values of the patients with childhood leukemia for Methotrexate blood drug concentration monitoring.Methods51 cases of patients with childhood leukemia were divided into observation group(28 cases)and control group(23 cases)according to the doses of MTX,the observation was 3g/m2,the control group was 5g/m2.The blood concentration for the MTX on 48h,72h was tested, the untoward effect was compared for the two groups.ResultsThere was no significant difference on the 48h,72h blood concentration for the two groups(P>0.05).The untoward effect for the observation was lower than the control group(P<0.05).ConclusionThe values of the patients with childhood leukemia for Methotrexate blood drug concentration monitoring is good,it can guide treatment for the patients with ALL, it has clinical value.
Keywords:MTX;Serum concentration monitoring;ALL;applied research
急性淋巴細胞白血病(ALL,Acute Lymphoblastic Leukemia)是最為常見的兒童惡性腫瘤之一,臨床多采取聯合化療的方式進行治療[1]。隨著治療技術的不斷完善,患兒可獲得長期無病生存。ALL患兒是否能夠治療成功與髓外白血病有一定的相關性[2]。白血病作為兒童最常見的惡性腫瘤,約占該時期所有腫瘤的35%[3]。我國每年約有15000左右15歲以下的兒童發生白血病。提高白血病的治愈率,開展和改善白血病的治療方法是血液病工作者的重要任務。大劑量甲氨蝶呤化療是兒童急性淋巴細胞白血病常用的預防中樞神經系統白血病及防止復發的重要手段[4]。國外研究表明,甲氨蝶呤(MTX,Methotrexate)的穩態血藥濃度與預后相關[5]。然而,MTX有一定的細胞毒性,臨床使用易發生惡心、嘔吐等不良反應。本文對大劑量甲氨蝶呤化療后的不良反應進行分析,為研究最為合理的治療髓外白血病的治療方案。
1 資料與方法
1.1 一般資料 收集2012年6月至2014年5月我院收治的住院ALL患兒共計51例,排除難治及合并中樞神經系統白血病的患兒。患兒家屬均簽署知情同意協議書,且能配合完成本研究。其中,男孩25例,女孩26例,患兒年齡范圍為1~14歲,平均年齡為(5.21±1.55)歲。經MIC分型(包括形態學、免疫學和細胞遺傳學)診斷確診。根據治療時MTX的用藥劑量,將患兒分為觀察組(28例)和對照組(23例)。觀察組:男孩13例,女孩15例,患兒年齡范圍為1~14歲,平均年齡為(5.04±1.22)歲。對照組:男孩12例,女孩11例,患兒年齡范圍為1~14歲,平均年齡為(5.25±1.17)歲。經統計學分析,兩組患兒在性別、年齡等一般資料方面,差異無統計學意義(P>0.05),具有可比性。
1.2 方法 觀察組MTX劑量為3g/m2,對照組MTX劑量為5g/m2,均以總量的1/6為突擊量進行靜脈滴注,于30min內完成后,剩余量在24h內勻速靜脈滴注。突擊量MTX滴入后0.5~2h內進行三聯鞘內注射1次。所有白血病患兒在大劑量MTX持續48h靜脈滴注結束時采集靜脈血2ml,立即送檢。如果患兒48h的穩態血藥濃度在目標濃度以上,下次甲氨蝶呤的不調整,低于目標濃度的根據血藥濃度值按比例增加甲氨蝶呤的劑量,直到達到目標濃度[6]。
1.3 觀察指標 在大劑量MTX首次用藥開始后,分別在48h、72h測定MTX血藥濃度;觀察兩組患兒不良反應發生情況。
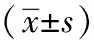
2 結果
2.1 MTX靜脈滴注48h血藥濃度分布 兩組患兒MTX靜脈滴注48h血藥濃度分布情況如表1所示。結果表明,兩組患兒在MTX靜脈滴注48h血藥濃度分布差異無統計學意義(P>0.05)。

表1 兩組患兒MTX靜脈滴注48h血藥濃度分布情況[例(%)]
2.2 MTX靜脈滴注72h血藥濃度分布 兩組患兒MTX靜脈滴注72h血藥濃度分布情況如表2所示。結果表明,兩組患兒在MTX靜脈滴注72h血藥濃度分布差異無統計學意義(P>0.05)。

表2 兩組患兒MTX靜脈滴注72h血藥濃度分布情況[例(%)]
2.3 兩組患兒不良反應發生情況比較 觀察組不良反應(主要表現為胃腸道反應、肝功能受損、皮膚過敏)顯著低于對照組,差異具有統計學意義(P<0.05)。

表3 兩組患兒不良反應發生情況比較[例(%)]
注:與對照組比較,*P<0.05。
3 討論
ALL是兒童最常見的惡性腫瘤,目前國內治療可達到長期無病生存率70%的效果[7],其余30%左右兒童ALL復發,其中5~10%的發生中樞神經系統白血病(CNSL)[8]。國內研究均建議使用3~5療程大劑量MTX進行ALL治療及預防復發[9]。但文獻也對大劑量MTX的毒副作用進行了報道:MTX在殺死腫瘤細胞的同時也會對正常的細胞進行殺傷效應,對患者造成不同程度的損傷[10]。MTX造成的損傷不良反應主要包括肝臟損傷、胃腸道反應、骨髓抑制以及皮膚損傷等[11]。許靜等[12]研究表明,不良反應的發生與甲氨蝶吟血藥濃度的高低、血漿有毒濃度維持時間的長短以及聚谷氨酸鹽(methotrexate polyglutamate,MTXPG)在細胞內的濃度和鏈長度有密切關系,其中MTXPG在細胞內的濃度和鏈長度是細胞毒性作用的主要因素。
MTX具有對抗葉酸代謝的作用,能夠對腫瘤細胞周期產生影響,具有廣譜抗腫瘤活性作用。MTX的主要作用機制為通過細胞膜上的還原葉酸鹽載體進入細胞內,并在一種合成酶的作用機制下與谷氨酸相連接,形成長鏈氨基酸甲氨蝶呤聚谷氨酸[13]。該物質可競爭性抑制二氫葉酸還原酶的活性,阻斷二氫葉酸轉換成具有活性的四氫葉酸,從而影響核酸以及蛋白質的合成,達到殺傷腫瘤細胞的目的[14]。大劑量MTX化療后藥代動力學研究表明,MTX的抗白血病作用強度與用藥后所達到的血藥濃度水平和有效濃度維持的時間呈正相關,只有當透過血腦屏障的MTX達到一定的濃度時才能對庇護所中的白血病細胞起到抑制耐藥腫瘤細胞和隱蔽在庇護所的腫瘤細胞起到強大的殺傷作用,可有效預防中樞神經系統與翠丸白血病的發生,提高長期無病生存率[15]。
本研究對不同劑量MTX治療ALL的臨床效果進行了血藥濃度監測并對其毒副作用進行了觀察,結果顯示兩組患兒在MTX靜脈滴注48h和72h血藥濃度分布上無統計學差異。提示大劑量MTX在血藥濃度上并不具有顯著的臨床優勢;而大劑量MTX組患兒不良反應(主要表現為胃腸道反應、肝功能受損、皮膚過敏)發生率顯著高于小劑量組患兒,提示大劑量MTX毒副作用明顯,嚴重影響患兒預后。因此,臨床治療中應以血藥濃度監測結果知道MTX用藥劑量,能夠在保證血藥濃度的基礎上,有效降低不良反應發生率,提高治療和預后效果。
總之,甲氨蝶呤血藥濃度監測能夠指導患兒白血病治療,臨床應用和推廣價值較高。
[1]Shima T,Miyamoto T,Kikushige Y,et al.The ordered acquisition of Class II and Class I mutations directs formation of human t(8;21) acute myelogenous leukemia stem cell[J].Exp Hematol, 2014,472(14):621-623.
[2]D'Souza P,Walker G.Spotlight on chronic lymphocytic leukemia: A Pharma Matters report[J].Drugs Today (Barc),2014,50(7):485-501.
[3]Lv QW,Zhang W,Shi Q,et al.Response to D.M.Marcus's comment on the TRIFRA study (comparison of Tripterygium wilfordii Hook F vs methotrexate in the treatment of active rheumatoid arthritis)[J].Ann Rheum Dis,2014,73(9):57.
[4]羅華山.大劑量甲氨蝶呤治療兒童急性淋巴細胞白血病的臨床觀察[J].中國當代醫藥,2012,6(5):76-77.
[5]McLaren JF,Barnhart KT,Sammel MD,et al.Success of the two-dose methotrexate protocol for treatment of ectopic pregnancy in women with a history of prior ectopic pregnancy[J].J Reprod Med,2014,59(7):379-384.
[6]黃志君,黃立秋,榮穎慈.兒童甲氨蝶呤血藥濃度監測結果回顧性分析[J].中國實用醫藥,2011,30(8):144-145.
[7]Mori T,Fukano R,Saito A,et al.Japanese Pediatric?Leukemia/Lymphoma Study Group[J].Rinsho Ketsueki,2014,55(5):526-533.
[8]Szumera-Cie?kiewicz A,Nasilowska-Adamska B,Prochorec-Sobieszek M,et al.Isolated extramedullary breast relapses in inv(16) positive and c-KIT negative acute myeloid leukemia after allogenic hematopoietic stem cell transplantation - description of two cases[J].Arch Med Sci,2014,10(3):632-635.
[9]王軍,宋森花,鄭云艷,等.大劑量甲氨蝶呤在治療急性淋巴細胞白血病中血藥濃度監測的意義[J].華南國防醫學雜志,2014,28(3):215-217.
[10]Stenehjem DD,Albright F,Kuo KL,et al.Response monitoring,tolerability,and effectiveness of imatinib treatment for chronic myeloid leukemia in a retrospective research database[J].J Natl Compr Canc Netw,2014,12(8):1113-1121.
[11]段彥龍,張永紅,石慧文,等.兒童急性白血病應用大劑量甲氨蝶呤嚴重并發癥3例臨床分析及文獻復習[J].中國小兒血液與腫瘤雜志,2013,18(6):277-281.
[12]許靜,徐康康,李天媛,等.還原葉酸載體基因G80A多態性與急性淋巴細胞白血病患兒甲氨蝶吟血藥濃度及不良反應的關系研究[J].中國藥房,2009,20(35):2739-2742.
[13]許宏,宋文琪,徐巍.兒童急性淋巴細胞白血病終了中甲氨蝶呤血藥濃度監測分析[J],中國新藥與臨床雜志,2010,32(11):850-852.
[14]張春燕,顧健,李玉珍,等.大劑量甲氨蝶呤治療329例兒童急性淋巴細胞白血病的群體藥物動力學研究[J].中國實驗血液學雜志,2008,16(1):106-110.

