糖調節受損大鼠認知障礙及腦組織NF-κBp65、TNF-α 的表達
董銀華,王洪新,陳澤峰,魏 佳,趙 嵐,李 強,范宏光
糖調節受損(impaired glucose regulation,IGR)是糖尿病前期糖調節失衡的一種表現,一般包括空腹血糖受損(impaired fasting glucose,IFG)和糖耐量受損(impaired glucose tolerance,IGT)。糖尿病是一個較早就被證實與認知功能障礙相關的因素[1],然而糖耐量受損作為糖尿病前期的一個重要臨床階段,是否與認知功能障礙相關,至今尚無定論[2]。本研究通過建立糖調節受損大鼠模型,從炎癥機制角度探討糖調節受損與認知障礙的關系。
1 材料和方法
1.1 動物模型制備 SPF 級雄性Wistar 大鼠50 只,體重180~200 g,由中國人民解放軍軍事醫學科學院實驗動物中心提供,許可證號:SCXK-(軍)2007-004,隨機分為對照組(NGT 組)和實驗組(IGR組),每組25 只。兩組均適應性喂養1 w(不計入實驗周期),NGT 組給予普通飼料;IGR 組給予高脂高糖飼料,自由進水,室溫18 ℃~22 ℃,飼養20 w。從第8 周開始,每2 w 取鼠尾靜脈血進行一次葡萄糖耐量實驗,空腹血糖6.2~7.5 mmol/L 或者餐后2 h 血糖7.9~10.4 mmol/L 的大鼠造模成功[3]。
1.2 行為學檢測 NGT 組和IGT 組分別于第5 周、第10 周、第15 周、第20 周,采用Morris 水迷宮試驗測定包括:適應性訓練、定位航行實驗、空間探索試驗測定大鼠學習記憶能力,評定認知功能。
1.3 腦組織NF-κBp65、TNF-α 免疫組織化學檢測 造模成功后,每組每個時間點隨機取5 只大鼠深度麻醉后,4%多聚甲醛灌注后,斷頭取腦,以視交叉前緣作后作冠狀位切片,行4 μm 厚的連續切片,然后依次脫水、透明、浸蠟和包埋。石蠟切片經脫蠟、水化,分別滴加第一抗體NF-κB、TNF-α,并4 ℃過夜。滴加生物素標記體,37 ℃孵育30 min。滴加過氧化物-鏈霉素卵白素37 ℃孵育30 min。DAB 顯色,蘇木素復染。目鏡測微尺在200 倍視野下計數細胞,分別取大鼠腦組織連續切片10 片,每片選10 個陽性視野,計數網格中陽性細胞數,重復3 次,取其平均值。
1.4 腦組織NF-κB mRNA、TNF-α mRNA 原位雜交檢測 原位雜交寡核苷酸探針試劑盒購自武漢博士德公司,用生物素標記。切片透明脫水后用0.01 mmol/L PBS 沖洗,0.2 mmol/L 鹽酸室溫酸化10 min,再次0.01 mmol/L PBS 沖洗后以25 μg/ml 蛋白酶K73 ℃消化10 min,并以2.5 g/L 乙酸酐平衡后,浸入90%(體積分數)乙醇脫水。切片在空氣中干燥后,用2 μg/ml 的生物素標記寡核苷酸探針孵育組織(30 μl/切片),42 ℃孵育過夜(對照:雜交反應液中不加探針,用有意義鏈作探針)。雜交后系列SSC 洗滌封閉,置0.3%(體積分數H2O230 min),而后4 ℃抗生物素血清過夜,置試劑盒ABC 液室溫孵育2 h,DBA 室溫染色5 min,陽性反應呈棕褐色。
2 結果
2.1 糖耐量損害大鼠成模情況 高脂高糖飼料飼養10 w 大鼠成模率60%;飼養15 w 大鼠成模率100%,模型組死亡2 只,及時補充。
2.2 認知功能評定情況 第5 周IGR 組較NGT 組逃避潛伏期短,空間探索時間長,隨著飼養周期的延長,糖調節損害大鼠逐漸成模;第15 周IGR 組大鼠全部成模,IGR 大鼠較NGT 組大鼠逃避潛伏期延長,空間探索穿臺次數減少,實驗結果有統計學差異(P<0.05);20 w 時IGR 組與NGT 組大鼠比較學習記憶能力顯著下降(P<0.01)(見表1)。NGT 組內不同時間點比較無差別,IGR 組自10 w 以后逐漸下降,差別顯著(P<0.01)。隨著飼養周期的延長,達到糖調節受損狀態,大鼠的學習記憶能力明顯降低。
2.3 大鼠腦 組織NF-κBp65、TNF-α 及NFκBp65mRNA、TNF-αmRNA 表達 NF-κBp65、TNF-α陽性表達為胞漿呈現棕黃色,強陽性時細胞核也出現棕黃色顆粒,胞核藍染。采用平均灰度值比較大鼠腦組織NF-κBp65 和TNF-α 蛋白及mRNA 陽性表達水平。在第5 周IGR 組與NGT 組兩因子表達無差異(P>0.05);與NGT 組比較第10 周IGR 組NFκBp65 及mRNA 表達有差異(P<0.05);第15 周、第20 周逐漸增高,組間差異有統計學意義;與NGT組比較第15 周IGR 組TNF-α 及TNF-α mRNA 表達有差異(P<0.05);第20 周有顯著差異(P<0.01),具體結果(見表2~表5)。
2.4 NF-κBp65 及TNF-α 的表達水平與認知之間的關系 Pearson 直線相關回歸分析發現,IGR組大鼠學習記憶成績與NF-κBp65 陽性表達水平呈正相關(r=0.472,P<0.05),與TNF-α 陽性表達水平呈正相關(r=0.475,P<0.05),而NGT 組兩者無明顯相關性(r=0.260,P>0.05)。
表1 兩組大鼠學習記憶能力(±s)
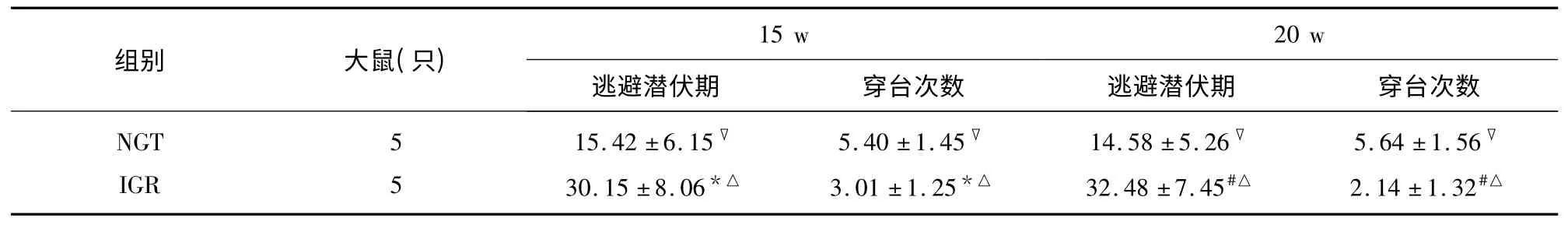
表1 兩組大鼠學習記憶能力(±s)
與NGT 組比較* P<0.05,#P<0.01;與NGT 組內比較▽P>0.05;IGR 組10 w 以后比較△P<0.01
表2 兩組大鼠不同時間點腦組織NF-κB 平均灰度值比較(±s)

表2 兩組大鼠不同時間點腦組織NF-κB 平均灰度值比較(±s)
與NGT 組比較* P>0.05,#P<0.05,▽P<0.01
表3 兩組大鼠不同時間點腦組織TNF-α 平均灰度值比較(±s)
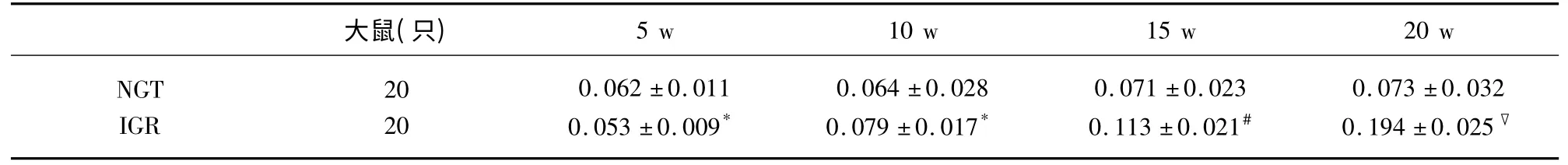
表3 兩組大鼠不同時間點腦組織TNF-α 平均灰度值比較(±s)
與NGT 組比較* P>0.05,#P<0.05,▽P<0.01
表4 兩組大鼠不同時點腦組織NF-κB p65 mRNA 平均灰度值比較(±s)
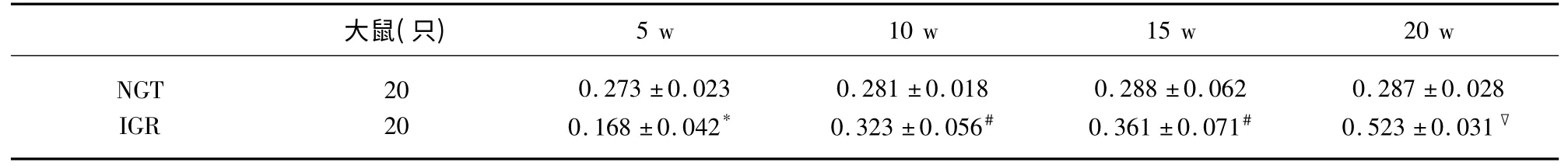
表4 兩組大鼠不同時點腦組織NF-κB p65 mRNA 平均灰度值比較(±s)
與NGT 組比較* P>0.05,#P<0.05,▽P<0.01
表5 兩組大鼠不同時間點腦組織TNF-α mRNA 平均灰度值比較(±s)
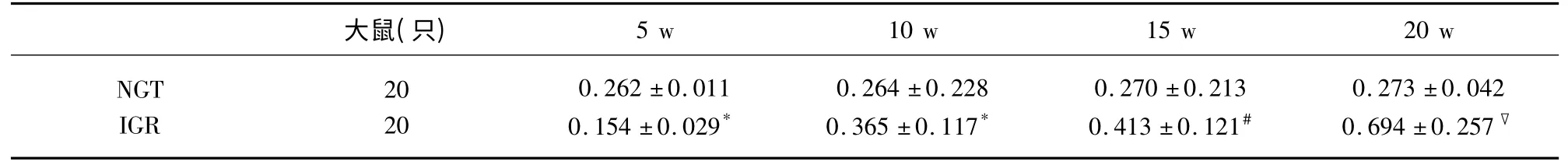
表5 兩組大鼠不同時間點腦組織TNF-α mRNA 平均灰度值比較(±s)
與NGT 組比較* P>0.05,#P<0.05,▽P<0.01
3 討論
糖調節受損(IGR)是糖尿病前期狀態,是糖尿病的高危人群。糖尿病是癡呆的高危因素已被公認。英國前瞻性糖尿病研究發現,新診斷的2 型糖尿病半數已有血管病變,提示血管病變可發生于糖尿病之前,即在IGR 階段已經有炎性反應的發生,且可能與血管性認知障礙有關[4]。有研究報道[5]在60 歲以上老年患者人群中正常范圍高血糖水平海馬與杏仁核萎縮明顯,認知功能減低明顯。這也提示在診斷糖尿病之前高血糖水平已經對腦組織造成損害,影響老年人的認知功能。近年研究發現較多的炎性因子在胰島素抵抗和IGR 的發生中具有重要作用,如C 反應蛋白、腫瘤壞死因子-α 等都與糖耐量損害有關[6]。
核轉錄因子NF-κB,在靜息狀態下以二聚體狀態在細胞漿內與IκB 結合,激活后與IκB 解離,NFκB 核因子定位序列暴露,NF-κB 進入細胞核內,以二聚體的形式起轉錄調節作用,從而誘導白細胞介素-1、細胞間粘附分子、腫瘤壞死因子(TNF-α)等的表達,白細胞在各種炎性介質的介導下,向血管內皮細胞移動、粘附并滲出,參與炎癥的的級聯反應,最終導致缺血性神經元的損傷,另外各項因子如腫瘤壞死因子、白介素的表達反過來進一步增加NF-κB從而進一步促進炎癥因子的表達,進一步加重炎癥反應,形成惡性循環[7~9]。
本研究發現造模成功,第15 周后認知功能評價,糖調節受損大鼠學習記憶、能力明顯遲滯于對照組大鼠,而且隨著時間的延長這種趨勢愈加明顯;同時研究發現糖調節受損大鼠腦組織第10 周開始NFκBp65 蛋白表達NF-κBp65 mRNA 的表達均高于正常對照組,TNF-α 蛋白表達和TNF-α mRNA 的表達第15 周開始表達明顯增高,兩組間差異均有統計學意義,而炎癥因子表達不同步的原因可能與上游NFκBp65 炎性激活的過程有關。Pearson 直線相關回歸分析糖調節受損大鼠認知功能與NF-κB、TNF-α 的陽性表達水平呈正相關。
因此本研究認為炎癥機制在認知障礙的發病過程中起著重要的作用,大鼠腦組織NF-κB 和TNF-α炎性因子,參與了大鼠認知功能障礙形成的過程。
綜上,糖耐量受損大鼠腦組織炎性因子NF-κB、TNF-α 的表達明顯高于對照組,且與大鼠認知功能障礙明顯相關,本研究從炎癥角度探討了糖調節受損對大鼠認知功能障礙的影響,認為炎癥機制是糖調節受損認知功能障礙的重要機制,抗炎治療可能是防治糖調節受損認知功能障礙的重要靶點。
[1]Dash SK.Cognitive impairment and diabetes[J].Recent Pat Endocr Metab Immune Drug Discov,2013,7(2):155-165.
[2]Daniel J,Boris P,Linda A,et al.Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 diabetes[J].Diabetes Care,2005,28:71-77.
[3]王 竹,楊月欣,向雪松,等.實驗大鼠血糖正常范圍的估算[J].衛生研究,2010,39(2):133-142.
[4]Debeng D,Amelang M,Hasselbach P,et al.Diabetes and cognitive function in a population-based study of elderly women and men[J].J Diabetes Complications,2006,20(4):238-245.
[5]Lucia Kerti,Veronica Witte,Angela Winkler,et al.Higher glucose levels associated with lower memory and reducedhippocampal microstructure[J].Neurology,2013,81:1746-1752.
[6]Griffin WS.Inflammation and neurodegenerative disease[J].Am J Clin Nutr,2006,83(Suppl):470-474.
[7]Cora H,Nijboer,Cobi J,et al.A dual role of the NF-kappa B pathway in neonatal hypoxic-ischemic brain damage[J].Stroke,2008,39:2578-2586.
[8]Kaltschmidt B,Kaltschmidt C.NF-κB in the nervous system[J].Cold Spring Harb Perspect Biol,2010,2(1):a001271.
[9]Kaltschmidt B,Ndiaye D,Korte M,et al.NF-kappaB regulates spatial memory formation and synaptic plasticity through protein kinase A/CREB signaling[J].Mol Cell Biol,2006,26(8):2936-2946.

