響應面法優(yōu)化復合酶提取蘆薈多糖工藝及其抗氧化活性分析
李亞輝,馬艷弘,*,黃開紅,趙延存,張宏志,王光祠
(1.江蘇省農業(yè)科學院農產品加工研究所,江蘇 南京 210014;2.徐州華瑞蘆薈制品有限公司,江蘇 徐州 221700)
響應面法優(yōu)化復合酶提取蘆薈多糖工藝及其抗氧化活性分析
李亞輝1,馬艷弘1,*,黃開紅1,趙延存1,張宏志1,王光祠2
(1.江蘇省農業(yè)科學院農產品加工研究所,江蘇 南京 210014;2.徐州華瑞蘆薈制品有限公司,江蘇 徐州 221700)
研究復合酶提取蘆薈多糖的工藝,并測定其抗氧化性。在單因素試驗的基礎上,利用響應面法對復合酶提取蘆薈多糖的條件進行了優(yōu)化,通過測定蘆薈多糖的總抗氧化能力、DPPH自由基和羥自由基清除能力研究其抗氧化性。結果顯示,當料液比1∶30(g/mL)、果膠酶與纖維素酶配比1∶3、pH 4.5時,優(yōu)化最佳提取條件為加酶量0.3%、酶解溫度48 ℃、酶解時間40 min,此條件下蘆薈多糖的提取率為5.65%,和超聲波輔助法相比提取率提高了4.2%。蘆薈多糖具有較好的抗氧化性,隨著質量濃度的增加,其總抗氧化能力、DPPH自由基和羥自由基清除能力逐漸增強,在25 mg/mL時其DPPH自由基和羥自由基清除率分別達到75%和90%。復合酶法是一種新的、有效的蘆薈多糖提取方法;蘆薈多糖具有較好的抗氧化性。
復合酶法;蘆薈多糖;響應面法;抗氧化性
蘆薈為百合科蘆薈屬多年生常綠肉質草本植物,分布于熱帶和亞熱帶地區(qū),目前已有品種600多種,是廣泛應用的天然藥用植物,其中庫拉索蘆薈、木立蘆薈和中華蘆薈等具有重要的食用價值和藥用價值[1]。蘆薈的化學成分較為復雜,主要包含蒽醌類物質、多糖類物質、氨基酸、有機酸、維生素、礦物質及微量元素等[2]。其中蘆薈多糖是蘆薈凝膠中的主要生物活性物質,具有免疫調節(jié)、抗菌、抗病毒、抗腫瘤、抗氧化、防衰老、防治艾滋病、防止糖尿病、提高免疫力等多種功效[3-8]。
蘆薈中多糖是一種混合多糖,其含量、種
類、組成和結構具有較大差異,相對分子質量約在12 000~7 000 000之間[9-10]。這些多糖主要由葡萄糖、半乳糖、甘露糖和阿拉伯糖等通過β-1-4糖苷鍵連接而成,大多數蘆薈多糖中都含有乙酰化的甘露糖結構[9]。目前,關于蘆薈多糖的提取方法國內外已有較多報道,主要有熱水浸提法、微波輔助法、超聲波輔助法[11-15],超臨界流體萃取法報道較少,但用酶法提取蘆薈多糖尚未有報道。植物細胞壁中含有果膠和纖維素,果膠酶和纖維素酶可破壞植物細胞壁,提高細胞壁和細胞膜的通透性,加速細胞內溶物的溶出[16-21]。果膠酶和纖維素酶作用條件溫和且容易控制,采用兩者輔助提取植物細胞內有效成分會具有較好效果[22-24]。蘆薈作為一種保健食品,目前對其多糖的功能性研究主要側重于抗腫瘤、抗病毒、提高免疫力等方面,而對其抗氧化方面的報道還較少。因此,本研究利用果膠酶和纖維素酶提取蘆薈多糖,通過響應面分析得到最佳提取工藝條件,并對其抗氧化性進行了初步研究。這對蘆薈多糖的提取、加工、利用及功能性研究具有重要意義。
1 材料與方法
1.1 材料與試劑
庫拉索蘆薈由徐州華瑞蘆薈制品有限公司提供。
羥自由基清除能力試劑盒 南京建成生物工程研究所;果膠酶 上海杰兔工貿有限公司;纖維素酶 無錫明輝國際貿易有限公司化工分公司;其他試劑均為市售分析純。
1.2 儀器與設備
UV-3802H紫外-可見分光光度儀 上海尤尼柯儀器有限公司;R-120型旋轉蒸發(fā)器 瑞士Büchi公司;LG10-2.4A高速離心機 北京醫(yī)用離心機廠;DHG-9070電熱鼓風干燥箱 上海齊欣科學儀器有限公司;HH-2數顯恒溫水浴鍋 國華電器有限公司。
1.3 方法
1.3.1 蘆薈前處理
取新鮮蘆薈葉洗凈去刺,切成5 mm薄片,用鼓風干燥箱50 ℃烘干。將烘干的蘆薈葉放入粉碎機粉碎,制成蘆薈粉,置于棕色瓶內密封保存?zhèn)溆谩?/p>
1.3.2 蘆薈多糖的提取
1.3.2.1 復合酶法提取
將蘆薈干粉按一定料液比加入到蒸餾水中,復水30 min,調節(jié)其pH值,加入一定量按一定比例混合的果膠酶和纖維素酶復合酶,在一定溫度條件下水浴提取一定時間。將提取液真空抽濾,取濾液并真空旋轉蒸發(fā)至體積約10 mL,然后加入5 倍體積的無水乙醇,混合均勻,置于4 ℃冰箱靜置12 h,再將其在3 000 r/min轉速下離心10 min,沉淀即為粗多糖。
1.3.2.2 超聲波輔助提取
將蘆薈干粉按料液比1∶30(g/mL)加入到蒸餾水中,復水30 min,然后在70 ℃條件下利用超聲波(超聲功率600 W、超聲時間15 min)輔助進行提取,提取液按照1.3.2.1節(jié)中方法處理得粗多糖。
1.3.3 蘆薈多糖提取率的測定
以葡萄糖溶液為標準溶液,繪制標準曲線所得回歸方程為:C=0.997A-0.000 7,R2=0.998 5,式中:C為葡萄糖質量濃度/(mg/mL);A為吸光度。
采用苯酚-硫酸法測定多糖含量,通過測定樣品的吸光度,帶入標準曲線,可得多糖質量濃度,并計算多糖提取率。

1.3.4 單因素試驗
按照1.3.2.1節(jié)所述復合酶法,分別研究了料液比、果膠酶與纖維素酶配比、pH值、加酶量、酶解溫度和酶解時間對蘆薈多糖提取率的影響。
1.3.5 響應面試驗設計
在單因素試驗結果基礎上,選擇料液比1∶30(g/mL)、果膠酶與纖維素酶配比1∶3、pH 4.5,采用Box-Behnken試驗設計,以加酶量、酶解溫度和酶解時間3 個因素為自變量,進行響應面分析,分別記為X1、X2、X3,并以-1、0、1分別代表自變量的低、中、高3 個水平,按方程xi=(Xi-X0)/X對自變量進行編碼,其中xi為自變量編碼值,Xi為自變量真實值,X0為試驗中心點處自變量真實值,X為自變量變化步長,試驗因素水平設計見表1。

表1 響應面試驗設計因素與水平Table 1 Factors and levels used in response surface methodology
1.3.6 蘆薈多糖的抗氧化性分析
1.3.6.1 總抗氧化能力測定
采用FRAP法[25]。取1 mL不同質量濃度的蘆薈多糖水溶液進行實驗,空白組用水代替,對照組用同等質量濃度的VC代替,每個樣品重復測定3 次。以1.0 mmol/L FeSO4溶液為標準,樣品抗氧化活性以達到同樣吸光度所需FeSO4的濃度(μmol/L)表示,定義為FRAP值。
1.3.6.2 DPPH自由基清除能力測定
參考Atoui等的測定方法[26]。取1 mL不同質量濃度的蘆薈多糖水溶液進行實驗,空白組用水代替樣品,對照組用同等質量濃度的VC代替,每個樣品重復3 次。

式中:A1為樣品組的吸光度,A0為對照組的吸光度。
1.3.6.3 羥自由基清除能力測定
采用2-脫氧核糖法[27]。取500 μL不同質量濃度的蘆薈多糖水溶液進行實驗,空白組用水代替樣品,對照組用同等質量濃度的VC代替,每個樣品重復3 次。

式中:A1為樣品組的吸光度,A0為空白組的吸光度。
1.4 數據分析
利用SPSS 18.0和Design-Expert V8.0數據處理軟件進行數據處理及統(tǒng)計分析。
2 結果與分析
2.1 復合酶法提取蘆薈多糖的單因素試驗
2.1.1 料液比對多糖提取率的影響
在果膠酶與纖維素酶配比1∶2、pH 5.0、加酶量0.2%條件下,40 ℃酶解30 min,料液比對多糖提取率的影響如圖1所示。隨著提取液用量的增加多糖提取率逐漸升高,但料液比在1∶30之后提取率增加幅度明顯減小,因此選擇1∶30為最佳料液比。

圖1 料液比對多糖提取率的影響Fig.1 Effect of solid-to-liquid ratio on the extraction yield of aloe polysaccharides
2.1.2 果膠酶與纖維素酶配比對多糖提取率的影響
在料液比1∶2 0(g/mL)、pH 5.0、加酶量0.2%條件下,40 ℃酶解30 min,果膠酶與纖維素酶配比對多糖提取率的影響如圖2所示。隨著纖維素酶含量的增多,多糖提取率逐漸升高,可能是因為蘆薈細胞壁中纖維素含量較高,提高纖維素酶量可以使細胞壁破裂更快更徹底,從而使多糖溶出更多。當果膠酶與纖維素酶比例小于1∶3時,多糖提取率增加幅度明顯減小,因此選擇1∶3為果膠酶與纖維素酶的最佳配比。
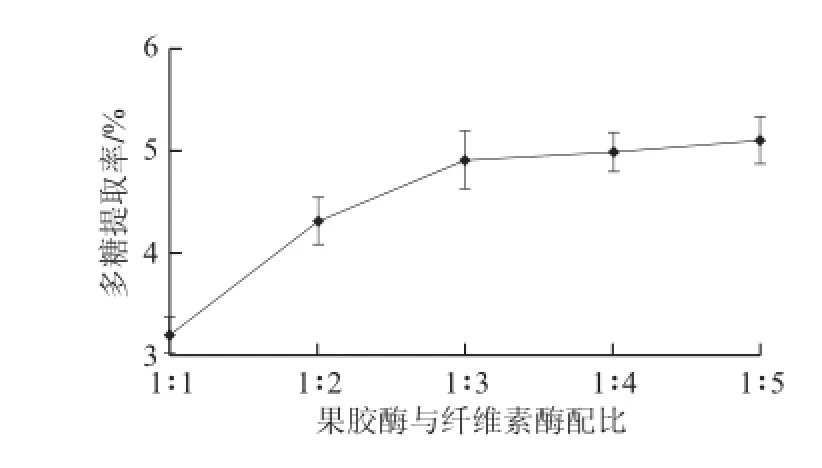
圖2 果膠酶與纖維素酶配比對多糖提取率的影響Fig.2 Effect of pectinase/cellulase ratio on the extraction yield of aloe polysaccharides
2.1.3 pH值對多糖提取率的影響
在料液比1∶20(g/mL)、果膠酶與纖維素酶配比1∶2、加酶量0.2%條件下,40 ℃酶解30 min,pH值對多糖提取率的影響如圖3所示。當反應液pH值小于4.5時,多糖提取率隨著pH值的升高逐漸升高,當pH值大于4.5時,提取率隨著pH值的升高逐漸降低,pH 4.5可能是果膠酶和纖維素酶這兩種酶酶解蘆薈細胞壁的最佳pH值,在此條件下蘆薈細胞壁破裂較快,從而使較多多糖溶出,因此選擇pH 4.5為提取液最佳pH值。

圖3 反應液pH值對多糖提取率的影響Fig.3 Effect of hydrolysis pH on the extraction yield of aloe polysaccharides
2.1.4 加酶量對多糖提取率的影響
在料液比為1∶20(g/mL)、果膠酶與纖維素酶配比1∶2、pH 5.0條件下,40 ℃酶解30 min,復合酶添加量對多糖提取率的影響如圖4所示。隨著加酶量的增大,多糖提取率逐漸增大,但當加酶量大于0.3%時提取率增加幅度明顯減小,考慮到實際生產中成本問題,選擇復合酶最佳添加量為0.3%。

圖4 復合酶添加量對多糖提取率的影響Fig.4 Effect of total enzyme dosage on the extraction yield of aloe polysaccharides
2.1.5 酶解溫度對多糖提取率的影響
在料液比1∶20(g/mL)、果膠酶與纖維素酶配比1∶2、pH 5.0、酶解30 min條件下,酶解溫度對多糖提取率的影響如圖5所示。在50 ℃時提取率最高,此溫度可能是果膠酶與纖維素酶在提取條件下的最適溫度,因此選為最佳提取溫度;60 ℃時提取率降低可能是因為酶的活力下降造成的;70 ℃時提取率升高可能是因為當酶失活后高溫可增加多糖的溶出造成的。
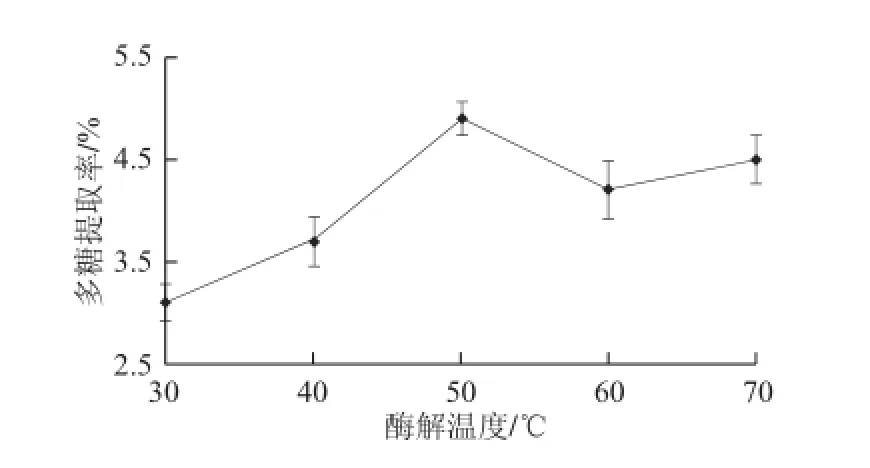
圖5 酶解溫度對多糖提取率的影響Fig.5 Effect of hydrolysis temperature on the extraction yield of aloe polysaccharides
2.1.6 酶解時間對多糖提取率的影響
在料液比1∶20(g/mL)、果膠酶與纖維素酶配比1∶2、pH 5.0、酶解溫度40 ℃條件下,酶解時間對多糖提取率的影響如圖6所示。隨著酶解時間的延長,多糖提取率逐漸增大,但當酶解時間大于60 min時提取率增加的幅度明顯減小,所以選擇最佳酶解時間為60 min。 2.2 復合酶法提取蘆薈多糖的響應面優(yōu)化

圖6 酶解時間對多糖提取率的影響Fig.6 Effect of hydrolysis time on the extraction yield of aloe polysaccharides
2.2.1 回歸模型的建立及其顯著性檢驗
復合酶法提取蘆薈多糖的響應面試驗結果及其預測值如表2所示(實測值為3 次平行實驗結果的平均值)。對表中試驗數據進行多元回歸擬合,獲得蘆薈多糖提取率對自變量復合加酶量、酶解溫度、酶解時間的二次多項回歸模擬方程如下:
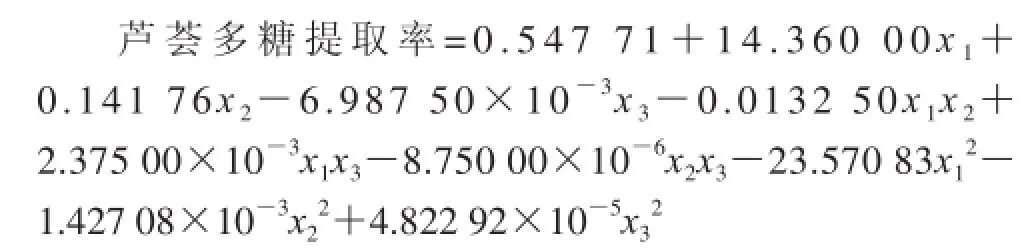
式中:x1、x2、x3分別為加酶量、酶解溫度和酶解時間的編碼值。利用該方程所得預測值與試驗值較為接近。
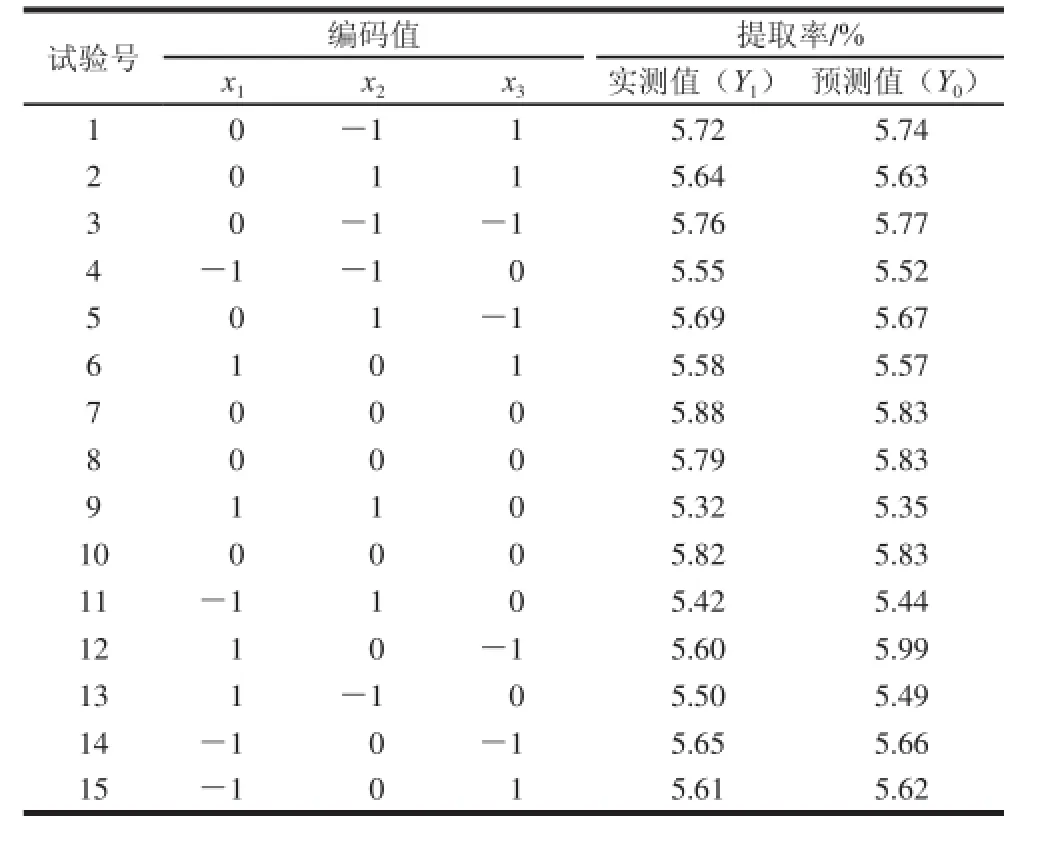
表2 響應面試驗設計及結果Table 2 Experimental design and results for response surface methodology
所得回歸模擬方程的方差分析如表3所示。酶解溫度(x2)對多糖提取率影響顯著(P≤0.05),加酶量二次項(x12)和酶解溫度二次項(x22)對多糖提取率影響極顯著(P≤0.01)。所得模型極顯著(P≤0.01),失擬項不顯著(P=0.650 3),且表1中試驗值與預測值較接近,說明該回歸模型合理,可很好解釋響應值。

表3 回歸模型方差分析Table 3 ANOVA for the response surface model
2.2.2 響應面分析及優(yōu)化
回歸方程響應面如圖7~9所示,任何兩個交互因素的響應面都存在最高點,加酶量和酶解溫度對多糖提取率的影響較大,而酶解時間對提取率的影響較小。通過軟件(Design-Expert V8.0)分析得到最佳多糖提取條件為加酶量0.29%、酶解溫度48.18 ℃、酶解時間40 min,在此條件下蘆薈多糖提取率的預測值為5.87%。為了驗
證該響應面結果的可行性,對所得最佳條件進行了優(yōu)化和驗證實驗。在加酶量、酶解溫度和酶解時間分別為0.3%、48 ℃和40 min條件下進行5 次實驗,所得蘆薈多糖提取率平均值為5.65%,相對標準偏差為0.105%,說明該條件下試驗結果穩(wěn)定;與預測值的相對誤差為3.75%,說明該響應面結果可靠。

圖7 加酶量和酶解溫度對多糖提取率影響的響應面圖Fig.7 Response surface model plot showing the effect of total enzyme amount and temperature on the extraction yield of aloe polysaccharides

圖8 加酶量和酶解時間對多糖提取率影響的響應面圖Fig.8 Response surface plot showing the effect of total enzyme amount and hydrolysis time on the extraction yield of aloe polysaccharides

圖9 酶解溫度和酶解時間對多糖提取率影響的響應面圖Fig.9 Response surface model plot showing the effect of hydrolysis temperature and time on the extraction yield of aloe polysaccharides
2.3 復合酶法與超聲波輔助法的比較
利用超聲波輔助法提取蘆薈多糖的提取率為5.42%,響應面優(yōu)化的復合酶法提取率為5.65%,復合酶法的提取率比超聲波輔助法提高了4.2%。超聲波輔助法是目前提取蘆薈多糖常用并且效率較高的方法,復合酶法不僅可以達到較高的提取率,而且和超聲波輔助法相比還具有反應條件溫和、溫度低、耗能少、對設備要求低等優(yōu)點。復合酶法具有較好的蘆薈多糖提取效果,可能是因為果膠酶和纖維素酶在短時間內快速降解了蘆薈細胞壁中的果膠和纖維素,從而破壞了其細胞壁,提高了細胞壁和細胞膜的通透性,加速了細胞內部多糖的溶出[16-22]。
2.4 蘆薈多糖的抗氧化性分析
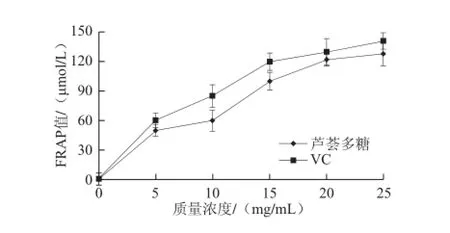
圖10 蘆薈多糖的總抗氧化能力Fig.10 Total antioxidant power of aloe polysaccharides
蘆薈多糖的總抗氧化能力測定結果如圖10所示,隨著蘆薈多糖質量濃度的增加其總抗氧化能力逐漸增強,當質量濃度為25 mg/mL時其總抗氧化能力達到約130 μmol/L。與同質量濃度的VC相比蘆薈多糖的總抗氧化能力略小,說明所提取蘆薈多糖具有一定的總抗氧化能力。

圖11 蘆薈多糖的DPPH自由基清除能力Fig.11 DPPH radical scavenging capacity of aloe polysaccharides
蘆薈多糖的DPPH自由基清除能力測定結果如圖11所示,當蘆薈多糖質量濃度在0~15 mg/mL時,隨著質量濃度的增加其DPPH自由基清除能力增加較快;在15~25 mg/mL時,其DPPH自由基清除能力增加較慢;在25 mg/mL時其清除率達到75%。和VC相比,蘆薈多糖的DPPH自由基清除率略大于同質量濃度的VC,說明所提取蘆薈多糖具有較強的DPPH自由基清除能力。
蘆薈多糖的羥自由基清除能力測定結果如圖12所示,與其DPPH自由基清除能力測定結果相似,在0~15 mg/mL時,其羥自由基清除能力增加較快,在
15~25 mg/mL時,其清除能力增加較慢;在25 mg/mL時其羥自由基清除率約為90%;其羥自由基清除率略大于同質量濃度的VC,說明所得提取蘆薈多糖具有較強的羥自由基清除能力。蘆薈多糖對羥自由基清除能力在其他文獻中也有報道[28]。
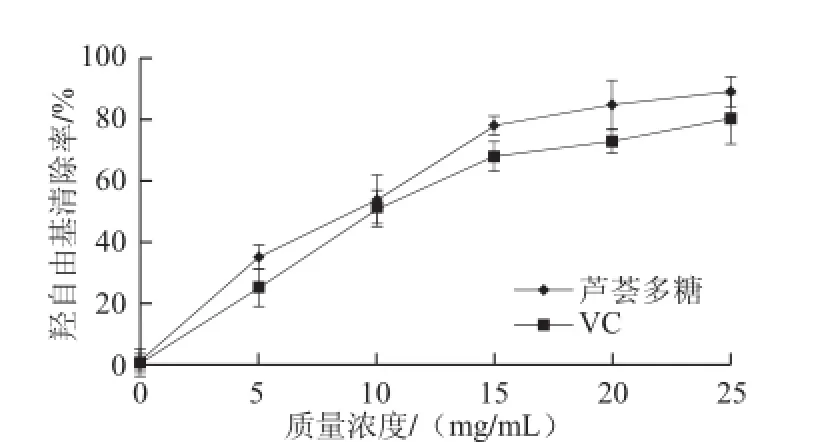
圖12 蘆薈多糖的羥自由基清除能力Fig.12 Hydroxyl radical scavenging capacity of aloe polysaccharides
由以上所述可以得到蘆薈多糖具有一定的抗氧化性,這些結果和已有報道[28-29](蘆薈多糖具有抗氧化性)一致。蘆薈多糖是由葡萄糖、半乳糖、甘露糖和阿拉伯糖等糖基由1-4糖苷鍵連接而成的一種混合多糖,其種類、組成、結構和性質具有較大差異。到底是哪一種多糖、多糖的什么結構使其具有抗氧化性目前還不清楚。在對蘆薈多糖提取的基礎上,還需對其進行分離純化、結構鑒定和進一步的功能研究,相關實驗正在進行中。
3 結 論
本研究在單因素試驗結果的基礎上,利用響應面法對復合酶提取蘆薈多糖的條件進行了優(yōu)化,并建立了合理可靠的二次多項模型。當料液比1∶30(g/mL)、果膠酶與纖維素酶配比1∶3、pH 4.5時,優(yōu)化的最佳復合酶法提取條件為加酶量0.3%、酶解溫度48 ℃、酶解時間40 min。在此條件下蘆薈多糖的提取率為5.65%,和超聲波輔助法相比,提取率提高了4.2%。對所提取蘆薈多糖的抗氧化實驗顯示,隨著質量濃度的增加,其總抗氧化能力、DPPH自由基清除能力和羥自由基清除能力逐漸增強,在25 mg/mL時其DPPH自由基清除率和羥自由基清除率分別達到75%和90%。酶法提取蘆薈多糖用時短、效率高、條件溫和且干凈環(huán)保,為蘆薈多糖的提取提供了一種新的、更有效的方法。
[1] 黨秀麗, 劉雪英, 王慶偉, 等. 蘆薈多糖的分離純化及其相對分子質量和含量測定[J]. 醫(yī)藥導報, 2012, 31(1): 67-70.
[2] 黃鳳蘭, 高鴻蒙, 李娜娜, 等. 蘆薈的研究進展[J]. 內蒙古民族大學學報: 自然科學版, 2012, 27(5): 553-556.
[3] WANG Zaojing, LUO Dianhui. Antioxidant activities of different fraction of polysaccharide purified from Gynostemma pentaphyllum Makino[J]. Carbohydrate Polymers, 2007, 68(1): 54-58.
[4] BHAT G, KUDVA P, DODWAD V. Aloe vera: natures soothing healer to periodontal disease[J]. Journal of Indian Society Periodontology, 2011, 15(3): 205-209.
[5] MIDRED A D, CHRISTOPHER R, PATEL S, et al. Aloe-emodin modulates PKC isozymes, inhibits proliferation, and induces apoptosis in U-373MG glioma cells[J]. International Immunopharmacology, 2004, 4(14): 1775-1784.
[6] JIA Yimei, ZHAO Guodong. JIA Jicheng. Preliminary evaluation the effects of Aloe Miller and Aloe arboresers Miller on word healing[J]. Journal of Ethnophar-macology, 2008, 120(2): 181-189.
[7] MARIITA R M, ORODHO I A, OKEMO P O, et al. Methanolic extracts of Aloe secundiflora Engl. inhibits in vitro growth of tuberculosis and diarrhea-causing bacteria[J]. Pharmacognosy Research, 2011, 3(2): 95-99.
[8] WU Junhua, XU Chen, SHAN C Y, et al. Antioxidant properties and PC12 cell protective erects of APS-1, a polysaccharide from Aloe vera var. chinensis[J]. Chinensis Life Sciences, 2006, 78(6): 622-630.
[9] 孔祥榮, 王宗偉. 蘆薈多糖化學結構與生物活性[J]. 國外醫(yī)藥: 植物藥分冊, 2003, 18(1): 7-12.
[10] 趙華, 趙進, 何聰芬, 等. 轉基因庫拉索蘆薈多糖的分離純化與結構表征[J]. 食品科學, 2009, 30(15): 17-20.
[11] 何思微, 何鳳林, 趙立超, 等. 庫拉索蘆薈中蘆薈多糖提取方法比較[J].食品研究與開發(fā), 2012, 33(2): 32-35.
[12] 安勝欣, 王紀紀, 唐小瓊, 等. 微波輔助提取蘆薈多糖的研究[J]. 安徽理工大學學報: 自然科學版, 2012, 32(3): 37-40.
[13] 韓秋菊, 王美珠. 木立蘆薈多糖提取工藝研究[J]. 山東農業(yè)科學, 2013, 45(5): 103-104; 107.
[14] 韓秋菊, 盧生有. 微波法提取木立蘆薈多糖的工藝研究[J]. 化學與生物工程, 2013, 30(5): 65-66; 71.
[15] 劉曉鵬, 姜寧, 向東山, 等. 庫拉索蘆薈多糖超聲輔助提取工藝的研究[J]. 食品科學, 2008, 29(10): 286-289.
[16] CHANDINIA S K, JAGANMOHAN R L, GOWTHAMAN M K, et al. Enzymatic treatment to improve the quality of black tea extracts[J]. Food Chemistry, 2011, 127(3): 1039-1045.
[17] 袁春龍, 張金. 纖維素酶和果膠酶對番茄紅素提取的影響[J]. 食品科學, 2010, 31(13): 100-104.
[18] 王璐, 胡仁和, 沈敏, 等. 纖維素酶和果膠酶共固定化研究[J]. 廣東化工, 2013, 40(13): 79-80; 65.
[19] 裴海閏, 曹學麗, 徐春明. 響應面法優(yōu)化纖維素酶提取蘋果渣多酚類物質[J]. 北京農學院學報, 2009, 24(3): 50-54.
[20] 韓立宏, 馬濤. 超聲波輔助纖維素酶-堿液提取大棗皮紅色素工藝的響應面優(yōu)化研究[J]. 食品科學, 2008, 29(7): 221-225.
[21] 高文秀, 趙文卓, 李平平. 果膠酶酶解法輔助超聲波法提取山楂中總黃酮的初步工藝優(yōu)化[J]. 吉林化工學院院報, 2013, 30(7): 29-32.
[22] DEEPA D, YOGENDER P K, RAMESH C K. Optimization of cellulose production by a brown rot fungus Fomitopsis sp. RCK2010 under solid state fermentation[J]. Bioresource Technology, 2011, 102: 6065-6072.
[23] 趙光遠, 常楊. 復合酶法生產紅棗澄清汁工藝研究[J]. 鄭州輕工業(yè)學院學報: 自然科學版, 2013, 28(3): 5-8.
[24] 余森艷, 劉海松, 張文碩. 復合酶法提取草莓汁的工藝優(yōu)化[J]. 農產品加工, 2013(7): 43-45.
[25] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma as a measure of “antioxidant power”: the FRAP assay[J]. Analytic Biochemistry, 1996, 239: 70-76.
[26] ATOUI A K, MANSOURI A, BOSKOU G, et al. Tea and herbal infusions: their antioxidant activity and phenolic profile[J]. Food Chemistry, 2005, 89(1): 27-36.
[27] 曹煒, 盧珂, 陳衛(wèi)軍, 等. 不同種類蜂蜜抗氧化活性的研究[J]. 食品科學, 2005, 26(8): 352-357.
[28] 相炎紅, 牛帥, 鄭波, 等. 蘆薈多糖的提取及其抗氧化性研究[J]. 中國食品工業(yè), 2010(12): 74-75.
[29] 吳廣楓, 湯堅. 蘆薈多糖的純化與體外抗氧化活性的研究[J]. 食品科學, 2002, 23(9): 129-132.
Optimization of Enzymatic Hydrolysis Conditions for the Extraction of Aloe Polysaccharides Using Response Surface Methodology and Assessment of Their Antioxidant Activity
LI Ya-hui1, MA Yan-hong1,*, HUANG Kai-hong1, ZHAO Yan-cun1, ZHANG Hong-zhi1, WANG Guang-ci2
(1. Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 2. Xuzhou Huarui Aloe Products Co. Ltd., Xuzhou 221700, China)
The present study focused on the extraction of aloe polysaccharides by enzymatic hydrolysis using pectinase and cellulase together, and the antioxidant activity of aloe polysaccharides was also evaluated. The extraction conditions were optimized using response surface methodology on the basis of single factor experiments, and the antioxidant activity was assessed by measuring total antioxidant capacity, DPPH and hydroxyl radical scavenging capacity. Results showed that the optimum extraction process was found to be extraction at 48 ℃ with a total enzyme dosage of 0.3% under the pre-established conditions: solid-to-liquid ratio, 1:30 (g/mL); ratio of pectinase to cellulase, 1:3; and hydrolysis pH, 4.5. The yield of aloe polysaccharides under the optimized conditions was 5.65%, an increase of 4.2% over that obtained with ultrasonic-assisted extraction. The aloe polysaccharides obtained possessed potent antioxidant activity, showing a positive concentrationeffect relationship for total antioxidant capacity, and DPPH and hydroxyl radical scavenging capacity. The concentration 25 mg/mL scavenged 75% of DPPH free radical and 90% of hydroxyl free radical. To conclude, multienzymatic hydrolysis can provide a new effective method for the extraction of aloe polysaccharides with good antioxidant activity.
multienzymatic hydrolysis; aloe polysaccharide; response surface methodology; antioxidant activity
S567.2
A
1002-6630(2014)18-0063-06
10.7506/spkx1002-6630-201418012
2014-01-06
江蘇省蘇北科技發(fā)展計劃—科技型企業(yè)技術創(chuàng)新項目(BC2012408);江蘇省農業(yè)科技自主創(chuàng)新資金項目(CX(12)1005)
李亞輝(1985—),男,助理研究員,博士,研究方向為食品發(fā)酵與生物技術。E-mail:liqianhao217@126.com
*通信作者:馬艷弘(1972—),女,副研究員,博士,研究方向為食品功能因子開發(fā)利用。E-mail:ma_yhhyy@126.com

