季銨基團可與高氯酸作用嗎?
祁玉成
(青島大學化學化工與環(huán)境學院 山東青島 266071)
季銨基團可與高氯酸作用嗎?
祁玉成
(青島大學化學化工與環(huán)境學院 山東青島 266071)
討論非水酸堿滴定的質子轉移過程。指出胺類藥物鹽酸鹽滴定原理表述中的不妥之處。
非水滴定 季銨基團 藥物分析
堿性較弱或水溶性較差的胺類藥物可用高氯酸標準溶液進行非水滴定。然而,在制備藥物時,如果胺基已接受質子成鹽,雖然仍可用高氯酸滴定,但其滴定反應與未成鹽的胺類藥物并不相同。目前出版的許多藥物分析教材在討論這兩種滴定時,通常不作明確區(qū)分,以至于出現(xiàn)了“季銨基團可與高氯酸作用”的不恰當表述[1-5]。鑒于胺類鹽酸鹽的藥品較多,非水滴定又是其常規(guī)定量手段,而眾多教材對其滴定原理闡述尚存在問題,本文將就此相關內容進行討論。
1 胺類藥物的滴定
根據(jù)質子理論,在冰醋酸介質中,醋酸合質子是能夠存在的最強酸,去質子的醋酸根是能夠存在的最強堿。非水滴定時,堿性大于醋酸根的胺類藥物(B)溶解于冰醋酸,離解出醋酸根(拉平到溶劑陰離子)。

高氯酸溶解于冰醋酸中,生成醋酸合質子(拉平到溶劑化質子)。

滴定胺類藥物的過程類似于在水溶液中用強酸滴定強堿,滴定時,實際發(fā)生的是醋酸合質子與醋酸根之間的反應,離子反應式為:

合并式(1)、式(2)、式(3),得到滴定胺類藥物的化學反應式為:

2 胺類藥物鹽酸鹽的滴定
藥物中的胺基已經(jīng)與氯化氫等成鹽,在冰醋酸中溶解時沒有醋酸根生成,僅離解出Cl-:

因胺基堿性大于Cl-,滴定開始前,胺基已經(jīng)與質子結合成質子化胺基,不能再接受質子(這是問題的關鍵,但卻常被忽視)。滴定胺類藥物鹽酸鹽的過程類似于在水溶液中用強酸滴定弱堿,標準溶液中的醋酸合質子只能與Cl-反應。滴定過程的離子反應式為:

合并式(2)、式(5)、式(6),得到滴定胺類藥物鹽酸鹽的化學反應式為:

與式(4)相比,式(7)的產物中多了HCl。由于滴定產物HCl在醋酸中呈弱酸性,有少量離解,反應進行不夠徹底,用指示劑確定終點時誤差較大。為此,可采用電位滴定法來確定終點。如果仍然選擇指示劑法確定終點,在滴定前,必須先加入醋酸汞,以使Cl-生成難離解的氯化汞,并置換出等物質的量的強堿——醋酸根。

再用高氯酸標準溶液滴定生成的醋酸根。該滴定過程與滴定未成鹽的胺類藥物相同,離子反應式同為式(3)。無論加醋酸汞與否,胺類藥物鹽酸鹽中的胺基在滴定前都已經(jīng)質子化,不會再與高氯酸作用;且在滴定時,不會直接參與質子轉移的反應。
3 教材中出現(xiàn)的問題
目前發(fā)行的多部藥物分析教材在介紹胺類藥物鹽酸鹽的滴定原理時,都將HCl視為干擾,以為消除了HCl的干擾,只保留胺類藥物,其余的過程便與前一種情況一樣了,被滴定物質是胺(B),滴定產物是質子化胺(BH+)。這樣處理會帶來3個問題:一是酸與堿(HCl與胺)混合,為什么不發(fā)生質子轉移;二是若將HCl視為干擾,便無法解釋為什么用指示劑確定滴定終點時才造成干擾,而改用電位法確定終點后又無干擾;三是容易造成概念不清。例如,在討論醋酸汞的作用時,一些教材中的表述為:
“加入定量的醋酸汞冰醋酸溶液,使其(指Cl-等)生成在醋酸中難離解的鹵化汞,以消除氫鹵酸對滴定的干擾與不良影響。”[1-2]
“有機堿的氫鹵酸鹽在用高氯酸滴定前,須加入醋酸汞溶液,以消除氫鹵酸鹽對非水溶液滴定法的干擾。”[2-3]
“在非水溶液中滴定前需加入醋酸汞,與維生素B1中的氫氯酸生成非離解的氯化汞,以消除氫氯酸的干擾。”[4]
“若藥物為鹽酸鹽,滴定前加入一定量醋酸汞試液,以消除鹽酸鹽的影響。”[5]
上述引文均將Cl-與HCl混為一談。只有將HCl視為干擾,才會出現(xiàn)這樣的問題。如果加入醋酸汞確實能把胺類藥物鹽酸鹽中的HCl除去,只留下堿性基團,那當然可以用高氯酸滴定。但事實上,加入醋酸汞,只是將Cl-置換成醋酸根,并未能除去H+。根據(jù)質子理論,HCl和Cl-分別為酸和堿,兩者是共軛關系,并不等同。尤其是在酸堿滴定中,應該將它們區(qū)分開來,否則會引起混亂。(在定量分析中,消除干擾通常是采用掩蔽或分離的方法。認為通過置換法,產生一個能繼續(xù)參與滴定反應的物質也能消除干擾,是另一個概念混淆。)
從前面(第一部分和第二部分)的討論中可以看出,在滴定前(更準確地說,是在溶解前),胺類藥物是以游離胺基的形式存在的,而此時胺類藥物鹽酸鹽中的胺基已經(jīng)質子化。滴定完成后,胺類藥物中的—NH2接受質子生成—NH,而胺類藥物鹽酸鹽中已質子化的胺基(—NH)在滴定前后都未發(fā)生變化,接受質子的物質是Cl-。因此,我們可以說“胺基具有堿性,可與高氯酸作用”,但不能說“已質子化胺基具有堿性,可與高氯酸作用”。然而,多部教材都幾乎完全相同地出現(xiàn)了類似的錯誤表述。例如,在維生素B1的含量測定中,有:
“維生素B1分子中含有兩個堿性的已成鹽的伯胺和季銨基團,在非水溶液中(在醋酸汞存在下),兩個堿性基團均可與高氯酸作用。”[2-3]
“維生素B1分子中含有兩個堿性的已成鹽的伯胺和季銨基團,可與高氯酸作用。”[4]
“維生素B1分子中含有兩個堿性的已成鹽的伯胺和季銨基團,它們在非水溶液中,醋酸汞存在下,均可與高氯酸作用。”[5]
2010年版的藥典對維生素B1的含量測定進行了修訂,改為不加醋酸汞,以電位滴定法確定終點。隨后出版的教材也作了相應的變動,但上述問題卻依然存在,如:
“維生素B1分子中含有兩個堿性的已成鹽的伯胺和季銨基團,在非水溶液中,均可與高氯酸作用。”[1]
上述引文中的表述是不對的。維生素B1的結構為:
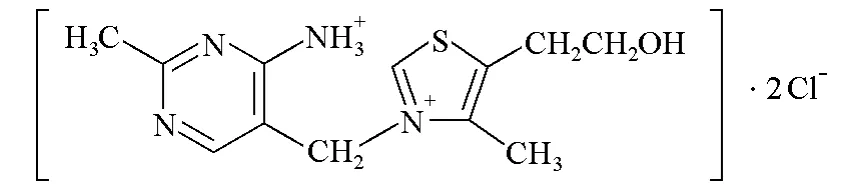
結構中已成鹽伯胺的胺基在滴定前已經(jīng)質子化,沒有孤對電子;季銨基團帶正電荷,也沒有孤對電子;兩者都不可能接受質子。換句話說,它們都沒有堿性,無法與高氯酸作用。成鹽已質子化的伯胺非但不是堿反而是弱酸,在一定條件下可給出質子。而季銨基團本無質子可以得失,因此既不是堿也不是酸。
此外,還有一個無法回避的問題。即使在伯胺鹽酸鹽的滴定中可以分解出HCl,并將其視為干擾;但在季銨鹽的滴定中,這樣的解釋是講不通的,因為季銨基團(離子)中沒有質子,也就無法拼湊出HCl,假如再將Cl-也視為干擾,那就無堿可滴定了。
總之,非水酸堿滴定是以質子理論為依據(jù)的。只有嚴格按照酸堿定義來界定酸堿,才能清晰準確地理解滴定的原理。HCl可給出質子,應視其為酸,而不應當將其作為干擾物質。HCl與胺類藥物(B)結合后,生成新的酸(質子化胺類藥物BH+)和新的堿(Cl-),即胺類藥物鹽酸鹽。胺類藥物鹽酸鹽溶解于冰醋酸后,Cl-是弱堿,可以用高氯酸滴定;而已成鹽的伯胺和季銨基團均無堿性,不可能與高氯酸作用。
[1]杭太俊.藥物分析.第7版.北京:人民衛(wèi)生出版社,2011
[2]劉文英.藥物分析.第6版.北京:人民衛(wèi)生出版社,2007
[3]周寧波,李玉杰.藥物分析.北京:化學工業(yè)出版社,2010
[4]徐溢.藥物分析.北京:化學工業(yè)出版社,2009
[5]馮芳.藥物分析.北京:化學工業(yè)出版社,2003

