硫酸亞鐵銨制備實驗的改進*
韋正友石婷婷 司友琳 孫遠東
(蚌埠醫學院 安徽蚌埠 233030)
硫酸亞鐵銨制備實驗的改進*
韋正友**石婷婷 司友琳 孫遠東
(蚌埠醫學院 安徽蚌埠 233030)
對傳統的敞開式制備硫酸亞鐵銨實驗進行改進。采用“封閉體系”制備硫酸亞鐵,可有效防止Fe2+被氧化,并可以吸收廢氣防止污染環境;利用原電池原理,加入少量碳粉或銅粉加速反應,能使反應進行得較徹底。使用乙醇可以制得品質好、收率高的硫酸亞鐵銨產品;使用過的乙醇可回收再利用。
硫酸亞鐵 硫酸亞鐵銨 乙醇 封閉體系 原電池
硫酸亞鐵銨(莫爾鹽)的化學式為(NH4)2Fe(SO4)2·6H2O,外觀為淺藍綠色單斜晶體,溶于水而不溶于乙醇。亞鐵鹽在空氣中通常易被氧化,而硫酸亞鐵銨在空氣中比一般亞鐵鹽穩定,較不易被氧化,是化學中常用的還原劑,在分析化學中還常被用作氧化還原滴定的基準物[1]。硫酸亞鐵銨的實驗室制備分兩步:一是制取硫酸亞鐵(常用金屬鐵與稀硫酸反應來制取);二是硫酸亞鐵與等物質的量的硫酸銨混合,利用復鹽的溶解度比反應物鹽的溶解度小的特性,經結晶制得硫酸亞鐵銨。有關反應方程式如下:

傳統制法為敞開式[1-2],制取硫酸亞鐵需要水浴加熱,操作過程中極易導致Fe2+被氧化成Fe3+,增加產物中雜質Fe3+含量,還需要補加酸或補充水等以控制溶液的pH[3-4],熱過濾時硫酸亞鐵晶體的析出,還會導致最終產品收率較低。此外,加熱蒸發、濃縮硫酸亞鐵與硫酸銨混合溶液以結晶出硫酸亞鐵銨時,也會增加雜質Fe3+含量,導致產品純度下降。
改進后的硫酸亞鐵制備為封閉式,能夠有效防止反應過程中Fe2+被氧化,并可以吸收廢氣防止污染環境;利用原電池原理,加入少量碳粉或銅粉可以加速反應,可以不用水浴加熱;在硫酸亞鐵與硫酸銨混合溶液液面上覆蓋適量乙醇,既隔絕空氣,又促進硫酸亞鐵銨產品析出,且不需要加熱,能有效避免溶液酸度的調節及Fe2+被氧化,所得產物的品質好,收率高。
1 實驗試劑及主要儀器
實驗試劑:鐵粉,活性炭粉,銅粉,硫酸,硫酸銨,乙醇,鄰二氮菲,鐵銨礬,鹽酸,鹽酸羥胺,均為分析純。
主要儀器:TG-328分析天平(上海天平儀器廠),721分光光度計(上海精密科學儀器有限公司),滴液漏斗,布氏漏斗,吸濾瓶,錐形瓶,吸量管,比色管。
2 實驗裝置
改進后的硫酸亞鐵制備實驗裝置如圖1所示,配有氣體吸收裝置[5],整個反應體系為封閉式,體系內部產生的氣體可以逸出反應體系外而外界空氣不能進入。錐形瓶裝有滴液漏斗,制備硫酸亞鐵時,產生的氣體排除反應體系中的空氣,并經吸收液(KMnO4/H2SO4)吸收可能產生的H2S、PH3等有害氣體[6]。
3 實驗步驟
3.1 硫酸亞鐵的制備
在錐形瓶中加入2.0g鐵粉(化學純鐵粉,或相當量的表面已除去油污的鐵屑[1])和0.5g活性炭粉(或銅粉)的混合物,由滴液漏斗滴加20mL的3mol·L-1硫酸(滴加結束時留取少許),反應產生的氣體被吸收液吸收廢氣后逸出;同時,反應不斷產生的H2排除反應體系內的空氣。待鐵粉(鐵屑)反應近完畢,產生了大量的硫酸亞鐵后,由滴液漏斗加入14mL經煮沸除氧的蒸餾水(最后留取少許,以使反應體系不進入空氣),使生成的硫酸亞鐵全部溶解。
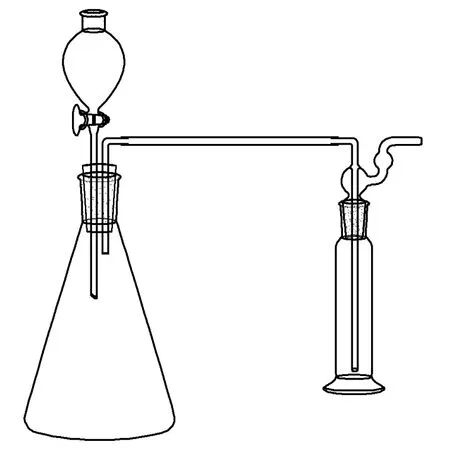
圖1 硫酸亞鐵制備實驗裝置
3.2 硫酸亞鐵銨的制備
待鐵粉(鐵屑)反應完畢,由滴液漏斗加入理論量經煮沸除氧的蒸餾水配制的硫酸銨飽和溶液。滴加完畢,待溶液混合均勻后,減壓過濾,濾渣用經煮沸除氧的蒸餾水洗滌(3×2mL)。迅速取濾液置于容器中,沿器壁緩慢加入適量乙醇,使之覆蓋在液面上。隨著乙醇在溶液中不斷擴散,硫酸亞鐵銨逐漸結晶析出。過濾,結晶用無水乙醇洗滌(3×5mL),倒在濾紙上晾干。
3.3 產品的純度測定
采用鄰二氮菲分光光度法測定產品的含鐵量[7]。將分析純鐵銨礬溶于水,鹽酸酸化后配制成100g·L-1鐵標液;類似地,配制含鐵約100mg·L-1的產品溶液;鹽酸羥胺作為還原劑,鄰二氮菲作為顯色劑,使用721型分光光度計測定508nm處吸光度,繪制工作曲線,從曲線上求得產品的原始濃度,進而求出產品的含鐵量,并與理論值(14.25%)比較,得出產品純度,即產品的含鐵量占理論值的百分率。
3.4 產品的等級分析
產品的等級分析采用目視比色法[1]。將分析純鐵銨礬配制成100mg·L-1的Fe3+標準溶液,再配制不同等級的標準色階,其Fe3+量分別為:Ⅰ級(0.05mg);Ⅱ級(0.10mg);Ⅲ級(0.20mg)。稱1g樣品放入25mL比色管中,然后與Fe3+標準溶液同體積同樣處理,并與標準色階比較,用目視比色法進行等級分析。
4 結果與討論
實驗中使用鐵粉(化學純鐵粉,或相當量的已處理鐵屑)與硫酸(稍過量)反應制備硫酸亞鐵,硫酸銨按與鐵粉等物質的量的理論量投料。在使用和不使用“封閉體系”、使用和不使用碳粉或銅粉及使用乙醇作溶劑等條件下制備硫酸亞鐵銨,進行對照實驗。
4.1 反應體系對產品質量的影響
使用傳統的敞開式制法,在兩步反應中都有空氣存在,加之溫度較高,發生Fe2+被氧化為Fe3+的反應,所得目標產品甚至比Ⅲ級差,即Fe3+量高于0.20mg;雜質含量也較高,產品甚至略帶黃色。使用改進后的封閉式制法,排除了反應體系內的空氣,第一步制得的硫酸亞鐵較純,所得最終產品優于Ⅰ級,即Fe3+量低于0.050mg,雜質少,質量好,為淺藍綠色晶體。文獻[4]采用封閉式體系制備硫酸亞鐵,再將硫酸亞鐵溶液壓入到與大氣相通的硫酸銨溶液底部,放置,結晶出硫酸亞鐵銨。本文采用裝置相對簡單的封閉式體系制備硫酸亞鐵,再利用硫酸亞鐵銨在乙醇中不溶的性質,于硫酸亞鐵和硫酸銨溶液液面上覆蓋乙醇以隔絕空氣,并高收率地結晶出硫酸亞鐵銨。
4.2 碳粉或銅粉對反應的影響
其他條件相同,不使用碳粉或銅粉時,鐵粉與稀硫酸反應很慢,耗費時間很長,很難反應徹底,后續制備硫酸亞鐵銨收率偏低;使用碳粉或銅粉時,鐵粉與稀硫酸反應較快,制備時間明顯縮短,反應能進行得比較徹底,后續制備硫酸亞鐵銨收率較高,原因是使用碳粉或銅粉構成了原電池,促使反應明顯加快,反應如下:

Fe2+在溶液pH高或溫度高時容易被空氣氧化;而加熱蒸發、濃縮硫酸亞鐵與硫酸銨混合溶液以結晶出硫酸亞鐵銨時,水分減少使溶液pH降低,導致硫酸濃度升高,氧化能力增強,也使Fe2+易被氧化。改進后的整個制備過程一般不需要加熱,第一步反應結束及第二步反應均不需要補加酸或補充水調節溶液的pH。當實驗室氣溫較低時,僅需微熱即可以加速反應;由于為“封閉體系”,產品質量幾乎不受影響。
4.3 溶劑對產品收率的影響
傳統方法以水作溶劑制備硫酸亞鐵銨,產品收率較低。文獻[3]以水作溶劑,經改進后收率能夠達到65%以上,純度可達到95%以上;文獻[4]也以水作溶劑,經改進后收率為41.2%~67.2%。雖然硫酸亞鐵銨在水中的溶解度比硫酸亞鐵和硫酸銨都要小,但將硫酸亞鐵溶液與硫酸銨溶液混合,往往形成的是飽和或過飽和溶液,難以析出晶體。本文的改進制法中,在硫酸亞鐵和硫酸銨混合溶液液面上覆蓋乙醇,不僅可以隔絕空氣,而且由于硫酸亞鐵銨在乙醇中不溶,隨著乙醇在溶液中不斷擴散,硫酸亞鐵銨晶體逐漸析出并長大,得到顆粒較大、結晶較完全的晶體,產品收率高,品質好。使用不同體積無水乙醇時的產品收率及含鐵量、純度見表1。從表1可知,產品收率達81.7%以上,純度達96.7%以上,均優于Ⅰ級。用95%乙醇也可代替無水乙醇,但使用量要適當加大。

表1 無水乙醇體積與產品的收率、含鐵量、純度、等級的關系
4.4 溶劑的回收及再利用
制備硫酸亞鐵銨晶體使用過的乙醇可以用于設計性實驗,讓學生自行設計回收乙醇的實驗方案,以強化學生的動手能力,并培養他們解決實際問題的能力;也可以將本實驗作為綜合性實驗進一步拓展,采用常壓蒸餾法回收溶劑,再利用回收的95%乙醇制備硫酸亞鐵銨晶體,物質循環利用,以體現循環經濟的思想。
5 結論
(1)在制備硫酸亞鐵的過程中,改進后的制法利用了原電池原理,加入少量碳粉或銅粉以加速反應,反應進行得較徹底,且不需在較高溫度下進行,避免了傳統方法水浴加熱時Fe2+被氧化成雜質Fe3+及熱過濾時硫酸亞鐵晶體的析出。既簡化了實驗步驟,縮短了反應時間,又充分利用了原料,提高了目標產品的質量等級和收率。
(2)改進后的反應體系為封閉式,可以使體系內部氣體逸出而外界空氣不能進入,從而有效地防止了反應過程中Fe2+被氧化,并可以吸收廢氣防止污染環境;同時整個制備過程均不需要加熱,避免了傳統方法第一步反應結束及第二步反應期間需要加酸或補充水調節溶液的pH。
(3)改進后的制法在硫酸亞鐵與硫酸銨的混合溶液液面上覆蓋乙醇,有效防止了Fe2+被氧化,所得產品顆粒較大,結晶較完全,品質好,收率高。制備硫酸亞鐵銨晶體使用過的乙醇可以用常壓蒸餾法簡單回收再利用。
[1]張利民.無機化學實驗.北京:人民衛生出版社,2003
[2]魏祖期.基礎化學實驗.北京:人民衛生出版社,2005
[3]姜述芹,馬荔,梁竹梅,等.實驗室研究與探索,2005,24(7):18
[4]汪豐云,王小龍.大學化學,2006,21(1):51
[5]關魯雄.化學基本操作與物質制備實驗.長沙:中南大學出版社,2002
[6]劉少華,田博士.廣州化工,2011,39(12):162
[7]張榮泉.分析化學實驗.北京:科學出版社,2012
國家自然科學基金項目(No.81171646,51173075);安徽省高等學校省級優秀青年人才基金項目(No.2011SQRL080)
**通訊聯系人,E-mail:weizy168@163.com

