102例肝癌患者介入治療后生存情況及影響因素
黃忠光 吳榮興 蔣紹香 李秋云 李永寶 楊曉輝
原發性肝癌的惡性程度較高,是所有惡性腫瘤中死亡威脅最大的之一,而我國每年死于肝癌的患者占全世界總數的45%以上[1]。未經治療干預的肝癌患者的平均生存期限僅為3~6個月,其治療首推外科腫瘤切除術,但大多數患者來院就診時已失去了手術的機會[2]。近年來隨著介入技術的高速發展,許多以往被認為失去手術機會的患者因為介入治療的產生而獲取了較好的生存質量,但介入治療并不能將腫瘤細胞完全消滅,有關介入術后肝癌患者的生存情況受到了廣大學者的關注[3-4]。本次研究選取了我院于2007年4月-2008年4月收治的1~2例接受介入治療的肝癌患者,于患者出院后進行為期5年的隨訪,探討分析了肝癌患者介入治療后長期生存的情況及其預后的相關因素,報告如下。
1 資料與方法
1.1 一般資料
選取我院2007年4月-2008年4月收治的102例接受介入治療的肝癌患者,所有患者均經影像學、病理學檢查及血清甲胎蛋白(AFP)檢測確診為原發性肝癌。男性73例,女性29例,年齡25~82歲,平均年齡(54.2±5.8)歲。治療前HBsAg陽性患者82例,陰性20例;血清AFP:<200 ng/L 52例,200~400 ng/L 46例,>400 ng/L 4例;血清白蛋白:<30 g/L 5例,30~35 g/L 11例,>35 g/L 86例;血清ALT:<40 U/L 40例,≥40 U/L 62例。Child-Paugh肝功能分級:A級82例,B級14例,C級6例;33例患者合并門脈癌栓,69例患者不合并門脈癌栓;大體分型:塊狀型64例,結節型20例,彌漫型18例。所有患者均自愿簽署書面知情同意書,并經我院倫理委員會批準。
1.2 方法
15例患者行肝動脈化療栓塞( TACE)+手術切除,13例患者行TACE+經皮注射無水乙醇(PEI),68例患者行單純TACE治療,6例患者行經肝動脈化療灌注治療(TAI)。化療藥物包括順鉑、絲裂霉素、羥基喜樹堿、氟尿嘧啶、表阿霉素等,一般采用3種藥物聯合的方案,1月/次,連續3個月,并于治療后3~6個月內進行補充化療栓塞。隨訪5年,隨訪率100%。
1.3 統計學方法
采用SPSS 16.0軟件進行統計分析,兩組數據間計量資料使用t檢驗,計數資料采用卡方檢驗,采用壽命表法計算患者的生存期,組間生存率的差異采用Log-rank、Wilcoxon進行檢驗,對Log-rank單因素分析有意義的變量采用Cox多因素回歸分析進行檢驗。
2 結果
2.1 生存情況
本組肝癌患者的中位生存時間為20個月,平均生存(24.05±3.65)個月,1年生存率為63.73%,2年生存率為42.86%,3年生存率為25.49%,5年生存率為7.84%。
2.2 不同臨床病理因素與肝癌患者預后的關系(表1)
2.3 Cox回歸分析結果
單因素分析結果顯示,可能影響肝癌患者介入治療后長期生存的因素有:患者年齡、HBsAg陽性、血清AFP、ALT、白蛋白水平、Child分級、治療方式、門脈癌栓和大體分型。Cox多因素回歸分析結果顯示:年齡、Child分級、治療方式、門脈癌栓、腫瘤大體分型與患者的長期預后密切相關,見表2。
3 討論
肝癌的治療手段主要為外科手術治療與非外科手術治療2種[5]。但有研究數據表明外科手術對于肝癌病灶的首次切除率不足30.00%,在首次接受肝癌切除術的患者中,術后兩年內的復發率亦高達80.00%[6-7]。而介入治療被公認為是肝癌除外科手術外最佳的治療方法,主要包括TACE術與TAI術。
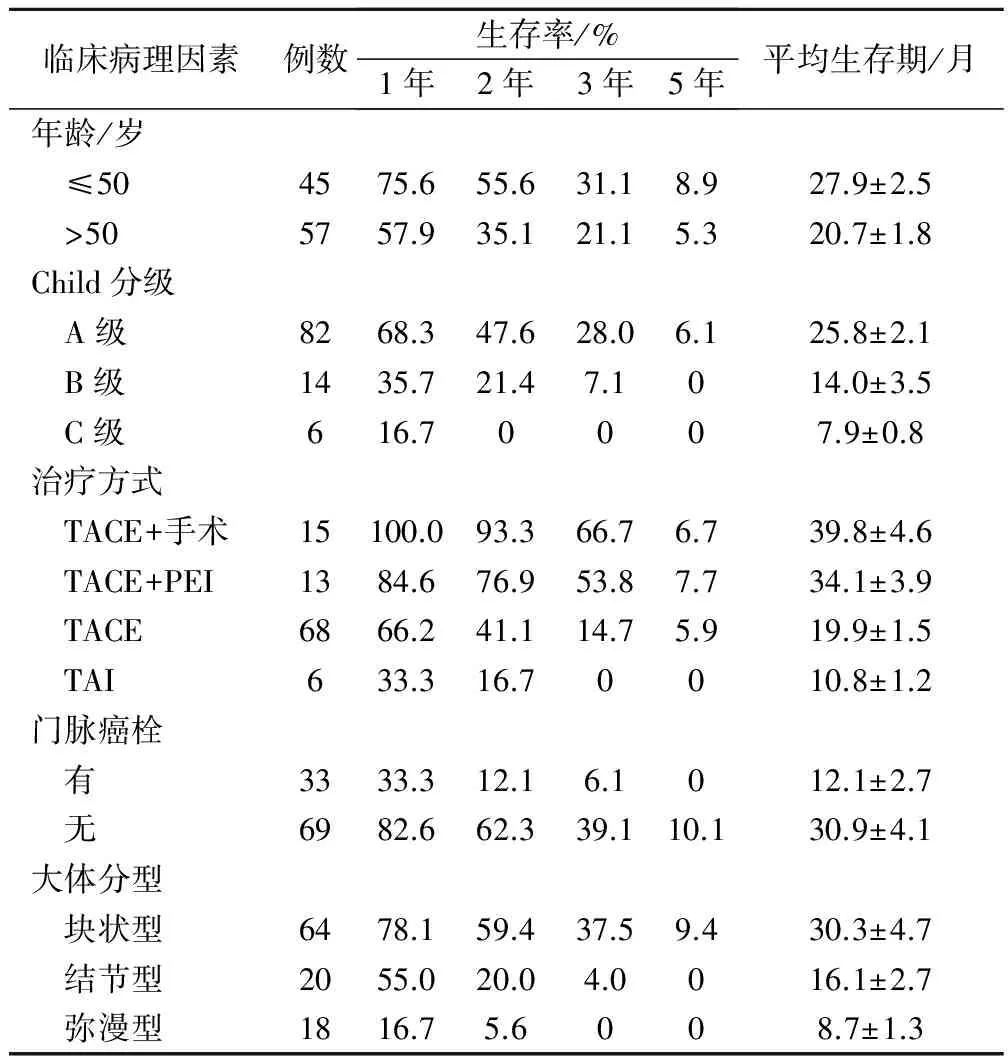
表1 不同臨床病理因素與肝癌患者預后的關系
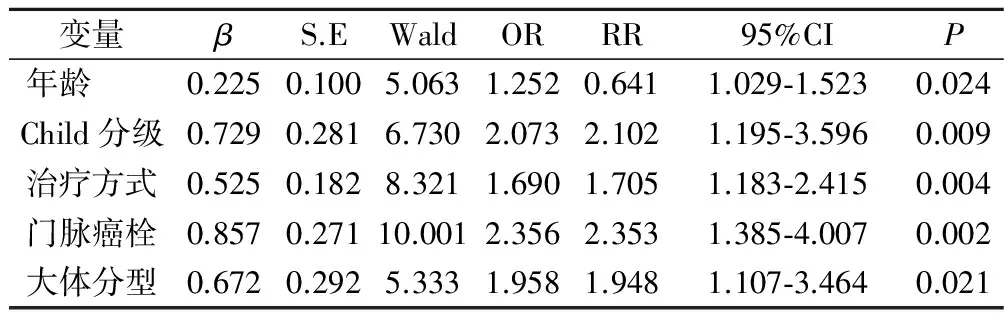
表2 Cox多因素回歸分析結果
在肝癌患者中,有極大一部分的乙肝病毒感染者,本次研究中HBsAg陽性的患者例數高達82例。除對肝細胞造成損傷外,乙肝病毒還能夠將正常的肝細胞與病毒的DNA整合起來。另一方面,HBsAg陽性會促進AFP基因的表達與腫瘤的生長,故合并乙型肝炎的患者病情常較一般患者更重。但本次研究中,我們發現HBsAg陽性,血清AFP、ALT、白蛋白水平不會影響接收介入治療的肝癌患者的長期預后。本次研究中,我們的結果顯示所有肝癌患者的中位生存時間為20個月,平均生存(24.05±3.65)個月,1年生存率63.73%,2年生存率42.86%,3年生存率25.49%,5年生存率7.84%。患者的生存曲線顯示在治療后的前3年內,曲線的下降幅度較為陡峭,提示在這段時間內,患者的死亡率較高,這與大部分文獻所報道的數據相吻合[8]。相比較于更為早期的數據,隨著介入技術的不斷提高,尤其是將碘油替代明膠海綿后,介入治療的效果得到了明顯的改善[9]。Cox多因素回歸分析結果顯示高齡、Child分級低、合并門脈癌栓、腫瘤病灶病理分型的惡性程度高的患者預后較差,而治療方式較為徹底的患者預后較好。高齡患者由于機體臟器的老化而導致代償功能發生下降,且患者的免疫力也較中青年人差。而Child分級能夠客觀地反應患者的肝細胞功能,這與介入治療的效果及患者的預后直接相關。肝細胞功能越差,其后期的存活與代償能力均會受到極大的影響。我們的結果顯示介入聯合手術治療的患者預后最佳,這部分患者在接受一段時間的介入治療后,病灶發生了不同程度的縮小,并被纖維組織所包裹,與周邊正常肝組織的界限變得清晰[10]。故手術中能夠實施段或葉的切除術,且術中的出血量也維持在較低的范圍內。合并有門脈癌栓的患者預后更差,這主要與癌栓易造成腫瘤的肝內擴散與肝外轉移密切相關,且較大的癌栓會造成門脈高壓,對肝細胞造成進一步的損傷。彌漫型肝癌患者的肝臟被微小癌結節所覆蓋,該種病理類型的肝癌惡性程度極高。由于其血供由動脈的末梢分支所提供,故范圍廣,呈彌散性分布。而介入治療僅能起到局部化療的作用,且碘化油油粒在豐富血供的不斷沖刷下會不斷變小,直至被沖出腫瘤病灶,故此類患者病情發展迅速,預后較差。
綜上所述,肝癌患者介入治療后的長期生存的總體情況較好,高齡、Child分級低、合并門脈癌栓、腫瘤病灶病理分型的惡性程度高的患者預后較差,而治療方式較為徹底的患者預后較好。
[1] 華永飛,陸才德,裘 豐,等.術后肝動脈栓塞化療對肝癌合并門脈癌栓患者手術療效的影響及預后因素分析〔J〕.中華肝膽外科雜志,2012,18(5):357.
[2] 范文哲,楊建勇,呂明德,等.TACE聯合經皮熱消融治療大肝癌的療效及預后分析〔J〕.中華醫學雜志,2011,91(31):2190.
[3] 孟慶雯,李 勇,胡寶山,等.血清VEGFR-2濃度預測行肝動脈化療栓塞肝癌患者的預后〔J〕.中華醫學雜志,2013,93(5):341.
[4] 商春雨,蘇洪英,劉 靜,等.原發性肝癌肝動脈化療栓塞術(TACE)預后多因素分析〔J〕.現代腫瘤醫學,2011,19(12):2466.
[5] 金 鑫,史憲杰,王茂強,等.大肝癌58例患者經肝動脈插管化療栓塞降期治療體會〔J〕.中華醫學雜志,2011,91(14):950.
[6] 葉 濤,王耀輝,夏景林,等.肝動脈化療栓塞治療結直腸癌肝轉移的療效和預后影響因素〔J〕.中華腫瘤雜志,2012,34(9):706.
[7] 王天浩,任正剛,葉青海,等.術前輔助性肝動脈化療栓塞對可切除巨塊型肝癌術后生存的影響〔J〕.中華腫瘤防治雜志,2010,17(15):1210.
[8] 吳曉安,陳建清,鐘小紅,等.終末期肝癌患者的治療分析〔J〕.實用癌癥雜志,2010,25(6):627.
[9] Lau WY,Sangro B,Chen PJ,et al.Treatment for hepatocellular carcinoma with portal vein tumor thrombosis:the emerging role for radioembolization using yttrium-90〔J〕.Oncology,2013,84(5):311.
[10] Matsuda M,Omata F,Fuwa S,et al.prognosis of Patients with hepatocellular carcinoma treated solely with transcatheter arterial chemoembolization:risk factors for one-year recurrence and two-year mortality(preliminary data)〔J〕.Intern Med,2013,52(8):847.

