環(huán)介導等溫擴增技術快速檢測痰標本中結核分枝桿菌的初步評價
于 霞,梁 倩,馬異峰,付育紅,黃海榮
(北京市結核病胸部腫瘤研究所,首都醫(yī)科大學附屬北京胸科醫(yī)院,北京101149)
結核病是由結核分枝桿菌感染引起的流行最廣的傳染性疾病。全球每年新發(fā)結核患者800-1000萬,有180萬人死于結核病[1]。涂片和培養(yǎng)是結核病診斷最為直接和可靠的診斷依據(jù),但其自身的不足已嚴重影響實驗室技術對結核病防治的價值。傳統(tǒng)診斷技術的不足主要有:(1)診斷技術敏感性低,涂片鏡檢對菌陽標本的檢出率只有40%-50%。(2)分枝桿菌培養(yǎng)雖然較涂片鏡檢的檢出率高,能達到85%,但耗時長,通常需要6-8周。
由于分子生物學診斷技術逐步被開發(fā),其敏感性和特異性以及實用性已經得到認可。環(huán)介導等溫擴增(LAMP)技術就是其中之一,該技術通過特異的引物與結核分枝桿菌染色體DNA的DNA gyrase subunit B (gryB)以 及insertion sequence(IS6110)區(qū)域結合,采用2對引物識別6個區(qū)域,在恒溫條件下進行擴增[2]。該技術的優(yōu)點為特異性高,擴增反應效率高,時間短產物量大,不需昂貴的儀器,操作簡易性好。
1 材料與方法
1.1 標本收集 收集本院2012年6-8月的疑似肺結核患者的痰標本246份。年齡范圍18到88歲,平均年齡49歲,男179份,女67份。經臨床診斷確診的結核病患者標本213例,其他肺部疾病標本33例。
1.2 分枝桿菌培養(yǎng)和涂片 對收集的痰標本進行熒光法涂片鏡檢,痰標本的收集和涂片鏡檢按照《痰涂片鏡檢質量保證手冊》進行操作。中性羅氏培養(yǎng)基的制作見參考文獻[3],取1ml痰標本,加入1-1.5倍體積4%用N-乙酰-L-半胱氨酸-氫氧化鈉溶液進行消化,旋緊蓋子,在渦旋振蕩器上渦旋震蕩10-20 s,直至痰標本充分液化。將離心管室溫靜置15 min,加入PBS中和至體積為40ml,3 000g離心15 min。取100μl處理后的樣品分別接種至中性羅氏培養(yǎng)基斜面上。每份標本平行接種至兩管中性羅氏培養(yǎng)基。37℃溫箱培養(yǎng),每周觀察記錄結果。
1.3 菌種鑒定 采用杭州創(chuàng)新生物檢控技術有限公司生產的結核分枝桿菌快速診斷試劑盒(膠體金)對羅氏培養(yǎng)陽性的痰標本進行菌種鑒定。試劑盒原理為結核分枝桿菌生長時產生分泌型蛋白MPB64,而非結核分枝桿菌(Non-tuberculosis mycobacteria,NTM)不會產生MPB64。質控和測試條帶均為紅色時,樣本中含結核分枝桿菌;只有質控條帶為紅色時,樣本中含有NTM。
1.4 實時熒光核酸擴增(RT-PCR) 采用達安基因股份有限公司生產的結核分枝桿菌DNA提取試劑盒進行核酸提取,然后按照標準曲線試劑盒進行操作,使用實時熒光核酸擴增儀(ABI7500)進行擴增,按試劑盒說明進行檢測。
1.5 環(huán)介導的等溫擴增技術(LAMP)
1.5.1 DNA提取 采用核酸快速提取試劑盒(榮研生物科技(中國)有限公司),該試劑盒通過對樣本中所含的細菌進行破碎處理,使其所含的核酸游離到溶液中,并將得到的溶液與吸附劑試劑管中的多孔介質混合,把樣本中所含的阻礙核酸擴增反應的物質去除,在通過滴注蓋薄膜濾器,使核酸溶液被提取出來。
1.5.2 LAMP擴增 將30μl的核酸溶液加到反應試管中;將恒溫器在67℃加熱40min;40min后再用加熱器進行酶的滅活,80℃,5min。結果判定:使用紫外照射燈管從反應試管的地面進行紫外照射。在確認陽性對照發(fā)出綠色熒光,陰性對照溶液沒有發(fā)出熒光后,對待測樣本結果進行判讀。陽性:發(fā)出綠色熒光。陰性:未發(fā)出綠色熒光。
1.6 臨床診斷 依據(jù)中華醫(yī)學會結核病學分會《肺結核診斷和治療指南》[4]。
1.7 統(tǒng)計分析 采用SPSS 13.0軟件進行數(shù)據(jù)分析,LAMP與RT-PCR法檢測結果比較用配對χ2檢驗;LAMP與RT-PCR法檢測結果一致性分析采用Kappa指數(shù)法,Kappa系數(shù)值越大,說明吻合程度越高。Kappa指數(shù)在0.4-0.7,提示吻合程度一般,大于0.7,說明吻合性強。
2 結果
2.1 4種方法的檢出率
痰涂片,痰羅氏培養(yǎng),LAMP擴增以及RTPCR四種方法對分枝桿菌的檢出率依次為30.89%(76/246),45.53%(112/246),54.47%(134/246),57.32%(141/246)。RT-PCR 的檢出率最高,其次為LAMP。LAMP與RT-PCR在結核分枝桿菌檢出率上的差異無統(tǒng)計學意義(配對χ2檢驗結果,P=0.189,P>0.05)。LAMP法與涂片法在結核分枝桿菌檢出率上的差異有統(tǒng)計學意義(配對χ2檢驗結果,P<0.001)。LAMP法與培養(yǎng)法在結核分枝桿菌檢出率上的差異有統(tǒng)計學意義(配對χ2檢驗結果,P<0.001)。
2.2 菌種鑒定結果 對于羅氏培養(yǎng)陽性的112株分枝桿菌進行膠體金試劑盒鑒定,其中7株(7/112,6.25%)株為NTM,其余105株為結核分枝桿菌。
2.3 LAMP法與羅氏培養(yǎng)法檢測結果的比較 對于膠體金鑒定為NTM的7株菌株,在進行LAMP法與羅氏培養(yǎng)的比較時排除這7株菌株。以羅氏培養(yǎng)結果作為金標準,LAMP法診斷的敏感性為96.19%(101/105),特異性為76.87%(103/134),兩法檢測結果的一致性是κ=0.711,說明LAMP法在檢測結核分枝桿菌方面與羅氏培養(yǎng)法有較好的吻合性。兩法檢測結果的比較見表1。

表1 LAMP法與羅氏培養(yǎng)法檢測結果的比較
2.4 LAMP法與涂片法、RT-PCR法以及臨床診斷結果的比較
以RT-PCR作為診斷標準,LAMP法的敏感性為90.07% (127/141),特異性為93.33% (98/105),兩法檢測結果的一致性是κ=0.83,說明LAMP法在檢測結核分枝桿菌方面,與RT-PCR法有很好的吻合性。以涂片結果作為金標準,LAMP的敏感性為96.05%(73/76),特異性為64.12%(109/170)。以臨床診斷作為金標準,LAMP的敏感性為62.74%(133/212),特異性為97.06%(33/34)。LAMP法與其他3種方法比較,見表2。來自不同臨床診斷類型的痰標本,四種不同檢測方法的檢出率如表3所示。
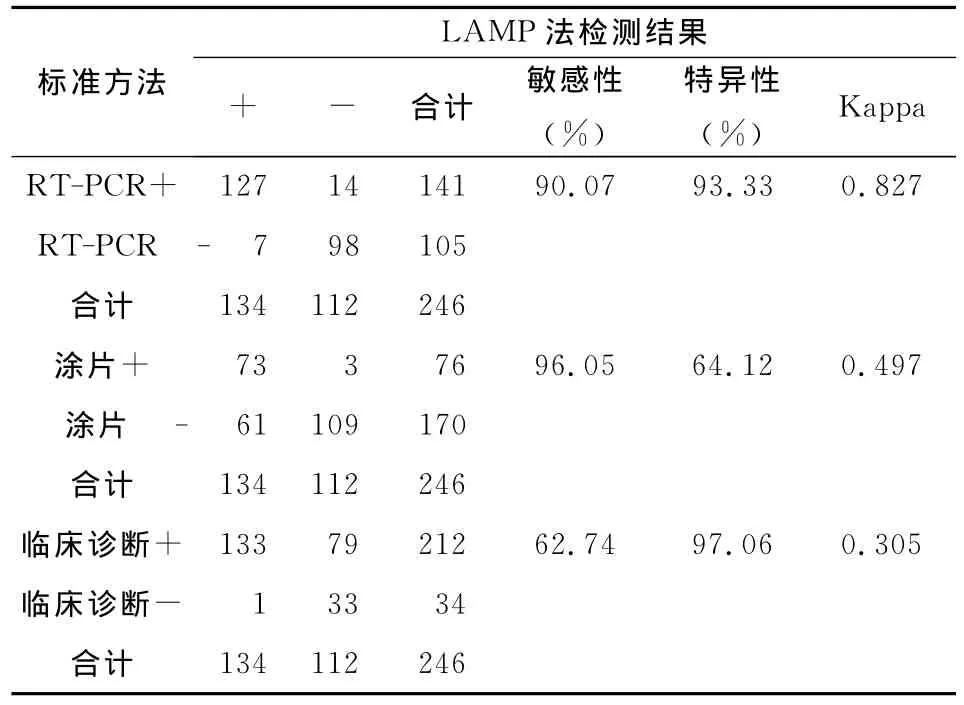
表2 LAMP法與涂片、RT-PCR和臨床診斷結果的比較
其他非結核性疾病包括肺癌5例,胸腔積液3例,肺炎4例,支氣管擴張合并感染1例,多漿膜腔積液1例。

表3 四種不同檢測方法對于來自不同臨床診斷類型標本的檢出率
3 討論
根據(jù)全國結核病耐藥性基線調查報告,NTM在培養(yǎng)陽性菌株中所占的比例為3.4%[5]。在本研究中,NTM在培養(yǎng)陽性菌株中的比例約6.25%(7/112)%。LAMP技術的引物設計在結核分枝桿菌染色體DNA的gryB以及IS區(qū)域內,從理論上講,只能對結核分枝桿菌進行診斷而無法識別NTM菌株。因此計算LAMP與培養(yǎng)的一致性時,應該先排除NTM菌株的影響。在7株經膠體金鑒定為NTM的菌株中有2株的LAMP法和RT-PCR均為陽性且臨床診斷均為結核病,提示這兩份標本可能存在混合感染,即一份痰標本中同時含有結核和NTM。因此,當LAMP結果為陽性且膠體金為陰性時,提示檢測樣本可能存在混合感染。
一系列的研究表明,LAMP法與培養(yǎng)法有著較好的吻合率。劉毅[6]等研究表明以培養(yǎng)法為金標準,選取121份痰標本,LAMP法的敏感性和特異性分別為92.16%和87.14%。易海華[7]等研究選取65份痰標本,以培養(yǎng)法為金標準,LAMP法的敏感性和特異性分別為96.4%和94.59%。包維華[8]等研究,選取118份痰標本,以培養(yǎng)法為金標準,LAMP法的敏感性和特異性分別92%和86.8%。戴廣明等[9]研究表明選取了79株臨床和標準菌株,與培養(yǎng)相比,LAMP法實驗的靈敏度和特異性分別為100%和92%。Geojith George等研究表明在涂片和培養(yǎng)結果一致的標本中,LAMP方法很有效[10]。同時,LAMP技術對于腦脊液標本也有很高的檢出率[11],與臨床診斷的敏感性和特異性分別為52.9% 和90%。本實驗以羅氏培養(yǎng)結果作為金標準,LAMP法診斷的敏感性為96.19%(101/105),LAMP的特異性為76.87%(103/134),兩種方法檢測結果的一致性是κ=0.71。
痰標本的細菌載量在5000-10000條/ml,涂片鏡檢才會報告陽性。而痰培養(yǎng)得細菌載量在100條/ml以上,培養(yǎng)會報告陽性[12]。本實驗所用的LAMP的最低檢出限為0.38基因組/測試。因此,涂片培養(yǎng)陰性并不代表痰標本中沒有結核分枝桿菌,有可能是由于細菌的數(shù)量低于檢測限造成的。在結核分枝桿菌檢出率上,LAMP法(134/246,54.47%)要高于涂片法(76/246,30.89%)和羅氏培養(yǎng)法(112/246,45.53%),且差異有統(tǒng)計學意義。
LAMP法與RT-PCR在檢出率上的差別沒有統(tǒng)計學意義(P=0.189),兩法檢測結果的一致性是κ=0.83。RT-PCR已經作為一種輔助檢查項目在國內的醫(yī)院廣泛開展,其結果也可以作為菌陰肺結核的診斷指標之一[4],檢測時間約為3個小時,但需要價格較為昂貴的設備,通過對擴增反應曲線圖譜來判讀結果,對操作人員的技術要求較高。LAMP試劑盒可以在2小時內報告結果,且僅需顏色的變化來判讀結果,操作更為簡單。因此,LAMP法適合作為臨床檢測項目開展。
[1]衛(wèi)生部疾病預防控制局.衛(wèi)生部醫(yī)政司 .中國疾病預防控制中心.中國結核病放置規(guī)劃實施工作指南.北京:中國協(xié)和醫(yī)科大學出版社.2006,1-9.
[2]Iwamoto T,Sonobe T,Hayashi K.Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex,M.avium,and M.intracellulare in sputum samples[J].J Clin Microbiol,2003,41(6):2616.
[3]World Health Organization.Laboratory Services in Tuberculosis Control Part III:Culture.Geneva:World Health Organization,1998.
[4]中華醫(yī)學會結核病學分會.肺結核診斷和治療指南[J].中華結核和呼吸雜志,2001,24(2):70.
[5]中華人民共和國衛(wèi)生部.全國結核病耐藥性基線調查報告(2007-2008年).北京:人民衛(wèi)生出版社:23-25.
[6]劉 毅,黃曙海,譚慧媚,等.環(huán)介導等溫擴增技術檢測肺結核患者痰標本中結核分枝桿菌[J].臨床檢驗雜志,2012:30(1):24.
[7]易海華,丁永健,錢志娟,等.環(huán)介導等溫擴增技術檢測痰標本中結核分枝桿菌的研究[J].中國國境衛(wèi)生檢疫雜志,2008:31(1):7.
[8]包維華,劉 毅,黃曙海,等.LAMP與RT-PCR法檢測痰結核分枝桿菌的效果比較[J].廣西醫(yī)學,2012,34(2):160.
[9]戴廣明,曹以誠,杜正平,等.結核分枝桿菌環(huán)介導恒溫擴增(LAMP)快速檢測方法的評價[J].中國防癆雜志,2011,33(1):47.
[10]George G,Mony P,kenneth J.Comparison of the efficacies of loop-mediated isothermal amplification,fluorescence smear microscopy and culture for the diagnosis of tuberculosis[J].PLoS One,2011,6(6):e21007.
[11]NagdevΚJ,Κashyap RS,Parida MMet al.Loop-mediated isothermal amplification for rapid and reliable diagnosis of tuberculous meningitis[J].J Clin Microbiol,2011,49(5):1861.
[12]馬 玙,朱莉貞,潘毓萱.結核病[M].北京:人民衛(wèi)生出版社,2006:99-117.

