大鼠骨髓間充質干細胞在淋巴細胞增殖中的免疫調節作用*
天津醫科大學第一中心臨床學院衛生部危重病急救醫學重點實驗室(天津300192) 郭瑞雪 沈中陽 宋紅麗 杜杰靜 張 靜 鄭衛萍 王玉亮
肝移植是治療終末期肝病的主要手段之一,但是移植后排斥反應嚴重影響了療效和預后。這種排斥反應主要與T細胞介導的免疫應答相關。MSCs低表達主要組織相容性復合體-Ⅰ(MHC-Ⅰ)類分子,不表達MHC-Ⅱ類分子和 B7-1(CD80)、B7-2(CD86)、CD40或CD40L等共刺激分子,這些特性使得其具有低免疫原性,能夠導致T細胞無能,從而抑制免疫排斥或誘導免疫耐受,降低移植排斥發生率[1]。本實驗旨在建立體外共培養體系研究BM MSCs對淋巴細胞增殖的抑制機制,現分析報告如下。
材料與方法
1 材料與試劑
1.1 實驗動物:Wista大鼠,雄性,體重100~120g,SPF級,4~5周齡,購于中國人民解放軍軍事醫學科學院實驗動物中心。
1.2 主要試劑:DMEM/F12培養基(Hyclone公司,美國),Percoll淋巴細胞分離液(Amersham Bioscience公司,美國),胎牛血清(PAA公司,奧地利),胰蛋白酶(Sigma公司,美國),ELISA盒(R&D System,美國),正常大鼠BRL細胞(中科院上海細胞生化所),抗大鼠的 CD45-PE、CD90-FITC、CD34-FITC、CD29-PE、RT1A-PE、RT1B-FITC、IgG-FITC和IgG-PE(Biolegend公司,美國),抗大鼠的 CD4-FITC、CD25-PE、Foxp3-PE-Cy5(eBioscience公司,美國)。
2 實驗方法
2.1 大鼠MSCs的分離和培養:全骨髓培養法分離培養MSCs。具體方法:用5%的水合氯醛腹腔麻醉大鼠致死,75%乙醇浸泡3min,無菌條件下取其脛骨股骨。剪去其兩端骨骺,于10cm2培養皿內使用含15%FBS的DMEM高糖培養基沖洗骨髓腔,制成單細胞懸液。置于含15%FBS、100U/ml青霉素和100U/ml鏈霉素的DMEM高糖培養基中。37℃,5%CO2、飽和濕度條件下培養48h后換液。此后每2~3d換液1次,細胞生長至80%左右融合時,用0.25%胰蛋白酶消化傳代,取第3代MSCs細胞,調整細胞濃度為2×105/ml備用。
2.2 流式檢測大鼠MSCs的表型鑒定:收集生長良好的第3代 MSCs,消化、計數,使細胞濃度為1×106/L,分別加入1.25μl的抗體 CD45、CD29、RT1A,0.5μl的抗體CD90、RT1B,20μl的抗體CD34,同時用IgG作為陰性對照,共孵育30min后,用PBS洗滌,經流式細胞儀檢測。
2.3 大鼠脾臟淋巴細胞的制備:用5%水合氯醛腹腔麻醉大鼠致死,無菌條件下取出脾臟,用200目尼龍網研磨后,應用淋巴細胞分離液獲得淋巴細胞,DMEM低糖培養基洗滌2次。調整細胞濃度為1×106/ml備用。
2.4 BRL的制備:將BRL細胞加入10%FBS的DMEM高糖培養基接種于培養瓶,37℃,5%CO2培養,最后調整細胞濃度2×105/ml備用。
2.5 MSCs細胞與淋巴細胞共培養:將淋巴細胞、MSCs、BRL和ConA分別分組接種于6孔培養板,每組3個副孔,每孔總量4ml。
2.6 實驗分組:①淋巴細胞組;②淋巴細胞+ConA組;③淋巴細胞+ConA+MSCs組;④淋巴細胞+ConA+MSCs+BRL組。37℃、5%CO2及飽和濕度條件下培養0h、24h和48h。
2.7 ELISA定量檢測各組培養上清中TNF-α、TGF-β1、IL-10的含量:待各組共培養0h、24h和48h后收集上清,方法按試劑說明書進行。
2.8 MTT法淋巴細胞混合反應:將MSCs,淋巴細胞,BRL和ConA接種于96孔板,共培養0h、24h和48h后MTT法檢測淋巴細胞相對細胞數。
2.9 流式檢測Treg含量:取共培養上清液以2500rpm離心5min,棄去上清留下細胞沉淀,按照說明書進行流式檢測準備工作。
3 統計學處理 本研究對所有數據采用SSPS17.0統計學軟件進行分析處理,計量資料以均數±標準差(±s)表示,組間比較采用獨立樣本t檢驗,以P<0.05為有顯著性差異,P<0.01為有極顯著性差異。
結 果
1 骨髓MSCs的形態學觀察及表型鑒定
1.1 形態學觀察:見圖1。剛接種下的骨髓MSCs呈大小較均一的圓形,胞膜清晰,胞體透亮。6h后開始貼壁,48h已牢固貼壁,生長速度較慢,4~5d后可有偽足伸展,以后成為長梭形細胞,出現明顯集落,在10d左右可以呈現80%融合。消化傳代后細胞平均4~5d再次傳代,細胞形態較為均一。
1.2 表型鑒定:見圖2。CD90、CD29和RT1A陽性,CD45、CD34和RT1B陰性,說明我們所提取培養的細胞正是骨髓MSCs。
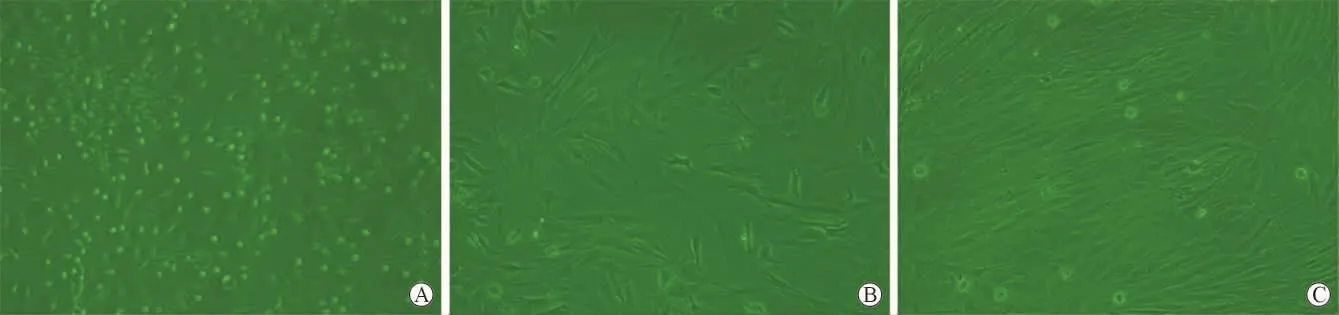
圖1 MSCs的體外培養(倒置相差×100)
2 ELISA法檢測各組培養上清中3種細胞因子分泌量 見表1。24h和48h的3、4組TGF-β1和IL-10較1、2組表現高分泌(P<0.05),TNF-α表現低分泌(P<0.05),0h基本沒有變化,TGF-β1分泌隨時間延長增高,但IL-10變化不明顯(P>0.05)。
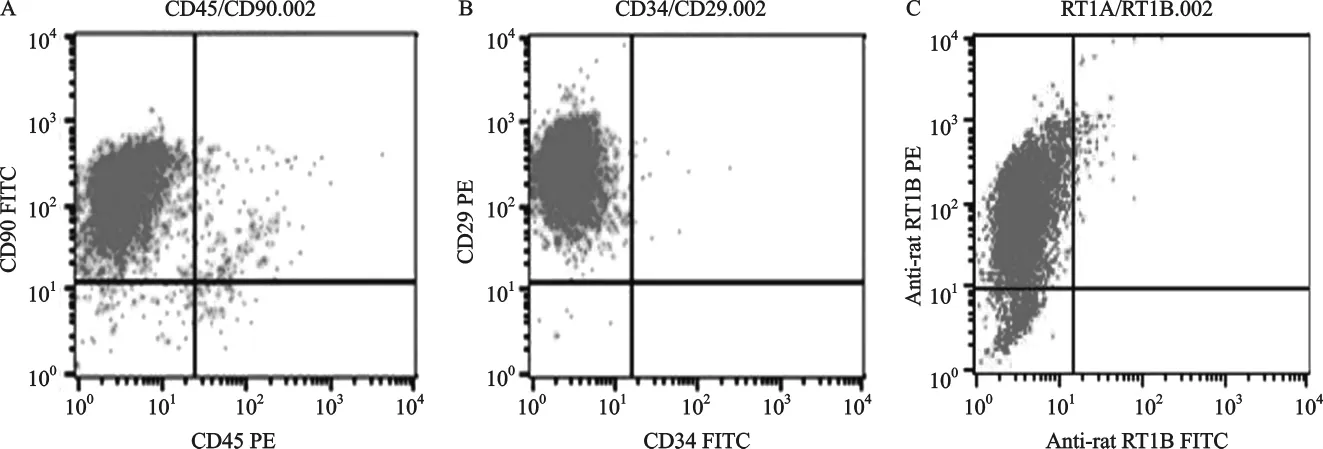
圖2 MSCs流式表型鑒定
表1 各組24h和48h的 TNF-α、TGF-β1 和IL-10分泌量(±s,ng/L)
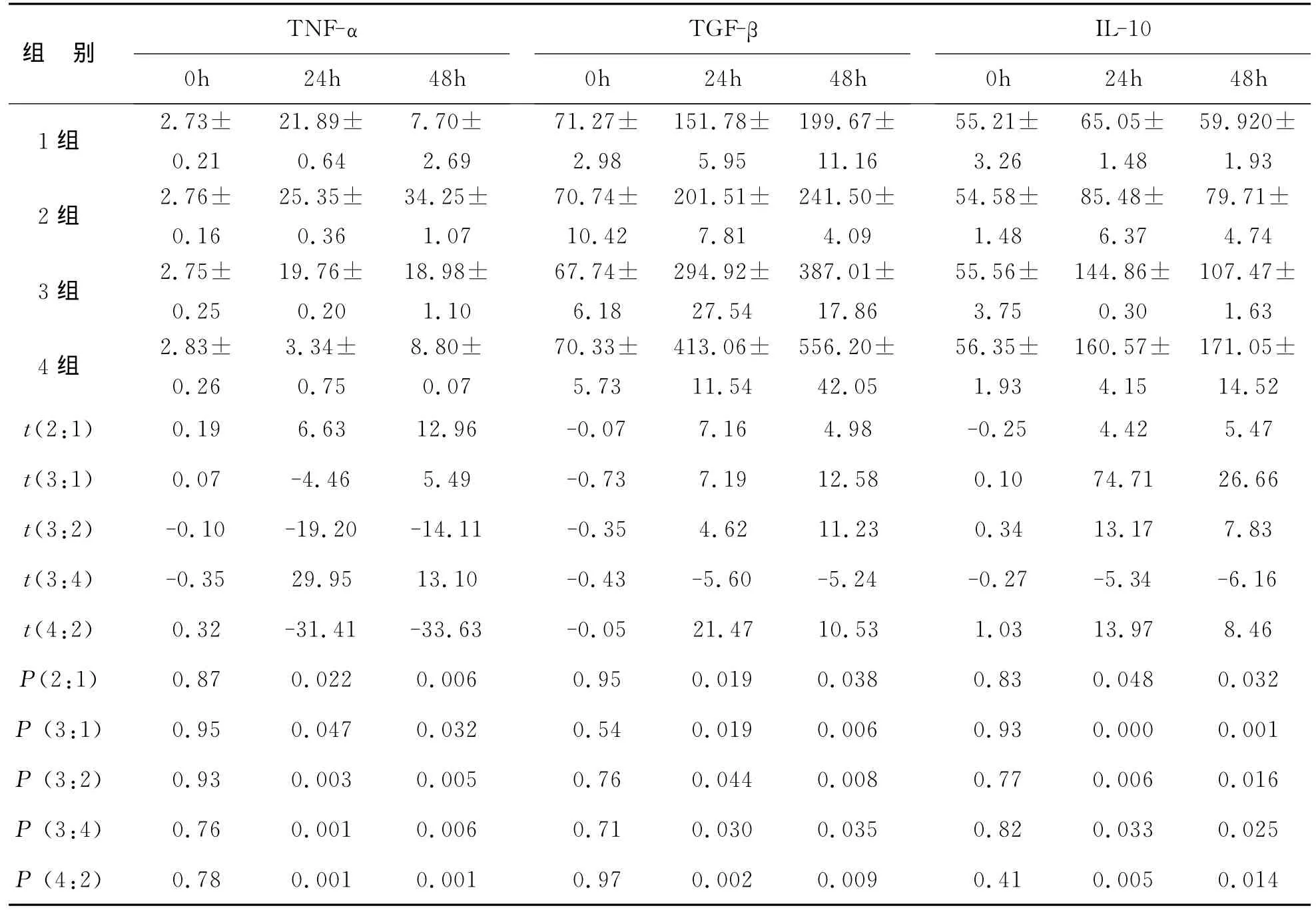
表1 各組24h和48h的 TNF-α、TGF-β1 和IL-10分泌量(±s,ng/L)
注:1組為淋巴細胞;2組為淋巴細胞+ConA;3組為淋巴細胞+ConA+MSCs;4組為淋巴細胞+ConA+MSCs+BRL
TNF-α IL-10組 別TGF-β 0h 24h 48h 0h 24h 48h 0h 24h 48h 1組 2.73±0.21 21.89±0.64 7.70±2.69 71.27±2.98 151.78±5.95 199.67±11.16 55.21±3.26 65.05±1.48 59.920±1.93 2組 2.76±0.16 79.71±4.74 3組 2.75±0.25 25.35±0.36 34.25±1.07 70.74±10.42 201.51±7.81 241.50±4.09 54.58±1.48 85.48±6.37 171.05±14.52 t(2:1) 0.19 6.63 12.96 -0.07 7.16 4.98 -0.25 4.42 5.47 t(3:1) 0.07 -4.46 5.49 -0.73 7.19 12.58 0.10 74.71 26.66 t(3:2) -0.10 -19.20 -14.11 -0.35 4.62 11.23 0.34 13.17 7.83 t(3:4) -0.35 29.95 13.10 -0.43 -5.60 -5.24 -0.27 -5.34 -6.16 t(4:2) 0.32 -31.41 -33.63 -0.05 21.47 10.53 1.03 13.97 8.46 P(2:1) 0.87 0.022 0.006 0.95 0.019 0.038 0.83 0.048 0.032 P(3:1) 0.95 0.047 0.032 0.54 0.019 0.006 0.93 0.000 0.001 P(3:2) 0.93 0.003 0.005 0.76 0.044 0.008 0.77 0.006 0.016 P(3:4) 0.76 0.001 0.006 0.71 0.030 0.035 0.82 0.033 0.025 P(4:2) 0.78 0.001 0.001 0.97 0.002 0.009 0.41 0.005 0.014 107.47±1.63 4組 2.83±0.26 19.76±0.20 18.98±1.10 67.74±6.18 294.92±27.54 387.01±17.86 55.56±3.75 144.86±0.30 3.34±0.75 8.80±0.07 70.33±5.73 413.06±11.54 556.20±42.05 56.35±1.93 160.57±4.15
3 MTT法檢測MSCs對淋巴細胞增殖作用結果見表2。24h和48h的3、4組OD值較1、2組降低(P<0.05),0h基本沒有變化(P>0.05)。
4 流式檢測Treg含量結果 見圖3。24h和48h的3、4組Treg含量均較1、2組增高(P<0.05),并且48h含量較高于24h(P<0.05)。
表2 各組24h和48h的OD值(±s)
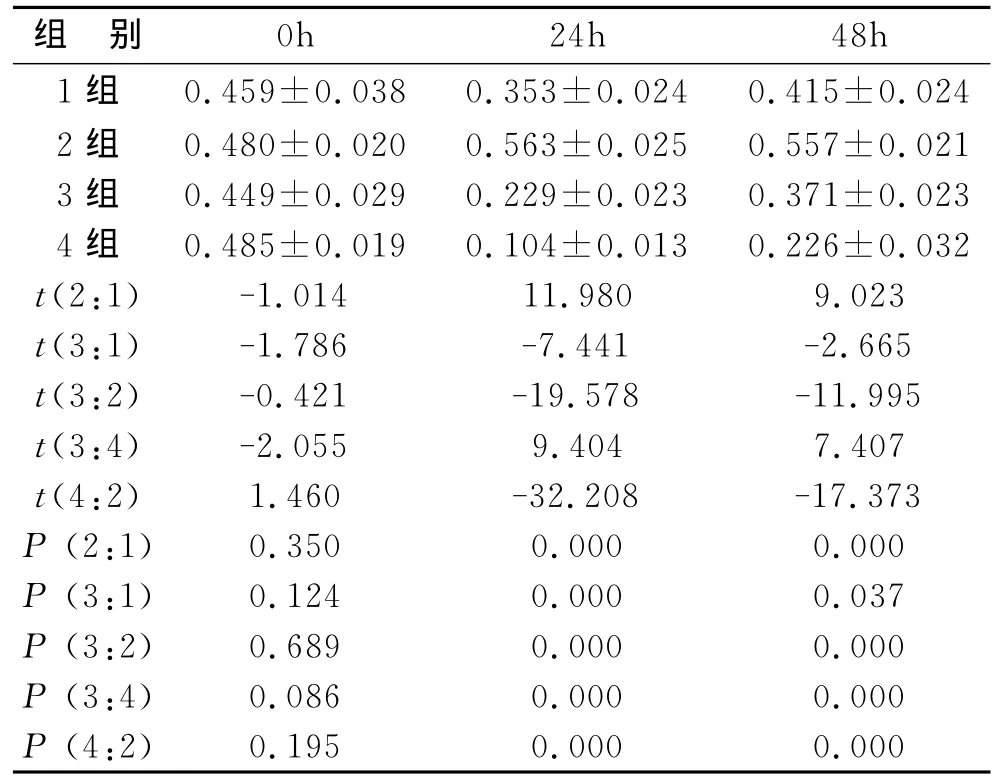
表2 各組24h和48h的OD值(±s)
注:1組為淋巴細胞;2組為淋巴細胞+ConA;3組為淋巴細胞+ConA+MSCs;4組為淋巴細胞+ConA+MSCs+BRL
組 別 0h 24h 48h 1組 0.459±0.038 0.353±0.024 0.415±0.024 2組 0.480±0.020 0.563±0.025 0.557±0.021 3組 0.449±0.029 0.229±0.023 0.371±0.023 4組 0.485±0.019 0.104±0.013 0.226±0.032 t(2:1) -1.01411.980 9.023 t(3:1) -1.786-7.441-2.665 t(3:2) -0.421-19.578-11.995 t(3:4) -2.055 9.404 7.407 t(4:2) 1.460-32.208-17.373 P(2:1) 0.350 0.000 0.000 P(3:1) 0.124 0.000 0.037 P(3:2) 0.689 0.000 0.000 P(3:4) 0.086 0.000 0.000 P(4:2) 0.195 0.000 0.000
討 論
骨髓MSCs主要有賴于其免疫表型而被識別,我們對分離擴增后的骨髓MSCs的表面標志進行了流式細胞儀檢測,結果表明骨髓MSCs高表達CD90、CD29和RT1A,不表達CD45、CD34和RT1B,與文獻報道一致[2]。許多研究已表明:MSCs可以抑制同種異體抗原對T細胞刺激的反應,但具體機制尚不清楚。有研究認為骨髓MSCs發揮作用是通過細胞-細胞接觸,但是更多則認為是通過分泌可溶性因子實現的[3]。本實驗建立體外共培養系統觀察MSCs對淋巴細胞的影響,檢測發現抑炎細胞因子TGF-β1和IL-10的含量在含有骨髓MSCs組均顯著增高,促炎細胞因子TNF-α含量降低,以及Treg含量增高,說明MSCs能夠促進負性免疫應答。
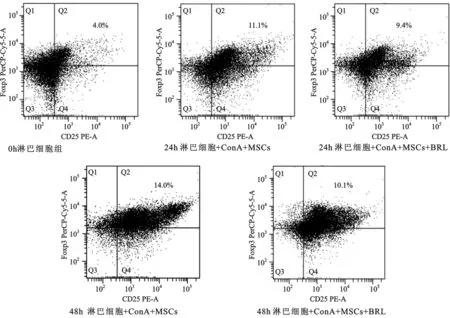
圖3 Treg流式圖
TGF-β1是免疫系統中良好的負性調節因子,能夠誘導自身耐受和器官耐受,維持免疫平衡[4]。Bertolo等[5]將 MSCs與外周血淋巴細胞共培養發現TGF-β1表達增加。Qian等[6]等的研究也證實了TGF-β1在MSCs對淋巴細胞的抑制作用中非常重要,我們的實驗結果與之一致,同時證明了這種作用隨時間延長幾乎沒有改變。
IL-10是另一重要的負性免疫調節因子,能夠抑制單核/巨噬細胞 MHC-Ⅱ類分子,間接降低T細胞增殖。Gao等[7]發現IL-10在MSCs發揮抑制作用中有著重要作用。這與我們的實驗結果一致,但是有部分學者認為:在MSCs對淋巴細胞抑制過程中,IL-10的分泌量沒有增加,其具體機制有待證實。
TNF-α除致炎作用外,還能夠促進T細胞、胸腺細胞以及B細胞等的增殖和分化,參與某些免疫病理過程。方 翔[8]等經動物實驗發現骨髓MSCs移植能夠降低肺氣腫大鼠血漿中TNF-α的含量。這與我們實驗結果相同,說明骨髓MSCs能夠通過降低TNF-α的分泌來減弱淋巴細胞的增殖和分化。
Treg是一類表面高表達IL-2受體α鏈(CD25)、胞質中表達Foxp3轉錄因子的CD4+T細胞,能夠抑制CD4+和CD8+T細胞的活化和增殖,達到負性調節以及自身免疫耐受的作用。Wang等[9,10]經動物實驗發現:骨髓MSCs移植能夠顯著增加外周血和淋巴結中Treg的含量,抑制急性排斥反應,延長受鼠的生存時間。我們的體外實驗得到了相同結果,這表明MSCs能夠通過提高Treg含量抑制淋巴細胞增殖。
肝臟作為“免疫特惠器官”表現一定程度的天然免疫耐受性,移植排斥反應發生率和嚴重度較少較輕,但是這仍然是移植失敗的一個主要因素。我們在共培養體系中加入BRL,想由此來了解骨髓MSCs在大鼠正常肝細胞存在情況下是否仍然對淋巴細胞起到抑制作用。
總之,骨髓MSCs具有抗炎和免疫調節的能力,使其成為治療免疫系統紊亂引起的疾病的潛在方法,例如移植后排斥反應。
[1]Uccelli A,Moretta L,Pistoia V.Immunoregulatory func-tion of mesenchymal stem cells[J].Eur J Immunol,2006,36(10):2566-2573.
[2]Krampera M,Cosmi L,Angeli R,et al.Role of the interferon-gamma in the immunomodulatory activity of human mesenchymal stem cells[J].Stem cells,2005,24(2):386-398.
[3]Sioud M.New insights into mesenchymal stromal cellmediated T-cell suppression through galectins[J].Scand Immunol,2011,73(2):79-84.
[4]Bommireddy R,Saxena V,Ormsby I,et al.TGF-beta 1 regulates lymphocyte homestasis by preventing activation and subsequent apoptosis of peripheral lymphocyte[J].J Immunol,2003,170(9):4612-4622.
[5]Bertolo A,Thiede T,Aebli N,et al.Human mesenchymal stem cell co-culture modulates the immunological properties of human intervertebral disc tissue fragments in vitro[J].Eur Spine J,2011,20(4):592-603.
[6]Qian BF,WahI SM.TGF-beta can leave you breathless[J].Curr Opin Pharmacol,2009,9(4):454-461.
[7]Gao K,Chen Y,Wei L,et al.Inhibitory effect of mesenchymal stem cells on lymphocyte proliferation[J].Cell Biochem Funct,2008,26(8):900-907.
[8]方 翔,湯兵祥.骨髓間充質干細胞移植對肺氣腫大鼠血漿 TNF-α的作用[J].中國實用醫刊,2010,37(5):18-22.
[9]Wang D,Zhang H,Liang J,et al.Effect of allogeneic bone marrow-derived mesenchymal stem cells transplantation in a polyl:C-induced primary biliary cirrhosis mouse model[J].Clin Exp Med,2011,11(1):25-32.
[10]Wang Y,Zhang A,Ye Z,et al.Bone marrow-derived mesenchymal stem cells inhibit acute rejection of rat liver allografts in association with regulatory T-cell expansion[J].Transplant Proc,2009,41(10):4352-4356.

