煙曲霉與人肺上皮細胞中E-cadherin相結合蛋白的初步研究
徐小勇,王 玉,孫 禾,張鵬鵬,施 毅
煙曲霉(Aspergillusfumigatus)是自然界中廣泛存在的腐生微生物,也是一種非常重要的條件致病真菌。煙曲霉感染特別是侵襲性肺曲霉病預后差,即使正確的抗真菌治療后,病死率仍高達50%[1]。目前,對于煙曲霉具體致病機制仍知之甚少[2-3]。肺泡上皮細胞是侵襲性肺曲霉病致病的第一站,曲霉孢子是借助何種侵襲因子與上皮細胞接觸進而侵入宿主細胞目前仍未明確[4]。
病原體侵入宿主細胞的機制在產單核細胞李斯特菌(Listeriamonocytogenes)、白念珠菌等侵入上皮細胞過程中有充分的研究[5-9]。李斯特菌侵襲因子internalin A(Inl A)的胞外段以15個β-sheet形成半圓型結構可以和上皮細胞黏附子E-cadherin的胞外結構EC1結合,從而介導了李斯特菌黏附侵入上皮細胞。先前的研究表明,cadherin參與了煙曲霉黏附侵襲宿主細胞的過程,即煙曲霉中存在可以和人E-cadherin結合的蛋白序列[10-11]。本研究擬通過生物信息學和分子生物學方法對煙曲霉中與cadherin結合的侵襲因子進行初步探討。
材料與方法
一、煙曲霉中InlA相似序列的搜索
在PubMed上搜索李斯特菌的InlA氨基酸序列,記錄其中參與結合E-cadherin的功能域富亮氨酸重復序列(leucine-rich repeats,LRRs),以此序列在煙曲霉基因組(Af293)查詢相似序列(BLASTp)[12]。ExPASy Proteomics Server的Compute pI/Mw tool計算相關序列的相對分子質量和等電點,分析一級結構。
二、相似序列二級結構的預測
應用EXPASY(www.expasy.org/tools)上的PredictProtein(PHD,多重比對人工神經網絡比對預測結構法)分析預測相似序列的二級結構。
三、三級結構預測
對同源性大于30%的蛋白上傳至SWISSMODEL服務器開展模型構建工作,其他同源性不足的蛋白選擇Phyre(Successor of 3D-PSSM),用swiss-pdb viewer分析觀察模擬的三級結構。
四、免疫共沉淀
煙曲霉標準株(AF293)由我院微生物室提供,生長于沙保弱培養基后5 d,滅菌磷酸緩沖液(PBS)沖洗獲取培養基表面的孢子,用16層紗布過濾,血球計數板計數后,用無血清DMEM培養液(Gibco)稀釋到107個/mL,4℃儲存備用。純化的人E-cadherin蛋白購自北京義楚神州生物技術公司(100μg)。離心沉淀煙曲霉孢子,充分裂解,加入純化E-cadherin 50μg,常規方法行免疫共沉淀,電泳分析其相對分子質量。
結果
一、Inl A中LRR的氨基酸序列
LRR的氨基酸序列為:IDGLEYLNNLTQINFSNNQLTDITPLKULTKLVDILMNNNQIADITPLANSSNLTGLTLFNNQITDIDPLKNLTNLNRLELSSNTISDISALSGLTSLQQLSFGNQVTDLKPLANLTTLERLDISSNKVSDISVLAKLTNLESLIATNNQISDITPLGILTNLDELSLNGNQLKUIG。
以此序列在煙曲霉AF293中搜索相似序列,見表1。結合對相似序列的描述,選擇XP750927.1、XP750245.1、XP752100.1、XP748256.1進行進一步的分析。
相似序列一級結構的分析,見表2。
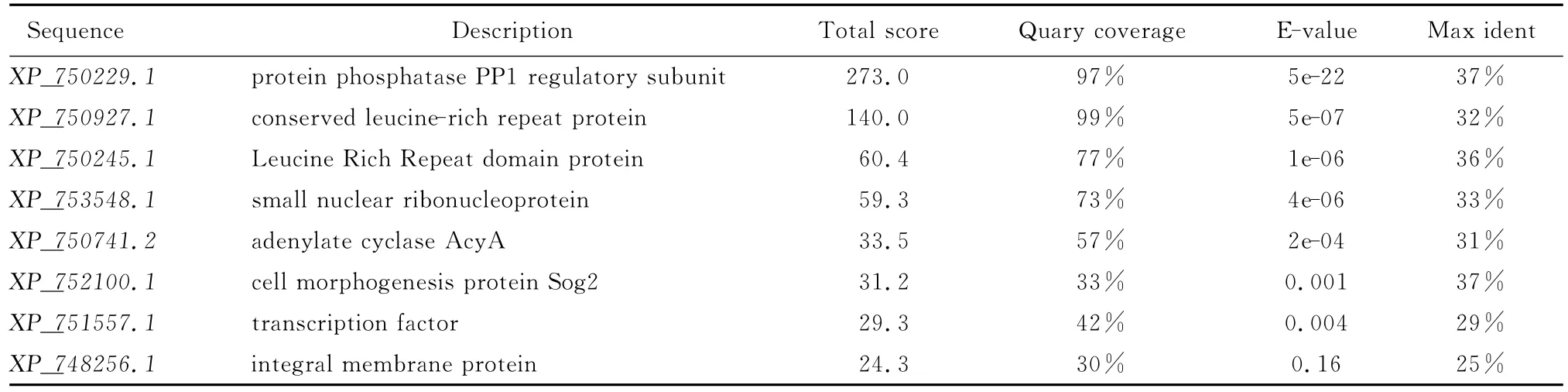
表1 曲霉基因組中的Inl A同源序列Table 1 Homologous sequences with InlA in Aspergillus fumigatus genome
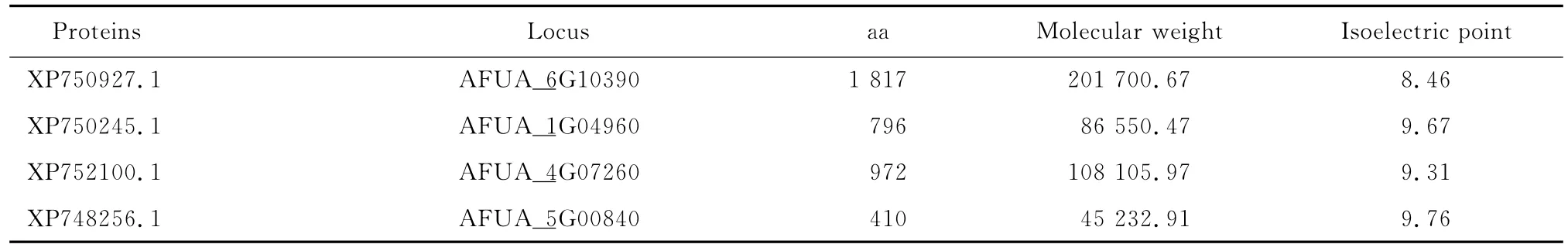
表2 相似蛋白的基本信息Table 2 Basic information of relevant proteins
二、相似序列二級結構的預測
(一)XP750245.1的二級結構 蛋白的H螺旋結構占30.14%,β折疊占4.84%,無規則卷曲占65.02%。無穿膜序列及核定位序列。
(二)XP750927.1的二級結構 蛋白的H螺旋結構占9.63%,β折疊占7.98%,無規則卷曲占82.39%。無穿膜序列及核定位序列。
(三)XP752100.1的二級結構 蛋白的H螺旋結構占25%,β折疊占6.53%,無規則卷曲占68.47%。無穿膜序列及核定位序列。
(四)XP748256.1的二級結構 蛋白的H螺旋結構占40.98%,β折疊占17.32%,無規則卷曲占41.71%。預測7個穿膜序列,最高評分為0.893 1,為第239-257氨基酸殘基。最高Zscore=1.287。無核定位序列。
(五)三級結構的預測 通過將上述4蛋白的序列提交給SWISS-MODEL(同源重建)和Phyre服務器。XP750927.1和XP750245.1同源性較好采用swiss-model的同源重建,其余提交Phyre服務器,獲得三維結構,見圖1。提示XP752100.1、XP748256.1與InlA三維結構類似。

圖1 煙曲霉中與InlA相似蛋白的三級結構模擬圖Figure 1 The diagram of the tertiary structure of the proteins in Aspergillus fumigatus which are similar to Inl A
三、免疫共沉淀
煙曲霉蛋白組與人重組E-cadherin行免疫共沉淀,分離蛋白后行電泳分析。提示與E-cadherin結合的蛋白出現在43×103~55×103,見圖2,箭頭所示。

圖2 煙曲霉中與E-cadherin可結合蛋白電泳圖Figure 2 The protein binding to E-cadherin in Aspergillus fumigatus
在43×103~55×103區間存在一淡色條帶,箭頭所示,對照組缺失,提示在煙曲霉中存在此區間蛋白可以和人重組E-cadherin結合。
討 論
煙曲霉孢子直徑2~3μm,懸浮于空氣中而易被宿主吸入到肺泡中,在宿主免疫力低下時,孢子躲避了肺泡巨噬細胞的吞噬而進入肺泡上皮細胞內,進而可發育成菌絲,侵襲性生長乃至全身播散。孢子進入肺泡上皮細胞是侵襲性肺曲霉病致病的第一步,研究其侵襲機制,特別是分子機制,針對特定靶位涉及藥物可降低侵襲性肺曲霉病的病死率。
大規模高通量測序技術的進步帶來了生物信息學快速發展,使生物信息學深入到各項生命科學研究中。在生物信息學的推動下,可以迅速了解蛋白質甚至是病原體和宿主相互作用的結構基礎,推測出新的蛋白質相互作用[13-14]。蛋白質相互作用一般是通過特定的、較為保守的結構域完成,我們通過十分明確的李斯特菌InlA與上皮細胞E-cadherin相互作用機制推測煙曲霉中可能與cadherin結合的蛋白配體,并通過簡單易行的蛋白質相互作用實驗來初步探討cadherin的配體。免疫共沉淀的方法初步表明,煙曲霉中與上皮細胞E-cadherin的蛋白相對分子質量為50×103,與生物信息學推測的XP748256.1相對分子質量類似,并有穿膜序列,表明了XP748256.1有可能為人肺泡上皮細胞E-cadherin的配體。從質量上分析,我們預測的蛋白與實際的蛋白質量上有一定的誤差,這可能由于蛋白合成后存在糖化或其他的一些修飾反應而導致質量的變化。另外,電泳中的不規則遷移也可導致測定的質量發生誤差,但誤差一般不超過30%[15],而我們目標蛋白恰在誤差范圍內。當然,最終蛋白的測定還需要質譜等檢測來分析,并通過進一步的分子生物學的實驗證實其作用。
絕大多數蛋白質現在還不能通過X線晶體衍射或磁共振來測定結構,因此需要通過生物信息學的預測方法來推斷蛋白質的三維結構[16-17]。同源建模是最常用的建模方法[18],但只有當目標研究蛋白的同源性在30%以上時結果才相對可靠。對同源性在30%以下的蛋白,THREADING預測法是近年發展起來的一種新方法[19],我們選擇基于此的Phyre對未知蛋白進行預測[20]。其主要原理是把未知蛋白質的氨基酸序列和蛋白質結構數據庫中已明確的蛋白質折疊進行比對,選擇最好的模型進行構建。
總之,通過初步的生物信息學和分子生物學推測,cadherin在煙曲霉蛋白XP748256.1可能為E-cadherin相關的結合蛋白,但需進一步的分子生物學技術來論證。
[1]Thompson GR3rd,Patterson TF.Pulmonary aspergillosis[J].Semin Respir Crit Care Med,2008,29(2):103-110.
[2]Segal BH.Aspergillosis[J].N Engl J Med,2009,360(18):1870-1884.
[3]Dagenais TR,Keller NP.Pathogenesis ofAspergillusfumigatusin invasive Aspergillosis[J].Clin Microbiol Rev,2009,22(3):447-465.
[4]Filler SG,Sheppard DC.Fungal invasion of normally nonphagocytic host cells[J].PLoS Pathog,2006,2(12):e129.
[5]Schubert WD,Urbanke C,Ziehm T,et al.Structure of internalin,a major invasion protein ofListeriamonocytogenes,in complex with its human receptor E-cadherin[J].Cell,2002,111(6):825-836.
[6]Bonazzi M,Lecuit M,Cossart P.Listeria monocytogenes internalin and E-cadherin:from structure to pathogenesis[J].Cell Microbiol,2009,11(5):693-702.
[7]Rajam G,Anderton JM,Carlone GM,et al.Pneumococcal surface adhesin A(PsaA):a review[J].Crit Rev Microbiol,2008,34(3-4):163-173.
[8]Phan QT,Fratti RA,Prasadarao NV,et al.N-cadherin mediates endocytosis ofCandidaalbicansby endothelial cells[J].J Biol Chem,2005,280(11):10455-10461.
[9]Phan QT,Myers CL,Fu Y,et al.Als3is aCandidaalbicansinvasin that binds to cadherins and induces endocytosis by host cells[J].PLoS Biol,2007,5(3):e64.
[10]徐小勇,施毅,張鵬鵬,等.N-鈣黏蛋白在煙曲霉黏附及侵襲內皮細胞中的作用[J].中華結核和呼吸雜志,2010,33(10):734-737.
[11]Xu XY,Shi Y,Zhang PP,et al.E-cadherin mediates adhesion and endocytosis ofAspergillusfumigatusblastospores in human epithelial cells[J].Chin Med J(Engl),2012,125(4):617-621.
[12]Nierman WC,Pain A,Anderson MJ,et al.Genomic sequence of the pathogenic and allergenic filamentous fungusAspergillusfumigatus[J].Nature,2005,438(7071):1151-1156.
[13]Tuncbag N,Gursoy A,Keskin O.Prediction of protein-protein interactions:unifying evolution and structure at protein interfaces[J].Phys Biol,2011,8(3):035006.
[14]Wass MN,David A,Sternberg MJ.Challenges for the prediction of macromolecular interactions[J].Curr Opin Struct Biol,2011,21(3):382-390.
[15]Wilkins MR,Pasquali C,Appel RD,et al.From proteins to proteomes:large scale protein identification by two-dimensional electrophoresis and amino acid analysis[J].Biotechnology(NY),1996,14(1):61-65.
[16]Fromme P,Spence JC.Femtosecond nanocrystallography using X-ray lasers for membrane protein structure determination[J].Curr Opin Struct Biol,2011,21(4):509-516.
[17]Wirmer-Bartoschek J,Bartoschek S.NMR in drug discovery on membrane proteins[J].Future Med Chem,2012,4(7):869-875.
[18]曾炳佳,曹以誠,杜正平,等.同源建模關鍵步驟的研究動態[J].生物學雜志,2008,25(2):7-10.
[19]Zhang Y.Progress and challenges in protein structure prediction[J].Curr Opin Struct Biol,2008,18(3):342-348.
[20]Kelley LA,Sternberg MJ.Protein structure prediction on the Web:a case study using the Phyre server[J].Nat Protoc,2009,4(3):363-371.

