拉氧頭孢的體外抗菌作用
楊 洋,朱德妹,葉信予,郭 燕,吳 湜,吳衛紅,胡付品,張嬰元
拉氧頭孢系日本鹽野義制藥株式會社研制,國內有海南海靈化學制藥有限公司生產的氧頭孢烯類抗生素,其抗菌作用特點與第三代頭孢菌素相似,故有時亦被歸入第三代頭孢菌素。為了解該藥對近期臨床分離細菌的抗菌活性,采用瓊脂稀釋法測定拉氧頭孢對近期臨床分離的大腸埃希菌、肺炎克雷伯菌等腸桿菌科細菌以及厭氧菌等的抗菌活性,并與其他抗菌藥物比較,現將結果報道如下。
材料與方法
一、材料
(一)細菌來源 收集2010—2011年上海、北京、廣東、浙江等11個省市部分醫院的臨床分離菌共612株,涉及16個菌屬23個菌種,其中包括腸桿菌科細菌398株,不發酵糖革蘭陰性桿菌110株,厭氧菌104株。腸桿菌科細菌包括大腸埃希菌和肺炎克雷伯菌各80株,產ESBLs菌株占一半,均經過ESBL確證試驗驗證。質控菌株為大腸埃希菌ATCC25922,銅綠假單胞菌ATCC27853,脆弱擬桿菌ATCC25285。
(二)抗菌藥物 拉氧頭孢、頭孢米諾為海南海靈化學制藥公司提供的產品;頭孢他啶、頭孢曲松、頭孢吡肟、頭孢哌酮-舒巴坦、哌拉西林-他唑巴坦、美羅培南、環丙沙星、慶大霉素、阿米卡星、替卡西林-克拉維酸、左氧氟沙星、甲氧芐啶-磺胺甲口惡唑、米諾環素、甲硝唑、克林霉素、氯霉素為中國食品藥品檢定研究院技術服務部標準品;亞胺培南為默沙東制藥公司產品。
(三)抗菌藥物紙片 頭孢他啶、頭孢噻肟、頭孢他啶-克拉維酸、頭孢噻肟-克拉維酸等檢測ESBLs的紙片為美國BBL公司產品。
(四)培養基和主要的試劑 需氧菌藥敏試驗用Mueller-Hinton培養基,厭氧菌藥敏用添加5%(v/v)脫纖維羊血及血紅素(5 mg/L)和維生素K1(1 mg/L)的Brucella培養基。MH培養基和Brucella培養基均為英國OXOID公司產品,Brucella厭氧菌藥敏培養基添加劑血紅素和維生素K1為Sigma-Aldrich公司產品;脫纖維羊血為上海閔行區諸翟無菌動物血試劑供應站產品。PCR擴增試劑盒為大連寶生物工程有限公司產品。PCR引物由上海生物工程有限公司合成。
二、方法
(一)最低抑菌濃度(MIC)測定
1.瓊脂稀釋法:按CLSI 2009年版M07-A8[1]和2007年版M11-A7[2]的推薦方法,采用瓊脂稀釋法測定拉氧頭孢及相關抗菌藥物對臨床分離菌的MIC。抗菌藥物測試濃度范圍為0.06~128 mg/L,按CLSI推薦的方法配制稀釋,用多點接種儀(A400,DENLEY)接種,腸桿菌科細菌和不發酵糖革蘭陰性桿菌接種菌量為104CFU/點,(35±2)℃培養20 h后閱讀結果,厭氧菌接種菌量為105CFU/點,(36±1)℃厭氧環境培養48 h后閱讀結果。
2.藥敏判讀標準:參照CLSI 2012年版M100-S22[3]的標準進行藥敏結果判讀,其中頭孢哌酮-舒巴坦按Jones等[4]報道以頭孢哌酮單藥的標準(≤16 mg/L敏感、32 mg/L中介、64 mg/L耐藥)判讀。CLSI無頭孢米諾的相關判讀標準,亦無拉氧頭孢對不發酵糖革蘭陰性桿菌和厭氧菌的判讀標準。采用SPSS統計軟件對藥敏試驗結果進行分析。
(二)β內酰胺酶檢測
1.ESBL表型確證試驗:按CLSI推薦[3]的酶抑制劑增強試驗檢測大腸埃希菌和肺炎克雷伯菌的ESBLs。如頭孢他啶或頭孢噻肟加克拉維酸后對受試菌的抑菌圈直徑與不加克拉維酸的單藥抑菌圈直徑相比,差值≥5 mm時,即判定為產ESBL菌株。
2.質粒AmpC檢測:根據文獻[5]采用多重PCR檢測大腸埃希菌和肺炎克雷伯菌的AmpC酶。
結果
一、β內酰胺酶的檢測結果
受試的160株大腸埃希菌和肺炎克雷伯菌,經ESBL確證試驗結果顯示,產ESBLs大腸埃希菌和肺炎克雷伯菌各40株,其中上述菌株中分別又有2株和7株細菌兼產AmpC酶。非產ESBLs的大腸埃希菌和肺炎克雷伯菌亦各40株,但后者有1株產AmpC酶。見表1。

表1 160株受試大腸埃希菌和肺炎克雷伯菌中產ESBLs和AmpC酶菌株的檢出率[n,(%)]Table 1 Prevalence of ESBLs and/or AmpC-producing strains in160 Escherichia coli and Klebsiella pneumoniae isolates[n,(%)]
二、拉氧頭孢對各種受試菌的MIC
拉氧頭孢對大腸埃希菌、肺炎克雷伯菌、腸桿菌屬、變形桿菌屬、黏質沙雷菌、弗勞地枸櫞酸桿菌、摩氏摩根菌等腸桿菌科細菌均具有良好的抗菌活性,包括產ESBLs的大腸埃希菌和肺炎克雷伯菌在內。拉氧頭孢除對弗勞地枸櫞酸桿菌和腸桿菌屬細菌的MIC90分別為8 mg/L和4 mg/L外,對其他受試腸桿菌科細菌的MIC90為0.125~1 mg/L,見表2。
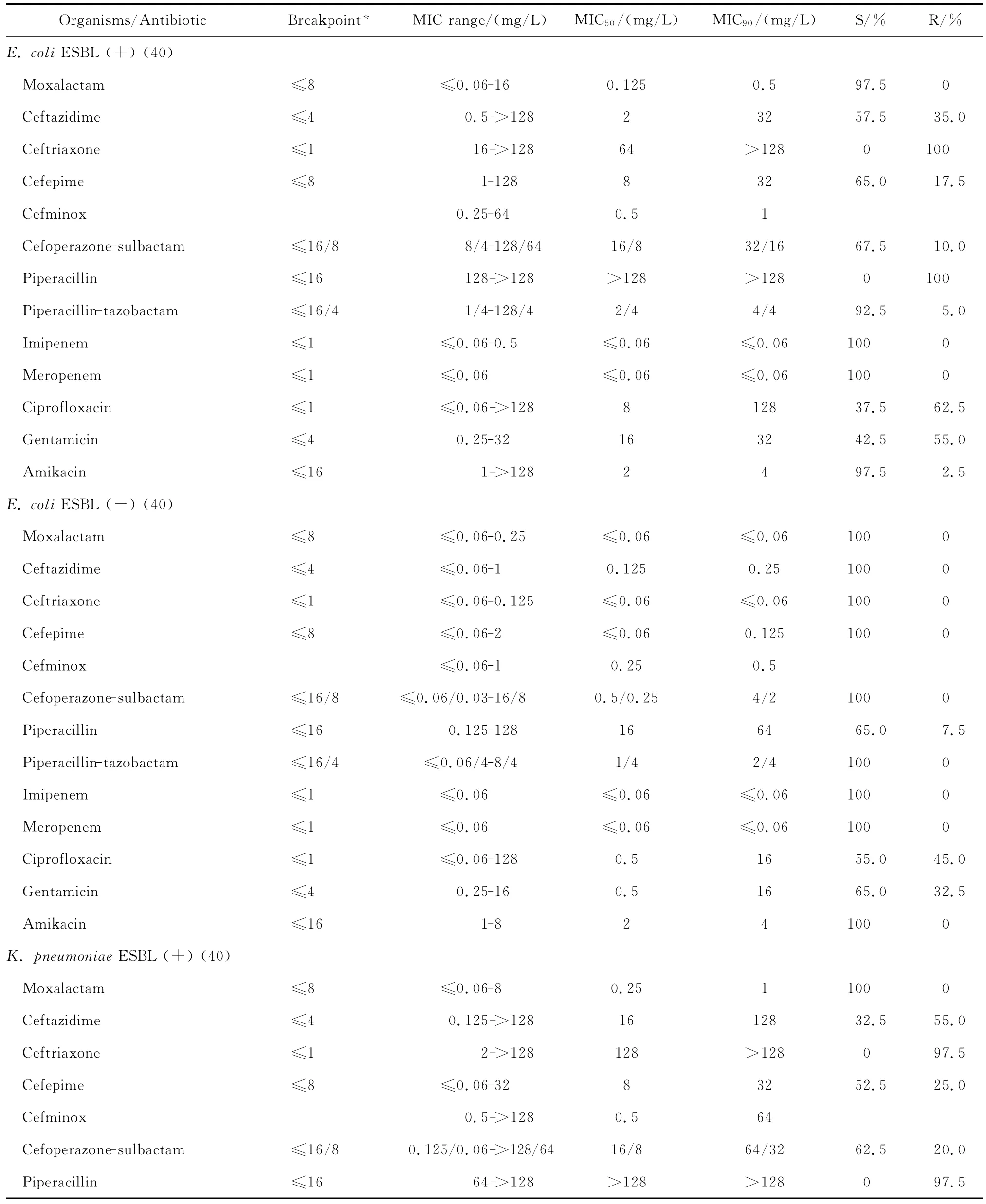
表2 拉氧頭孢等抗菌藥物對398株腸桿菌科細菌的藥敏試驗Table 2 In vitro activities of moxalactam and comparative antibiotics against Enterobacteriaceaisolates(n=398)
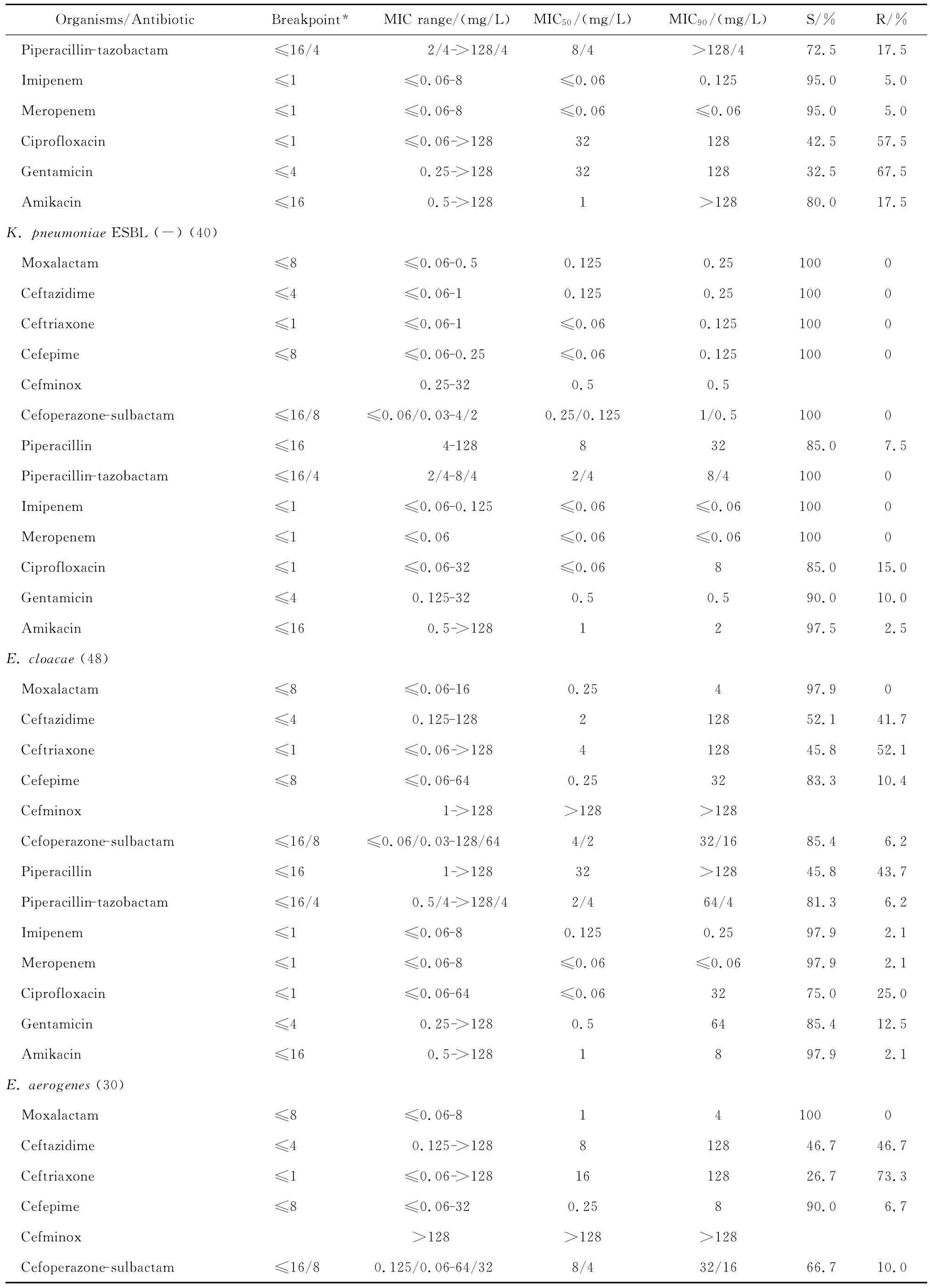
continued table 2
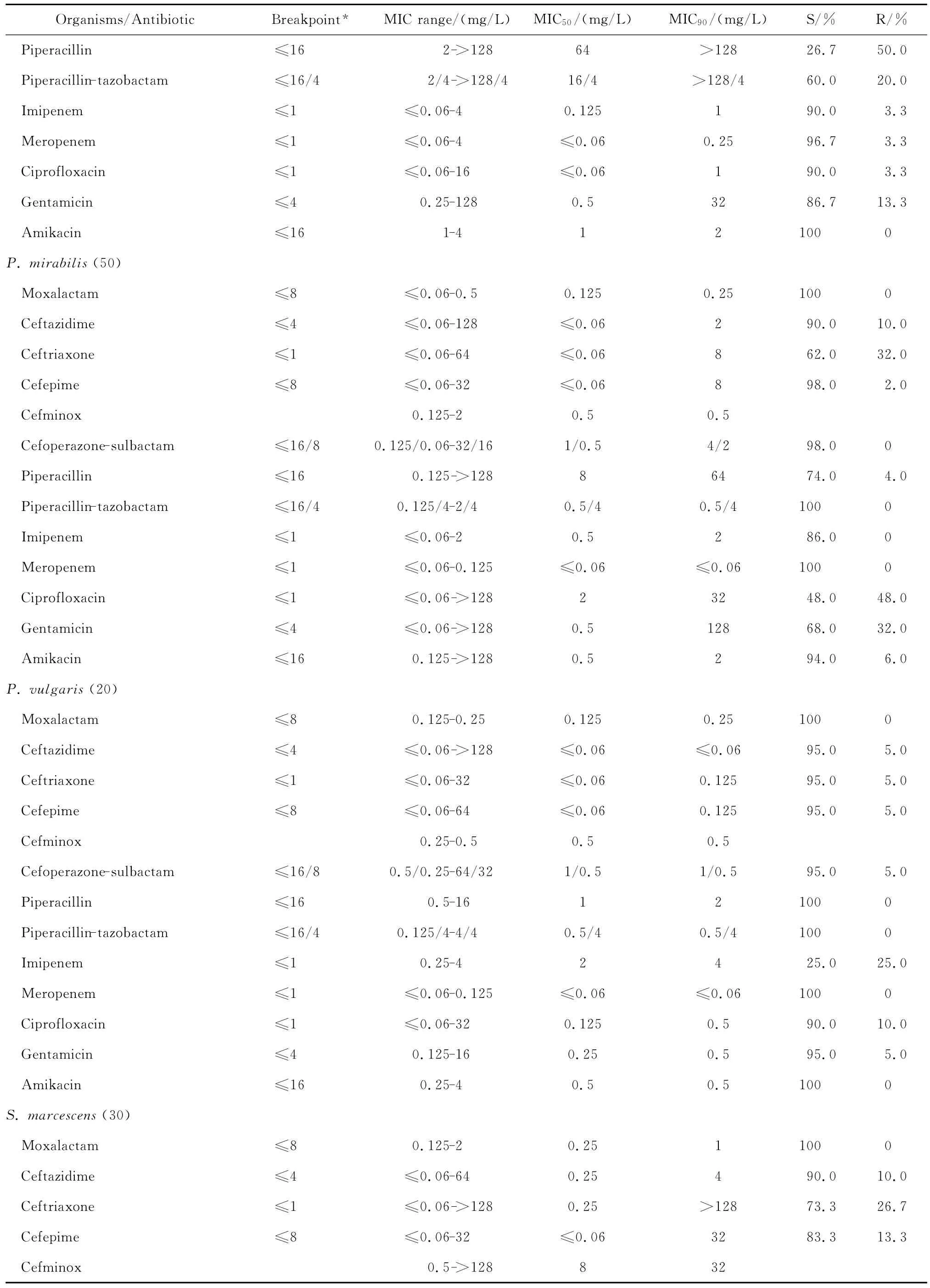
continued table 2
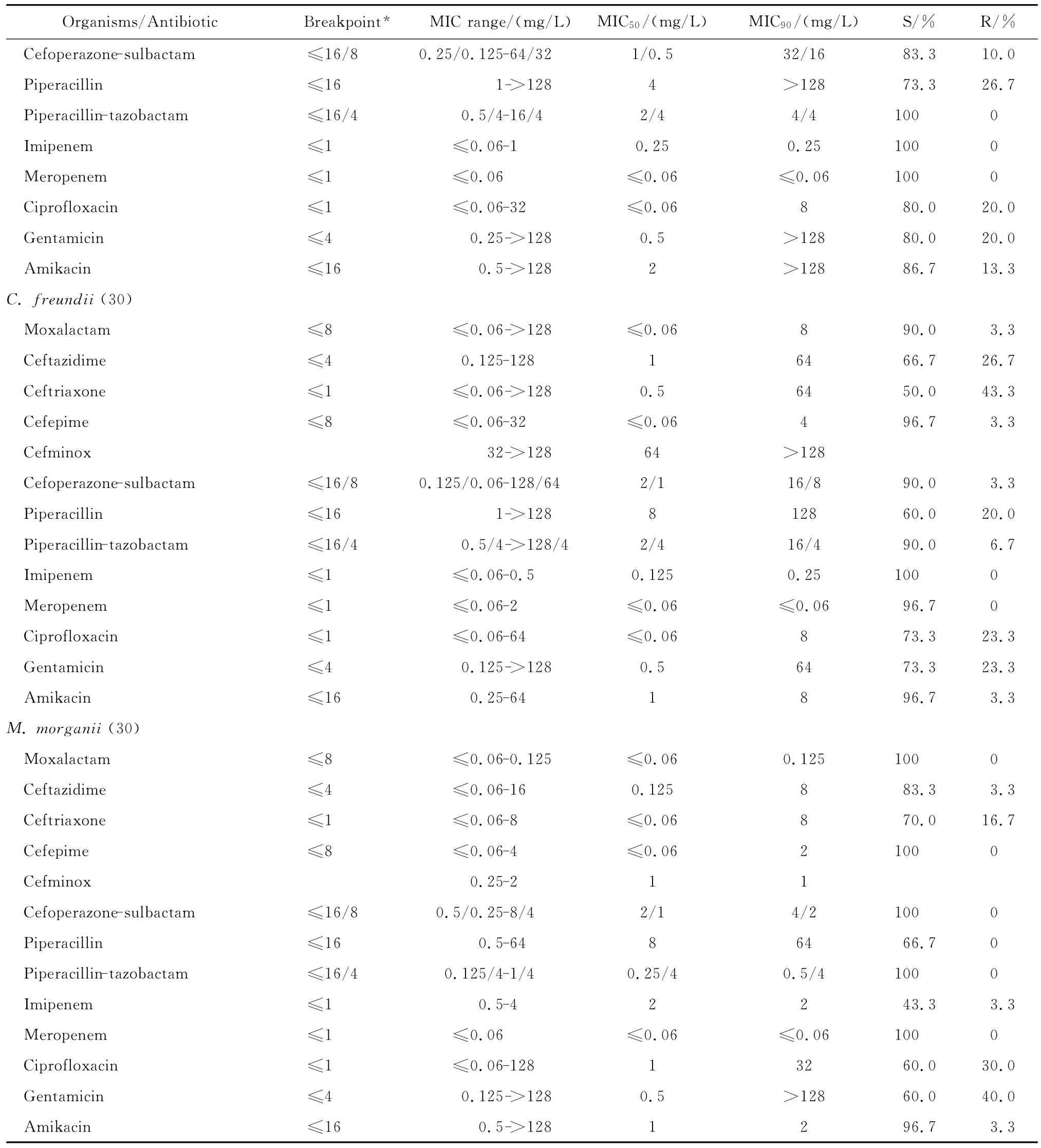
continued table 2
拉氧頭孢對銅綠假單胞菌、鮑曼不動桿菌和洋蔥伯克霍爾德菌等不發酵糖革蘭陰性桿菌的抗菌活性較弱。拉氧頭孢除了對嗜麥芽窄食單胞菌的MIC90為8 mg/L外,對其他受試不發酵糖革蘭陰性桿菌的MIC90均≥64 mg/L,見表3。
拉氧頭孢對脆弱擬桿菌和普雷沃菌屬細菌亦有一定的抗菌活性,MIC50分別為2 mg/L和1 mg/L,MIC90分別為64 mg/L和32 mg/L;但對其他擬桿菌屬細菌的抗菌活性差。拉氧頭孢對梭桿菌屬和消化鏈球菌屬細菌均有良好的抗菌活性,其MIC50和MIC90分別為0.25~2 mg/L和2~4 mg/L,但對韋榮球菌屬細菌的MIC50和MIC90分別為8 mg/L和16 mg/L,見表4。
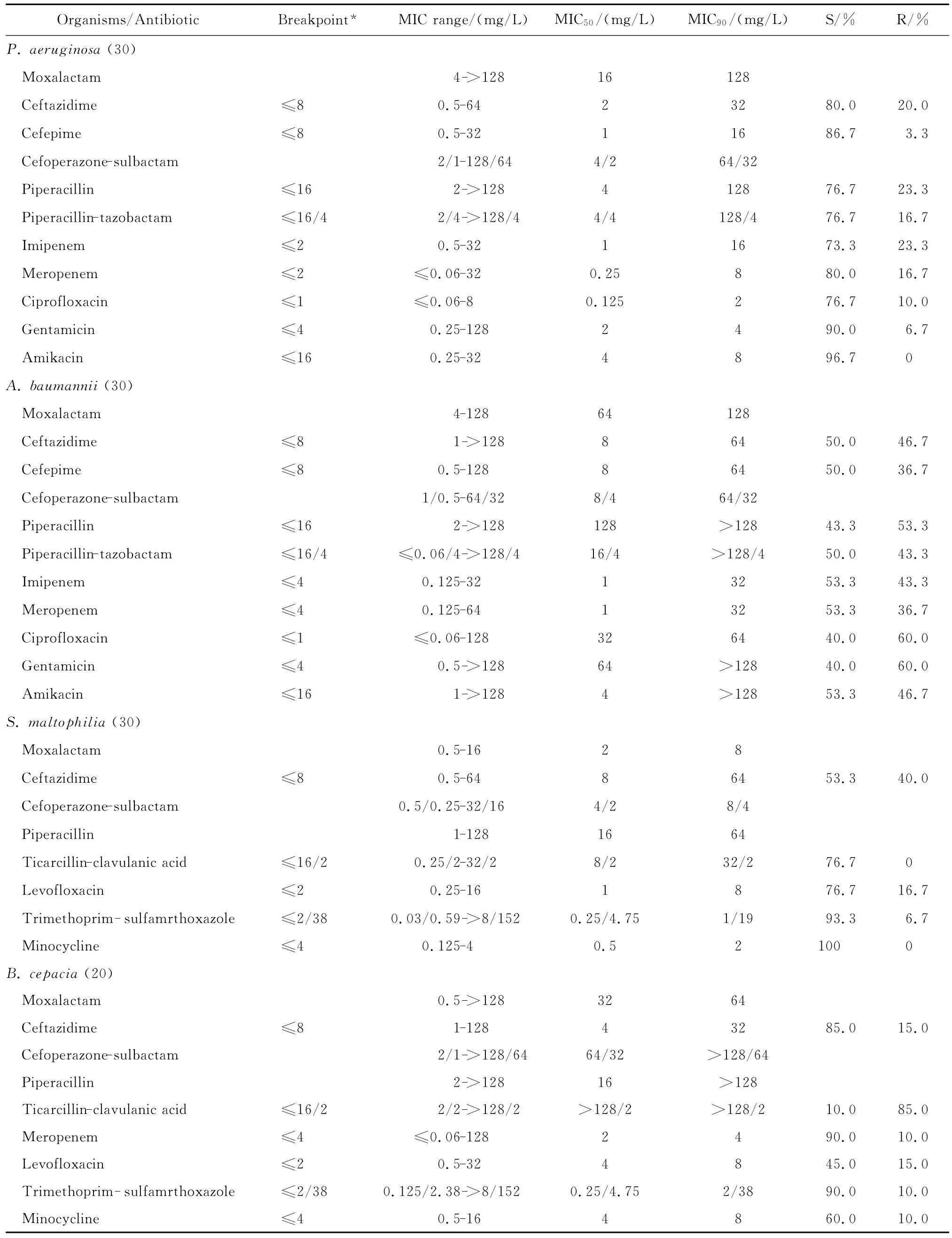
表3 拉氧頭孢等抗菌藥物對110株不發酵糖革蘭陰性桿菌的藥敏試驗Table 3 In vitro activities of moxalactam and comparative antimicrobial agents against non-fermentative gram-negative rods(n=110)
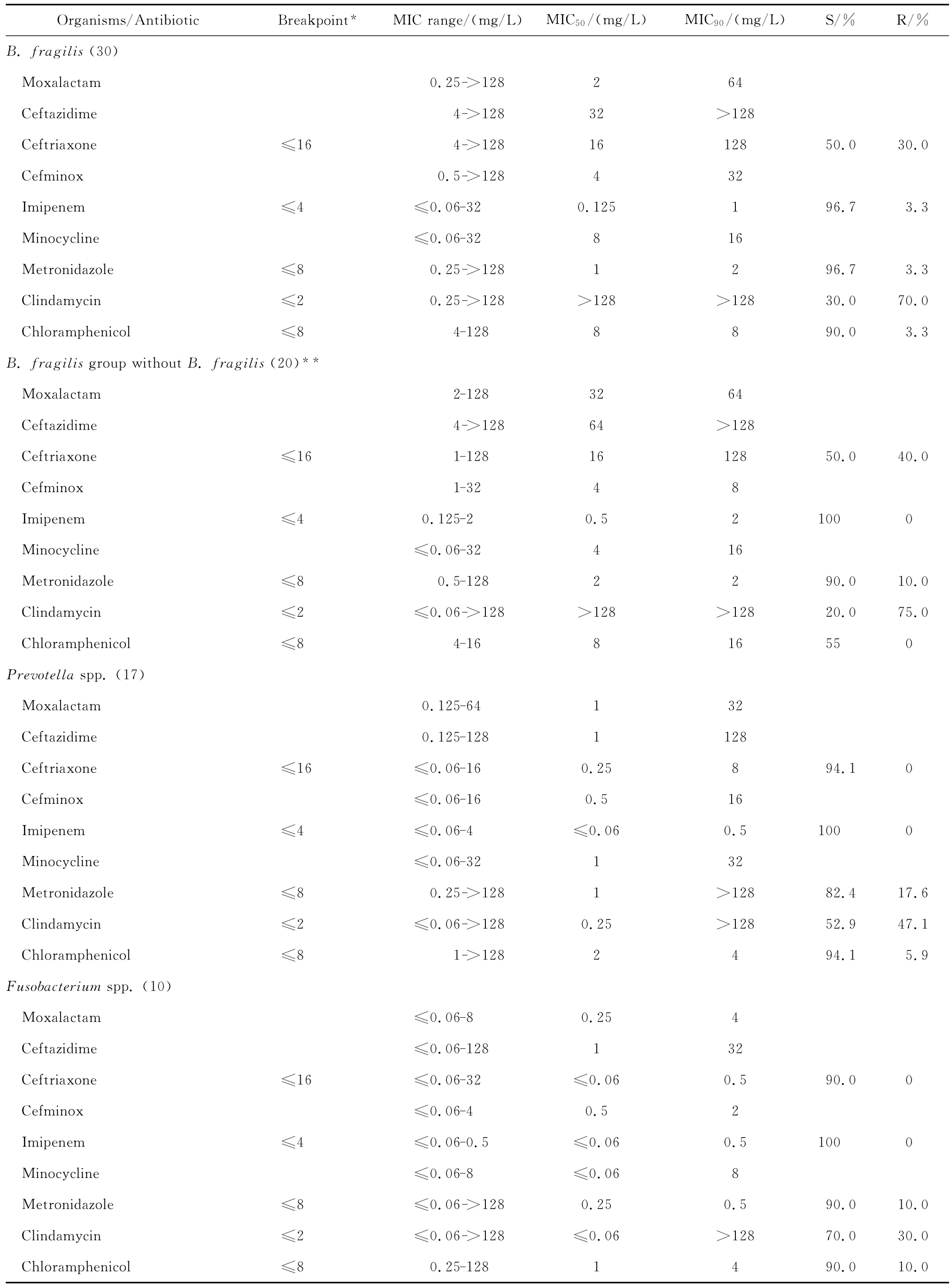
表4 拉氧頭孢等抗菌藥物對104株厭氧菌的藥敏試驗Table 4 In vitro activities of moxalactam and comparative antimicrobial agents against anaerobic bacterium(n=104)
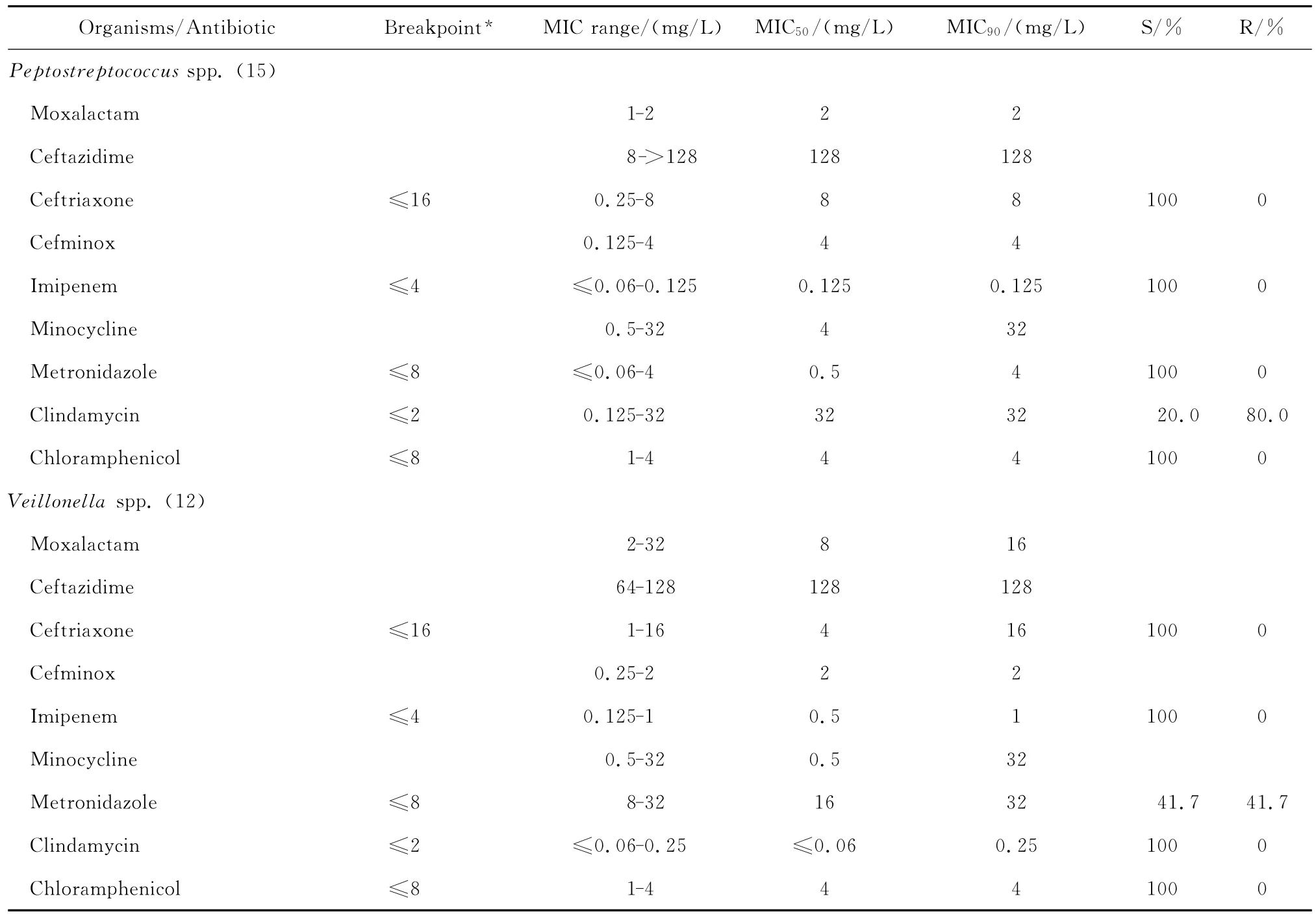
continued table 4
三、受試藥與其他對照藥的體外抗菌活性比較
與第三、四代頭孢菌素相比,拉氧頭孢對產ESBLs大腸埃希菌和肺炎克雷伯菌的抗菌活性較上述2類頭孢菌素強。0.25 mg/L拉氧頭孢即可分別抑制100%大腸埃希菌和90.0%以上肺炎克雷伯菌中產ESBLs菌株的生長,但4 mg/L頭孢他啶僅能分別抑制57.5%大腸埃希菌和32.5%肺炎克雷伯菌中產ESBLs株生長,頭孢曲松對之幾無抗菌活性;8 mg/L頭孢吡肟只能抑制50.0%大腸埃希菌和肺炎克雷伯菌中的產ESBLs株。其中對大腸埃希菌和肺炎克雷伯菌中產ESBLs株的抗菌活性與受試的2種酶抑制劑復方抗菌活性相仿,對不產酶株的抗菌活性優于酶抑制劑復方。0.25 mg/L拉氧頭孢即可抑制所有非產ESBLs大腸埃希菌和肺炎克雷伯菌的生長,抗菌活性優于或相仿于頭孢他啶、頭孢曲松、頭孢吡肟。
拉氧頭孢對腸桿菌屬、奇異變形桿菌、沙雷菌屬、摩根菌屬等其他腸桿菌科細菌的抗菌活性亦明顯優于頭孢他啶、頭孢曲松和頭孢吡肟,4 mg/L或8 mg/L拉氧頭孢即可抑制大多數受試的其他腸桿菌科細菌生長,亦可分別抑制97.9%陰溝腸桿菌和90.0%弗勞地枸櫞酸桿菌生長。
拉氧頭孢對腸桿菌科細菌的抗菌活性較頭孢米諾、頭孢哌酮-舒巴坦和哌拉西林-他唑巴坦為優或相仿,但對腸桿菌科細菌的抗菌活性較碳青霉烯類抗生素差(亞胺培南對變形桿菌屬細菌和摩氏摩根菌除外)。本研究中10株腸桿菌科細菌對亞胺培南或美羅培南耐藥,其中亞胺培南對5株普通變形桿菌和1株摩氏摩根菌的MIC為4 mg/L,而美羅培南的MIC≤0.06 mg/L;2株肺炎克雷伯菌和2株腸桿菌屬細菌對2種碳青霉烯類抗生素均耐藥,拉氧頭孢對這些菌株的MIC在0.125~4 mg/L敏感范圍內。但拉氧頭孢對腸桿菌科細菌的抗菌活性與阿米卡星、環丙沙星和慶大霉素相仿或略優。
拉氧頭孢對銅綠假單胞菌的抗菌活性明顯較碳青霉烯類、氨基糖苷類及氟喹諾酮類抗菌藥物差。8 mg/L拉氧頭孢只能抑制40.0%銅綠假單胞菌生長,且對鮑曼不動桿菌的抗菌活性較多數受試對照藥為差,但對嗜麥芽窄食單胞菌的抗菌活性較替卡西林-克拉維酸為優;與左氧氟沙星相仿,較米諾環素差。拉氧頭孢對洋蔥伯克霍爾德菌的抗菌活性較頭孢他啶、美羅培南、氟喹諾酮類和米諾環素差,與替卡西林-克拉維酸相仿。
拉氧頭孢對脆弱擬桿菌、梭桿菌屬和消化鏈球菌屬細菌的抗菌活性與頭孢米諾相仿,但對其他擬桿菌屬細菌以及普雷沃菌屬、韋榮球菌屬細菌的抗菌活性較頭孢米諾稍差;拉氧頭孢對厭氧菌的抗菌活性較亞胺培南差。對脆弱擬桿菌等擬桿菌屬細菌的抗菌活性較甲硝唑差,但對普雷沃菌屬、梭桿菌屬、韋榮球菌屬和消化鏈球菌屬細菌的抗菌活性與甲硝唑相仿;對消化鏈球菌屬細菌的抗菌活性優于克林霉素。
討 論
拉氧頭孢是氧頭孢烯類抗生素,為廣譜抗生素,有時亦被歸入第三代頭孢菌素,由于其7-氨基頭孢烷酸上的硫原子被氧原子替代,其化學結構和抗菌譜均有別于第三代頭孢菌素,不但對革蘭陰性菌抗菌活性強,對多數β內酰胺酶穩定,且對脆弱擬桿菌等厭氧菌亦具有良好的抗菌活性[6-9]。
腸桿菌科細菌是臨床重要病原菌,中國CHINET細菌耐藥性監測網最近報道的結果顯示,大腸埃希菌和肺炎克雷伯菌的臨床分離株數居前2位。產β內酰胺酶是腸桿菌科細菌對β內酰胺類抗生素最常見的耐藥機制[10],如今ESBLs在我國臨床分離菌株中廣泛流行,大腸埃希菌中產ESBLs菌株超過50.0%,肺炎克雷伯菌中近40.0%[11]。據文獻報道,我國臨床分離菌所產ESBL以CTX-M型為主,SHV型亦有發現、TEM型少見[12-13]。治療產ESBLs菌感染的首選藥物為碳青霉烯類抗生素。但隨著碳青霉烯類抗生素的廣泛應用,腸桿菌科細菌對碳青霉烯類抗生素的耐藥率逐年升高,給臨床診治帶來嚴重挑戰。本研究發現拉氧頭孢對產ESBLs的菌株仍有良好的抗菌活性,MIC值較低;本品1 mg/L即可抑制大部分產ESBLs菌株的生長。拉氧頭孢對大腸埃希菌、肺炎克雷伯菌、變形桿菌屬細菌、摩氏摩根菌等腸桿菌科細菌,包括產ESBLs大腸埃希菌和肺炎克雷伯菌在內的抗菌活性明顯優于頭孢他啶、頭孢曲松和頭孢吡肟,其MIC90大多是后3種抗菌藥物的1/8到1/256。這與楊青等[13]報道的氧頭孢烯類抗生素對產ESBLs菌株的體外抗菌活性研究的結果一致。
Jacoby等[14]報道腸桿菌屬、枸櫞酸桿菌屬、沙雷菌屬和摩根菌屬細菌常攜帶染色體介導的AmpC酶,其中可能出現去阻遏高產酶菌株。本組資料中有10株產AmpC酶菌株,拉氧頭孢的MIC90為0.125~8 mg/L,其中9株同時產ESBLs。拉氧頭孢對2株產ESBLs和AmpC酶的大腸埃希菌的MIC分別為1 mg/L和16 mg/L,對7株產ESBLs和AmpC酶的肺炎克雷伯菌中6株的MIC為0.25~0.5 mg/L,另1株的MIC為8 mg/L;對1株單產AmpC酶肺炎克雷伯菌的MIC≤0.06 mg/L。提示拉氧頭孢對細菌產生的ESBLs和AmpC酶高度穩定。這與陳東科等[15]2003年的研究發現,拉氧頭孢 對ESBLs(包 括TEM-3、TEM-5、SHV-2、SHV-4、SHV-5)高度穩定,對產ESBLs+AmpC酶菌株的耐藥率低的結果亦相一致。
本組資料顯示,腸桿菌科細菌中10株碳青霉烯類耐藥菌株,其中2株肺炎克雷伯菌、5株普通變形桿菌以及陰溝腸桿菌、產氣腸桿菌和摩氏摩根菌各1株。拉氧頭孢對上述菌株的MIC值(≤8 mg/L)均在敏感范圍內。文獻報道,產碳青霉烯酶是腸桿菌科細菌對碳青霉烯類抗生素耐藥的主要機制[16],但其中變形桿菌屬、摩根菌屬細菌對亞胺培南的耐藥則有其他尚未明確的耐藥機制[3]。因此提示拉氧頭孢可能對耐碳青霉烯類抗生素的腸桿菌科細菌具有抗菌活性,且與碳青霉烯類抗生素無交叉耐藥。
本組資料顯示,拉氧頭孢對脆弱擬桿菌等厭氧菌有一定的抗菌作用,其作用與頭孢米諾相仿或略差,遜于亞胺培南。文獻報道拉氧頭孢對脆弱擬桿菌的抗菌活性優于其他頭孢菌素,對其他厭氧菌的抗菌活性則與頭孢噻肟等第三代頭孢菌素相仿[17-18]。
拉氧頭孢具有抗菌譜廣,對革蘭陰性菌抗菌活性強,對細菌產生的多種β內酰胺酶穩定,血藥濃度高且持續時間長以及腦脊液內藥物濃度高等特點,日本批準用于腸桿菌科細菌、流感嗜血桿菌、擬桿菌屬中敏感菌株引起的血流感染、細菌性腦膜炎、肺炎、肺膿腫、肝膿腫、膽道感染、盆腔感染和腎盂腎炎等。但拉氧頭孢對葡萄球菌屬、肺炎鏈球菌等革蘭陽性球菌抗菌活性差,腸球菌屬細菌對拉氧頭孢天然耐藥,在上述細菌所致感染中不宜采用[19-20]。
[1]Clinical and Laboratory Standards Institute.Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Glow Aerobically[S].Approved Standard-Eighth Edition,2009,M07-A8.
[2]Clinical and Laboratory Standards Institute.Methods for Antimicrobial Susceptibility Testing of Anaerobic Bacteria[S].Approved Standard-Seventh Edition,2007,M11-A7.
[3]Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial Susceptibility Testing[S].Twenty-Second Informational Supplement,2012,M100-S22.
[4]Jones RN,Barry AL,Packer RR,et al.Invitroantimicrobial spectrum,accurrence of synergy,and recommendations for dilution susceptibility testing concentration of the cefoperazone-sulbactam combination[J].J Clin Microbiol,1987,25(9):1725-1729.
[5]Pérez-Pérez FJ,Hanson ND.Detection of plasmid-mediated AmpC beta-lactamase genes in clinical isolates by using multiplex PCR[J].J Clin Microbiol,2002,40(6):2153-2162.
[6]Snepar R,Poporad G,Romano J,et al.Invitroactivity,efficacy,and pharmacology of moxalactam,a new beta-lactam antibiotic[J].Antimicrob Agents Chemother,1981,20(5):642-647.
[7]Reimer LG,Mirrett S,Reller LB.Comparison ofinvitroactivity of moxalactam(LY127935)with cefazolin,amikacin,tobramycin,carbenicillin,piperacillin,and ticarcillin against 420 blood culture isolates[J].Antimicrob Agents Chemother,1980,17(3):412-416.
[8]Lang SD,Edwards DJ,Durack DT.Comparison of cefoperazone,cefotaxime,and moxalactam(LY127935)against aerobic gram-negative bacilli[J].Antimicrob Agents Chemother,1980,17(3):488-493.
[9]張鳳凱,李家泰,潘石,等.拉氧頭孢對臨床分離的1143株致病菌體外抗菌作用的研究[J].中國抗生素雜志,1994,19(3):221-229.
[10]Paterson DL,Bonomo RA.Extended-spectrum beta-lactamases:a clinical update[J].Clin Microbiol Rev,2005,18(4):657-686.
[11]胡付品,朱德妹,汪復,等.2011年中國CHINET細菌耐藥性監測[J].中國感染與化療雜志,2012,12(5):321-329.
[12]Wang P,Hu F,Xiong Z,et al.Susceptibility of extendedspectrum-beta-lactamase-producingEnterobacteriaceaeaccording to the new CLSI breakpoints[J].J Clin Microbiol,2011,49(9):3127-3131.
[13]楊青,陳云波,顧怡明,等.氧頭孢烯類抗生素對產超廣譜β內酰胺酶菌株的體外抗菌活性研究[J].中國抗感染化療雜志,2003,3(6):344-346.
[14]Jacoby GA.AmpC beta-lactamases[J].Clin Microbiol Rev,2009,22(1):161-182.
[15]陳東科,胡云建,張秀珍.舒巴坦與拉氧頭孢配比對產酶菌的體外抗菌活性研究[J].臨床藥物治療雜志,2003,1(4):53-56.
[16]Tzouvelekis LS,Markogiannakis A,Psichogiou M,et al.Carbapenemases inKlebsiellapneumoniaeand otherEnterobacteriaceae:an evolving crisis of global dimensions[J].Clin Microbiol Rev,2012,25(4):682-707.
[17]Edwards R,Greenwood D.An investigation of beta-lactamases from clinical isolates ofBacteroidesspecies[J].J Med Microbiol,1992,36(2):89-95.
[18]Jorgensen JH,Crawford SA,Alexander GA.Comparison of moxalactam(LY127935)and cefotaxime against anaerobic bacteria[J].Antimicrob Agents Chemother,1980,17(5):901-904.
[19]汪復,張嬰元.實用抗感染治療學[M].2版.人民衛生出版社,2012:305-306.
[20]McCracken GH Jr,Threlkeld N,Mize S,et al.Moxalactam therapy for neonatal meningitis due to gram-negative enteric bacilli.A prospective controlled evaluation[J].JAMA,1984,252(11):1427-1432.

