吡格列酮抑制膠原誘導的關節炎大鼠滑膜S100A8/A9 mRNA的表達
黃火高,韓春光,劉永學,郭啟煜
類風濕關節炎(rheumatoid arthritis,RA)是一種累及外周小關節為主的進行性破壞性的慢性自身免疫性炎性疾病。盡管近年對RA機制的進一步認識推動對該病治療的進展,但是目前臨床上仍存在諸多難題,RA的詳盡發病機制仍有待深入研究[1]。過氧化物酶體增殖物活化型受體γ(peroxisome proliferator-activated receptor gamma,PPARγ)是一類配體依賴的核受體。研究表明,激活PPAR γ可調控多種基因表達,并產生抗炎作用[2]。PPAR γ激動劑吡格列酮可顯著抑制膠原誘導的關節炎(collageninduced arthritis,CIA)[3]。S100A8/A9 為一組鈣衛蛋白,是類風濕關節炎中重要炎性介質[4]。本實驗通過大鼠膠原誘導性關節炎(collagen-induced arthritis,CIA)模型,檢測PPARγ激動劑吡格列酮對滑膜表達S100A8/A9 mRNA的影響,以探討 PPARγ在RA中作用及可能機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 Wistar雄性大鼠(200±20)g,由軍事醫學科學院實驗動物中心提供并飼養。
1.1.2 主要試劑 吡格列酮由江蘇恒瑞醫藥股份有限公司惠贈。牛Ⅱ型膠原及不完全弗氏佐劑為美國Sigma產品。總RNA提取試劑TRIzol購自美國Invitrogen。逆轉錄-聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)試劑盒和DL2000 DNA Marker為大連寶生物工程有限公司產品。引物由北京賽百勝生物有限公司合成并純化。
1.2 方法
1.2.1 動物分組和用藥方法 將20只大鼠編號。隨機抽取3只大鼠飼養至首批關節炎大鼠到達實驗終點時作為正常對照組。余下17只大鼠經二次強化免疫后每日依次查看,以發生關節炎時間先后順序再隨機入組,分為模型對照組、吡格列酮用藥大劑量組[20 mg/(kg·d)]和吡格列酶用藥小劑量組[4 mg/(kg·d)],進入實驗的大鼠每組各3只,多余大鼠廢用。將吡格列酮均勻混懸于1%羧甲基纖維素鈉懸液中。吡格列酮用藥組大鼠入組當天開始灌胃給藥,1/d,連續14 d。模型對照組大鼠以同樣方式給予等體積的1%羧甲基纖維素鈉混懸液。
1.2.2 CIA模型誘導 依據本實驗組建立的方法[5]制作制備膠原乳液并誘導CIA模型。簡述如下:大鼠麻醉后,將背部及尾根部去毛,按照每只250 μl皮內多點注射Ⅱ型膠原乳液(4 mg/ml)進行初次免疫,間隔7 d后二次注射強化免疫。
1.2.3 RT-PCR檢測滑膜目的基因mRNA表達二次強化免疫大鼠關節炎發作滿14 d后將大鼠麻醉,打開脛跗關節,沿著骨骼周邊用眼科剪與手術刀片剪切滑膜及其周圍組織,于磷酸鹽緩沖液(phosphate buffered saline,PBS)中快速洗滌1遍后立即轉入裝有1 ml Trizol試劑的組織勻漿器中研磨,以抽提總RNA。檢測獲得的RNA量和純度后以20 μl體系將3 μg的 RNA逆轉錄成 cDNA模板,用于PCR檢測。所用引物序列和PCR條件見表1。除了退火溫度和循環數,反應程式其他部分均相同:94℃預變性2 min進入循環,94℃變性45 s,不同溫度下退火30 s,72℃延伸1 min,循環結束后72℃再延伸5 min,降至4℃。PCR產物于2%瓊脂糖凝膠電泳并成像分析,以美國國立衛生研究院(National Institutes of Health,NIH)開發的軟件ImageJ對產物條帶吸光度值進行計算。結果以“目的基因/甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)”比值表示。

表1 所用引物序列資料及PCR條件
1.3 統計學處理 采用SPSS 17.0統計軟件分析,計量資料以均數±標準差(±s)表示。兩組比較用t檢驗,兩組以上比較用單因素方差分析,后續兩兩比較用最小顯著性差異法(least-significant difference,LSD)檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 CIA 滑膜 PPARγ mRNA表達變化 PPARγ mRNA在正常對照組大鼠滑膜僅極少量表達(0.03±0.01),而在模型對照組大鼠滑膜表達明顯增高(0.14±0.01),兩組比較差異有統計學意義(P<0.01)。
2.2 正常滑膜S100A8 mRNA和S100A9 mRNA固有表達 正常對照組大鼠關節滑膜僅微量表達S100A8 mRNA(0.01±0.01)和S100A9 mRNA(0.20±0.07)。
2.3 關節炎滑膜S100A8 mRNA和S100A9 mRNA的表達及吡格列酮的影響 CIA后14 d模型對照組大鼠滑膜組織表達S100A8 mRNA和S100A9 mRNA顯著增高;吡格列酮小劑量用藥組滑膜表達S100A8 mRNA和S100A9 mRNA明顯低于模型對照組,抑制率分別為62.7%和34.2%;吡格列酮大劑量用藥組滑膜表達S100A8 mRNA和S100A9 mRNA顯著低于模型對照組,抑制率分別為82.1%和71.9%(P<0.01,圖1及表2)。吡格列酮大、小劑量組之間比較,差異有統計學意義(P<0.01)。
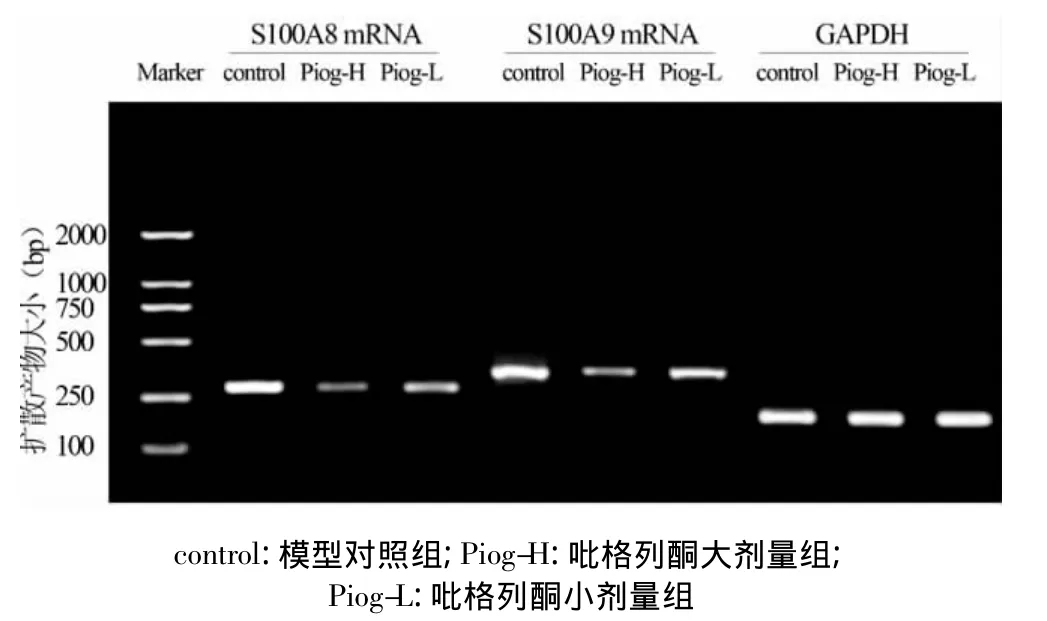
圖1 吡格列酮對滑膜組織S100A8 mRNA和S100A9 mRNA表達的影響
表2 各組大鼠滑膜組織S100A8 mRNA和S100A9 mRNA表達結果(±s)

表2 各組大鼠滑膜組織S100A8 mRNA和S100A9 mRNA表達結果(±s)
注:與模型對照組比較,*P<0.01
組 別S100A8 mRNA S100A9 mRNA模型對照組1.23 ±0.06 1.07 ±0.11吡格列酮小劑量組 0.46 ±0.08* 0.71 ±0.06*吡格列酮大劑量組 0.22 ±0.02* 0.30 ±0.03*
3 討論
S100A8 mRNA和S100A9 mRNA屬于S100家族,主要表達于粒細胞和單核細胞,與髓系細胞分化密切相關[4-6]。研究發現S100A8 mRNA和S100A9 mRNA與滑膜炎的嚴重程度密切相關[4],其中S100A8 mRNA可加重病情并介導RA的骨破壞[6]。
核受體PPAR γ的主要功能是在mRNA水平調控基因的表達;吡格列酮是PPARγ高親和力的配體[2]。本實驗選擇吡格列酮,旨在通過觀察該配體激活PPARγ后目的基因表達的變化,以研究PPARγ激活的效應。PPARγ mRNA在CIA發生14 d后表達明顯增高,為藥物發生作用提供了基礎。本研究結果顯示,吡格列酮明顯抑制S100A8 mRNA和S100A9 mRNA的表達,并存在劑量依賴關系,提示激活PPARγ可抑制炎性趨化物S100A8/A9 mRNA的表達。激活PPARγ本身有促分化特性[2]。巨噬細胞分化成熟后S100A8 mRNA和S100A9 mRNA不再表達[7],吡格列酮抑制 S100A8 mRNA和S100A9 mRNA表達提示其具有促巨噬細胞分化成熟的作用。文獻表明,成熟的巨噬細胞炎性反應明顯減弱,可能是導致某些急性炎癥反應自發緩解重要機制[8]。本小組研究曾發現,吡格列酮可能通過促巨噬細胞成熟而減輕痛風性炎癥[9]。RA滑膜炎癥持續放大而不能自發緩解,提示巨噬細胞功能可能存在異常。本文初步探討了PPARγ激活后對CIA滑膜S100A8/A9 mRNA表達的影響,意在為進一步的研究建立基礎,深入研究PPARγ、S100A8/A9 mRNA以及巨噬細胞分化在RA中的作用,可深化對RA發病機制的認識,為RA治療新藥研究提供新的思路。
總之,PPARγ激動劑吡格列酮可明顯抑制RA模型滑膜S100A8/A9 mRNA的基因表達,其改善RA炎癥的機制可能涉及對巨噬細胞分化的調控。人類RA病程與巨噬細胞的分化的關系、如何更有效改善滑膜巨噬細胞功能以及PPARγ激活后如何實現對S100A8/A9 mRNA的內在調控作用則是需要我們深入認識的新領域。
[1]Asquith DL,Mclnnes IB.Emerging cytokine targets in rheumatoid arthritis[J].Curr Opin Rheumatol,2007,19(3):246-251.
[2]Oates JC,Reilly CM,Crosby MB,et al.Peroxisome proliferator-activated receptor gamma agonists:potential use for treating chronic inflammatory diseases[J].Arthritis Rheum,2002,46(3):598-605.
[3]Cuzzocrea S,Mazzon E,Dugo L,et al.Reduction in the evolution of murine typeⅡcollagen-induced arthritis by treatment with rosiglitazone,a ligand of the peroxisome proliferator-activated receptor gamma[J].Arthritis Rheum,2003,48(12):3544-3556.
[4]Hammer HB,Fagerhol MK,Wien TN,et al.The soluble biomarker calprotectin(an S100 protein)is associated to ultrasonographic synovitis scores and is sensitive to change in patients with rheumatoid arthritis treated with adalimumab[J].Arthritis Res Ther,2011,13(5):R178.
[5]Han C,Huang H,Hu M,et al.Time-dependent expression of leukotriene B4 receptors in rat collagen-induced arthritis[J].Prostaglandins Other Lipid Mediat,2007,83(3):225-230.
[6]Katano M,Okamoto K,Suematsu N,et al.Increased expression of S100 calcium binding protein A8 in GM-CSF-stimulated neutrophils leads to the increased expressions of IL-8 and IL-16[J].Clin Exp Rheumatol,2011,29(5):768-775.
[7]Schweyer S,Hemmerlein B,Radzun HJ,et al.Continuous recruitment,co-expression of tumour necrosis factor-alpha and matrix metalloproteinases,and apoptosis of macrophages in gout tophi[J].Virchows Arch,2000,437(5):534-539.
[8]Landis RC,Yagnik DR,Florey O,et al.Safe disposal of inflammatory monosodium urate monohydrate crystals by differentiated macrophages[J].Arthritis Rheum,2002,46(11):3026-3033.
[9]黃火高,胡明,王建和,等.吡格列酮對大鼠尿酸鈉晶體誘導的炎癥組織細胞中S100A8和S100A9的mRNA表達的影響[J].中國藥理學與毒理學雜志,2007,21(2):113-117.

