重組大腸桿菌表達雙功能谷胱甘肽合成酶的發酵工藝研究
張 松,王德正,李 娓,李志敏,葉 勤
(華東理工大學 生物反應器工程國家重點實驗室,上海200237)
谷胱甘肽(Glutathione,GSH)是一種具有多種重要生理功能的活性三肽,由谷氨酸、半胱氨酸和甘氨酸經肽鍵縮合而成。GSH在維持體內氧化還原平衡、迅速增強機體免疫力、促進消化系統及呼吸系統機能、抗腫瘤等方面發揮著重要作用[1],廣泛應用于醫藥、食品、體育運動等領域。GSH的生物合成分為兩步[2]:第一步,谷氨酸的γ-羧基與半胱氨酸的氨基在γ-谷氨酰半胱氨酸合成酶(GSHⅠ,即γ-GCS)的作用下催化形成肽鍵,合成γ-谷氨酰半胱氨酸;第二步,在谷胱甘肽合成酶(GSHⅡ,即GS)的作用下與甘氨酸反應生成谷胱甘肽。其中GSHⅠ是谷胱甘肽合成的限速酶,受到還原型谷胱甘肽的反饋抑制[3],而谷胱甘肽對GSHⅡ沒有反饋抑制[4]。
最近研究報道,除了GSHⅠ和GSHⅡ外,在某些菌[5,6](如無乳鏈球菌、李斯特氏菌)中還存在另外一種特殊的雙功能谷胱甘肽合成酶(GshF),同時具有GSHⅠ和GSHⅡ的活性,對產物抑制不敏感,在谷胱甘肽生物合成中有著重要的應用價值。目前的研究主要集中在新酶的開發和分子機制方面,未涉及發酵及誘導表達GshF的工藝優化。
作者在此以重組表達嗜熱鏈球菌gshF基因的大腸桿菌BL21為對象,進行了重組菌BL21/pET-gshF 5L罐的發酵研究,分別考察了不同培養基、誘導劑種類、誘導時機、誘導溫度、補料流加碳源類型等因素對菌體生長、GshF蛋白表達及其酶活的影響,擬為GshF在谷胱甘肽生物合成中的應用奠定基礎。
1 實驗
1.1 菌株
重組大腸桿菌BL21/pET-gshF,自行構建;目的基因片段gshF來自嗜熱鏈球菌。
1.2 培養基
種子培養基:含30mg·L-1卡那霉素的LB培養基。
基本 培 養 基 (g·L-1):Na2HPO4·12H2O 15.12,KH2PO43,NH4Cl 3,MgSO4·7H2O 0.5,NaCl 0.5,酵母提取物5。葡萄糖5,115℃單獨滅菌30min;CaCl20.011,單獨滅菌。1%維生素B1用微孔濾膜(0.22μm)過濾除菌,待培養基滅菌冷卻后按0.12mL·L-1的比例加入。微量元素混合溶液(μmol·L-1,FeCl350,CaCl220,MnCl2·4H2O 10,ZnSO4·7H2O 10,CoCl2·6H2O 2,CuCl2·2H2O 2,NiCl2·6H2O 2,Na2MoO4·5H2O 2,Na2SeO3·5H2O 2,H3BO32)用微孔濾膜(0.22μm)過濾除菌,待培養基滅菌冷卻后按0.12mL·L-1的比例加入。
補料培養基Ⅰ(g·L-1):葡萄糖500,MgSO4·7H2O 25。
補料培養基Ⅱ(g·L-1):甘油250,MgSO4·7H2O 25。
自誘導培養基(g·L-1):蛋白胨10,酵母提取物5,Na2HPO47.1,KH2PO46.8,(NH4)2SO46.6,MgSO40.12,甘油20,葡萄糖0.5,乳糖2,琥珀酸鈉4.05,按0.12mL·L-1的比例加入微量元素儲備液。
1.3 培養方法
1.3.1 種子培養
一級種子培養:將-20℃保存的甘油管菌株接種到裝有30mL LB培養基的250mL三角瓶中,加卡那霉素至終濃度為30mg·L-1,于37℃、220r·min-1培養6h。
二級種子培養:將上述種子液按1%接種量接種到裝有125mL LB培養基的500mL三角瓶中,于37℃、220r·min-1培養8h。
1.3.2 分批發酵
將二級種子液按5%接種量接種到裝有2.5L發酵培養基的5L發酵罐(BIOTECH-BG-5型,上海保興生物設備公司)中,于37℃進行分批發酵。用NaOH控制pH值為7.0左右,通氣量為1VVm,調節攪拌轉速控制溶氧在30%以上。
1.3.3 補料分批發酵
發酵罐裝液量為2.5L,接種量為5%,用25%氨水控制pH值為7.0,通氣量為1VVm,調節攪拌轉速保持溶氧在30%以上。初糖耗盡、溶氧跳升后通過指數流加(控制比生長速率0.3h-1)進行補料,分別以葡萄糖和甘油兩種不同碳源流加。在對數生長初期及中后期補加IPTG或者乳糖進行誘導。
1.4 分析方法
1.4.1 還原型谷胱甘肽的含量測定
用HPLC法檢測GSH含量。使用C18色譜柱(4.6mm×150mm),流動相為0.01mol·L-1Na2HPO4和0.05mol·L-1K2HPO4溶液(含0.01mol·L-1庚烷磺酸鈉,pH值3.0)。檢測時流動相和甲醇按95∶5的比例進柱,柱溫30℃,流速0.6mL·min-1。
1.4.2 GshF蛋白定量
按照分子克隆對發酵樣品進行蛋白凝膠電泳,并以蛋白Marker和牛血清蛋白為標準確定目標蛋白GshF的大小和含量[7]。
1.4.3 酶活分析
取1mL菌液,離心收集菌體,加pH值為8.5的0.15mmol·L-1Tris-HCl、0.2mmol·L-1EDTA,0.1mmol·L-1KCl至1mL,在冰浴中超聲破碎后,于12 000r·min-1離心10min;取上清液500μL,加入40mmol·L-1Glu、40mmol·L-1Gly、20mmol·L-1Cys、40mmol·L-1MgCl2、40mmol·L-1ATP,30℃反應30min;加入與反應液等體積的20%三氯乙酸終止反應,然后用HPLC檢測生成的GSH含量。
酶活單位(U)為:每分鐘轉化底物生成1mg GSH的酶量。
比酶活(U·g-1)為:每克GshF蛋白每分鐘轉化底物生成1mg GSH的酶量。
1.4.4 菌體密度的測定
將待測發酵液稀釋至一定濃度后,用紫外分光光度計在600nm波長下測定發酵液的吸光度值。發酵液的細胞密度即為吸光度值與稀釋倍數的乘積。
1.4.5 其它物質的測定
葡萄糖、甘油、乙酸、乳糖、琥珀酸的含量均采用HPLC法檢測[8]。色譜柱為 Aminex HPX-87H,用紫外檢測器和視差折光檢測器檢測;流動相為5mmol·L-1H2SO4,流速0.6mL·min-1,檢測溫度65℃。
2 結果與討論
2.1 自誘導培養基分批培養
分批培養是一種簡單的培養方式,可以初步獲得菌體生長和重組蛋白表達的基本規律,為后續優化提供借鑒,但分批培養后期由于營養物質的消耗,難以實現細胞的高密度培養和蛋白的高表達。Studier[9]在自誘導培養基中培養重組大腸桿菌,目標蛋白得到很好的表達。因此,本研究首先考察37℃時使用自誘導培養基進行分批培養時的菌體生長、營養物質代謝和GshF蛋白表達,結果見圖1。

圖1 分批培養時菌體生長、代謝情況和GshF表達量Fig.1 The cell growth,metabolism and GshF expression in batch culture
由圖1可見,在37℃自誘導培養基中,前8h菌體生長迅速,乙酸積累了1.9g·L-1;培養10h時甘油耗盡,OD600達到最大值18.5,并開始利用積累的乙酸,菌體生長基本停滯;培養10h時GshF表達量達到最大值0.26g·L-1,隨后隨著菌體濃度的減小,出現下降;初始葡萄糖只有0.5g·L-1,因此很快就被完全消耗,過程中基本檢測不到。
2.2 以葡萄糖為碳源流加實驗
補料流加培養是生產重組蛋白最常用的方式,能使基質濃度保持在較低水平,有效地抑制副產物的積累,提高外源蛋白的表達效率。由于自誘導培養基中使用了較多的復合成分,增加了生產成本,因此補料流加工藝以添加少量復合成分的基本培養基(添加酵母提取物的M9培養基)為初始發酵培養基,考察IPTG誘導溫度和誘導時機、乳糖作為碳源和誘導劑時對菌體生長和蛋白誘導表達的影響。
2.2.1 IPTG誘導溫度的影響
采用初始發酵培養基在37℃下進行菌體培養,4.8h開始控制比生長速率為0.3h-1,指數流加補料培養基Ⅰ,10.5h添加0.5mmol·L-1IPTG進行誘導,比較誘導溫度為37℃、30℃時的菌體生長和GshF表達量,結果見圖2。

圖2 IPTG誘導溫度對菌體生長、GshF表達量的影響Fig.2 Effect of induction temperature on cell growth,GshF expression
以添加酵母提取物的M9培養基為初始發酵培養基,并限制性流加葡萄糖的補料分批培養過程中未檢測到殘余葡萄糖和乙酸生成。由圖2可見,37℃進行誘導時,GshF表達量隨著誘導時間的延長而增加,比酶活最大達到74.6U·g-1;30℃誘導時,比酶活最大為70.9U·g-1。表明,誘導溫度對菌體生長和GshF的表達影響不大。
2.2.2 IPTG誘導時機的影響
考慮到過早誘導可能增加表達外源蛋白的代謝負荷而抑制菌體生長,從而影響GshF表達量。因此嘗試推遲誘導劑添加時間,在OD600達到50的時候加入0.5mmol·L-1IPTG 進行誘導。結果發現,添加IPTG誘導后,菌體在最初的2h內保持高速指數生長,之后生長速率減慢,OD600在18h達到最大值96.8,但GshF表達量最高只有2.13g·L-1(表1 )。表明推遲誘導劑添加時間雖然有利于菌體生長,但GshF表達量并沒有顯著提高。

表1 誘導時機對菌體生長、GshF表達量的影響Tab.1 Effect of induction time on cell growth,GshF expression
2.2.3 乳糖誘導的影響
維持初始發酵培養基和流加培養基不變,在9h OD600達到33時停止流加葡萄糖以防止葡萄糖對乳糖誘導的抑制作用,饑餓處理0.5h至葡萄糖完全耗盡,然后恒速(40mL·h-1)流加20%乳糖進行誘導,結果見圖3。

圖3 乳糖誘導對菌體生長、GshF表達量的影響Fig.3 Effect of induction by lactose on cell growth,GshF expression
由圖3可見,雖然乳糖既有誘導作用,又能作為碳源被菌體代謝,但作為碳源,和葡萄糖相比還是難以利用,菌體生長幾乎停止;GshF表達量也遠遠達不到IPTG誘導的效果,最高值僅為0.19g·L-1。這可能是因為,乳糖只有借助于乳糖透酶的作用進入到菌體細胞內,并經過β-乳糖苷酶的作用轉化為異乳糖才會起到誘導劑的作用[10]。雖然乳糖誘導的GshF表達量低,但其比酶活遠遠高于IPTG誘導時的比酶活,在誘導3h時達到最大值359U·g-1,即出現了蛋白含量低、酶活高的現象[11]。原因可能是IPTG誘導產生GshF較乳糖快,使得蛋白來不及正確折疊,從而形成了部分包涵體,導致酶活較低。
2.3 以甘油為碳源流加實驗
葡萄糖作為一種很容易被菌體利用的碳源,能使菌體短時間內大量增殖,但過快的生長速度并不利于外源蛋白的表達,而且葡萄糖過量也容易引起乙酸等代謝物的積累,這對蛋白表達也是不利的。甘油是一種較慢被大腸桿菌利用的碳源,進行甘油補料流加不僅產生較少的副產物乙酸,而且可以實現重組大腸桿菌的高密度發酵,因此初步嘗試在生長階段和誘導階段均流加20%的甘油,結果見圖4。
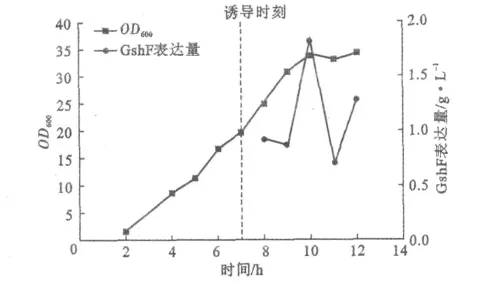
圖4 誘導前后均流加甘油時的菌體生長、GshF表達量Fig.4 Cell growth,GshF expression with glycerol fed before and after induction
由圖4可見,流加甘油,OD600最終達到34.3;在OD600為20時開始誘導表達,GshF表達量在誘導3h后達到最大值1.83g·L-1,隨后出現波動降低。這一方面是由于發酵液中蛋白酶的作用,也與后期菌濃不再增加有關。甘油流加工藝中GshF表達量稍低于葡萄糖流加工藝,且后期菌濃停止增加,不利于繼續提高蛋白表達和保持蛋白活性。
3 結論
在5L發酵罐中培養重組大腸桿菌BL21/pET-gshF,考察了不同培養基、誘導方式和流加碳源對菌體生長、GshF蛋白表達的影響,結果表明:
(1)使用自誘導培養基分批發酵,能夠代替添加IPTG實現GshF蛋白的自發誘導,但表達量較低,培養基成本過高。
(2)以M9培養基加5g·L-1酵母提取物為初始發酵培養基,葡萄糖作為流加碳源并在OD600達到30時加入IPTG誘導,誘導溫度對菌體生長和GshF表達量影響均不大;推遲IPTG誘導時機,菌體生長量大幅提高,但GshF表達量并沒有顯著提高;在使用乳糖作為誘導劑進行誘導時,GshF表達量較低,但比酶活高于IPTG誘導。乳糖成本低,需要進一步優化工藝使其能在保持高酶活的前提下提高蛋白表達量。
(3)以甘油為碳源進行流加培養和蛋白表達,也實現了GshF的高效表達,但后期菌體生長停滯,蛋白降解嚴重,因此甘油作為碳源工藝條件還不成熟,需要進一步探索。
[1]錢小明,吳學豪.還原型谷胱甘肽在急危重癥中的應用[J].中國急救醫學,2003,23(6):411-412.
[2]Blach K C.The synthesis of glutathione in isolated liver[J].Biol Chem,1949,179(3):1245-1254.
[3]Ikner A,Shiozaki K.Yeast signaling pathways in the oxidative stress response[J].Mutat Res,2005,569(1-2):13-27.
[4]毛珍,裘娟萍.酵母菌中谷胱甘肽的主要生理功能及其代謝調控[J].微生物學雜志,2005,25(1):94-96.
[5]Janowiak B E,Griffith O W.Glutathione synthesis in Streptococcus agalactiae.One protein accounts for gamma-glutamylcysteine synthetase and glutathione synthetase activities[J].J Biol Chem,2005,280(12):11829-11839.
[6]Gopal S,Borovok I,Ofer A,et al.A multidomain fusion protein in Listeria monocytogenes catalyzes the two primary activities for glutathione biosynthesis[J].J Bacteriol,2005,187(11):3839-3847.
[7]鄧永康,吳民瀘,劉盛邦,等.乳糖誘導重組尿酸酶基因在大腸桿菌中的表達[J].中國生物工程雜志,2009,29(7):74-79.
[8]Liu Y,Wu H,Li Q,et al.Process development of succinic acid production by Escherichia coli NZN111using acetate as an aerobic carbon source[J].Enzyme and Microbial Technology,2011,49(5):459-464.
[9]Studier F W.Protein production by auto-induction in high density shaking cultures[J].Protein Expression and Purification,2005,41(1):207-234.
[10]楊書慧,趙勝軍,劉軍,等.乳糖誘導甜蛋白Monellin在大腸桿菌中的表達[J].中國生物工程雜志,2008,28(3):53-58.
[11]余永恒,李清雄,王革非.乳糖誘導重組人睫狀神經營養因子在大腸桿菌中的可溶性表達[J].中國生物制品學雜志,2007,20(1):43-46.

