刷狀聚乙二醇兩親性共聚物的合成及其對載藥的影響研究進展
敬小波,申有青
(浙江大學化學工程與生物工程學系,浙江 杭州 310027)
基于刷狀聚乙二醇(PEG)的兩親性共聚物能形成納米顆粒用于改善藥物的水溶性,并能利用通過實體瘤的高通透性和滯留效應(EPR)實現被動靶向腫瘤以提高藥物的藥效,降低毒副作用,因而受到了廣泛的關注和研究[1-4]。PEG是一種線性聚醚,呈電中性,水溶性及生物相容性良好。此外,PEG還具有低的界面自由能和“non-fouling”特性,因而能抑制蛋白吸附,是藥物輸送領域最常用的親水聚合物[5-6]。刷狀PEG兩親性共聚物是以PEG鏈為側鏈且含有疏水鏈段的共聚物,與相同組成的直鏈PEG共聚物相比,刷狀PEG空間結構小而緊湊,其載藥納米系統具有獨特的體內外性能[7-8]。此外,刷狀結構還提供了多樣化的立體結構和組成,并可獲得其它功能,如pH響應功能[9]和溫度響應功能[10]。
本文主要介紹刷狀 PEG兩親性共聚物的合成及刷狀 PEG結構對共聚物納米顆粒載藥性能的影響,并側重于刷狀PEG與生物可降解的聚酯等形成的兩親性共聚物。
1 刷狀PEG兩親性共聚物的合成
如圖1所示,根據PEG的接枝點、主鏈和側鏈的產生方式,合成刷狀PEG兩親性共聚物的方法主要分為大分子單體法(grafting through)和主鏈-側鏈偶聯法(grafting onto)[11-12]。這兩種策略均能應用到多種合成技術(如離子聚合、自由基聚合、開環聚合及各種耦合反應),在控制刷狀PEG共聚物的結構參數(如化學組成、PEG密度、主鏈及PEG側鏈長度等)方面各有優缺點[13]。
1.1 大分子單體法
大分子單體法是首先合成帶可聚合基團的大分子單體,再聚合得到聚合物主鏈。該方法的優點在于側鏈的分子量和分布在聚合前就得到了控制。該方法可以實現100%的接枝率,但是由于位阻作用,聚合物的主鏈聚合度(即側鏈重復單元數)大多不高[7]。用于制備刷狀PEG共聚物的大分子單體有的可以直接購買到(如PEGMA),而大多數含特定端基或 PEG鏈長的大分子單體需要在實驗室合成。圖2為常見的PEG單體[8],陰(陽)離子聚合、傳統或可控自由基聚合及開環聚合等聚合方法均可以制備刷狀PEG共聚物。

圖1 刷狀PEG兩親性共聚物的合成方法

圖2 常見的PEG大分子單體
1.1.1 自由基聚合(FRP)
FRP是引發 PEG大分子單體聚合得到刷狀PEG共聚物的常用方法,反應溫度通常在 40~80 ℃,常用的引發劑有偶氮類(AIBN和VA- 044)和過氧類(如Na2S2O8和BPO)[8]。該方法的優點是反應條件溫和,且適用的單體和溶劑范圍很廣。應用自由基聚合法可引發多種單體聚合得到各種無規共聚物。如圖3所示,作者課題組報道了疏水鏈為聚己內酯(PCL)、親水鏈為PEG的刷狀共聚物。實驗發現所得的兩親性刷狀共聚物的CMC比相同組成的直鏈PEG-b-PCL小近10倍,形成的膠束在稀釋條件下有更高的穩定性[14]。
1.1.2 原子轉移自由基聚合(ATRP)
ATRP是以低價過渡態金屬絡合物催化可逆的鹵原子轉移的可控活性自由基聚合,常用配體為聯吡啶(bpy)、五甲基二乙烯三胺(PMADETA)等。與傳統離子活性聚合不同,ATRP法適用的單體范圍廣、催化劑等原料便宜易得、反應不受水等因素影響且條件溫和,非常適合生物應用的聚合物的合成[15]。應用小分子或大分子鹵化物為引發劑,可合成各種刷狀共聚物結構。如圖4(a)所示,本文作者用末端帶溴的聚己內酯引發PEGMA聚合,得到近單分散性的刷狀共聚物 PCL-pPEGMA。此外,還可以使用多種單體共聚得到多功能性的刷狀共聚物[9,16]。

圖3 大分子單體法通過FRP合成刷狀PEG共聚物
1.1.3 可逆加成斷裂鏈轉移聚合(RAFT)
RAFT是可控活性自由基聚合的一種,能方便地制備多樣化的規整共聚物[17-18]。RAFT聚合是通過鏈轉移過程進行的,所以需要添加鏈轉移劑(CTA)。RAFT聚合能夠制備主鏈聚合度高、分散性好的刷狀PEG共聚物。如圖4(b)所示,Davis等[6]應用RAFT法合成分子量高且分布很窄的刷狀PEG共聚物,通過酰胺鍵與蛋白(溶解酵素)相連,比較了不同結構共聚物對蛋白的保護作用。
1.1.4 開環聚合(ROP)
ROP是指環狀單體在引發劑作用下逐步開環轉變為線性聚合物的反應,一般情況下反應條件溫和。通過ROP得到刷狀PEG共聚物,通常先將PEG連接在環狀化合物上形成大分子單體,而這些環狀化合物多為極性較大的雜環。但由于大分子側鏈的空間位阻,使得其側鏈重復單元數不高。如圖5(a)所示,Wang等[19]先應用Al(OiPr)3引發己內酯(CL)聚合得到聚己內酯(PCL),再引發連接磷酸酯環的PEG單體聚合,得到PCL-b-PPEG刷狀聚合物,但其聚合度很低(DP,約4~6),而單體利用率也很低(約12%~15%)。

圖4 大分子單體法通過ATRP和RAFT合成刷狀PEG共聚物

圖5 大分子單體法通過ROP和ROMP合成刷狀PEG共聚物
大分子單體法制備刷狀 PEG共聚物的聚合方法還很多,如(活性)陰離子聚合、基團轉移聚合(GTP)[20]、自由游離基聚合(FRP)[8]、氮氧自由基調控聚合(NMP)[21]等。
1.1.5 開環異位聚合(ROMP)
ROMP是指由釕等金屬絡合物催化環烯烴聚合的方法,可得到結構規整、組成可控及近單分散性的聚合物[22]。該方法有兩大優勢:一是側鏈上大環狀單體產生的空間為鏈增長反應提供了便利;二是大環的張力為聚合提供了熱力學動力[13]。它與點擊化學等方法結合,可以制備多種刷狀PEG共聚物,且具有良好的生物相容性。如圖5(b)所示,Fontaine等[23]先應用端炔基與疊氮的點擊反應得到氧雜降冰片烯(ONB)偶聯的PEG大分子單體,然后應用ROMP法得到聚合度較高、分子量分布窄的PONB-g-PEG刷狀共聚物。
1.2 主鏈-側鏈偶聯法
偶聯法,即通過化學反應將PEG大分子直接連接到另一聚合物主鏈上。與大分子單體法不同,該方法首先分別合成聚合物主鏈和PEG側鏈,并分別帶有相對應的反應基團。在一定條件下,主鏈的一系列官能團和 PEG側鏈發生偶聯反應,得到刷狀PEG共聚物。該方法中,共聚物的接枝率易受側鏈結構的影響,而短鏈PEG位阻相對較小,接枝率通常較高。
合成偶聯法所需聚合物主鏈的方法很多,和大分子單體聚合類似,帶活性基團的聚合物主鏈也可以通過小分子的離子聚合、自由基聚合等聚合制備[24-25]。以聚酯為主鏈的PEG刷兩親共聚物主要是首先通過相應單體的聚合得到側鏈含活性基團的聚合物主鏈,再通過耦合反應接枝PEG側鏈。這些疏水的聚合物主鏈主要有聚己內酯、聚乳酸、聚碳酸酯及聚磷酸酯等[26-28]。如圖6(a)所示,Emrick等[29]合成了α-炔丙基-δ-戊內酯,利用 ROP得到側鏈含炔丙基的聚戊內酯,再通過端炔基-疊氮點擊反應引入PEG側鏈;如圖6(b)所示,Rieger等[30]合成了γ-丙烯酰氧基-ε-己內酯,通過類似步驟得到聚酯后,經巰基-烯點擊反應與PEG-SH偶聯,這兩種方法都得到了接枝率及主鏈聚合度高的刷狀PEG共聚物。
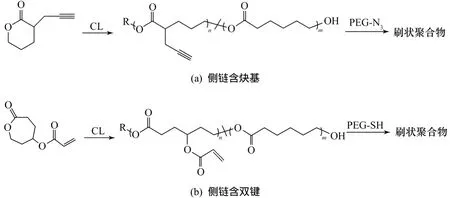
圖6 側鏈含炔基和雙鍵的聚酯通過偶聯法得到刷狀PEG共聚物

圖7 (PCL-PAEP)-g-PEG共聚物的合成途徑

圖8 常用偶聯方法
磷酸酯(polyphosphoester)有良好的細胞親和性和生物相容性,是一類近年來發展很快的生物可降解材料[31]。如圖7所示,首先合成了含丙烯基的環狀磷酸酯單體(AEP),然后在辛酸亞錫催化下采用PCL—OH引發開環聚合,得到側鏈含有烯丙基的兩嵌段共聚物。最后采用末端含巰基的PEG與雙鍵進行巰基-烯點擊化學反應,得到刷狀共聚物PCL-b-(PAEP-g-PEG),經核磁表征雙鍵峰完全消失,接枝率達到 100%。該聚合物結構可控,分子量分布較窄,且具有良好的生物相容性和緩釋能力。
主鏈和側鏈的偶聯除了通過上述介紹的點擊反應(圖 8)實現之外,還可以通過酯化或酰胺化反應等實現,但反應條件更為苛刻,且接枝率難以達到100%[32]。
2 刷狀 PEG結構對納米顆粒載藥性能的影響
兩親性共聚物在選擇性溶劑中的濃度大于臨界聚集濃度(CAC)時,決定于其結構和親水段所占比例,能自組裝形成球型、棒型以及囊泡等聚集體[33-35]。這些納米結構主要通過物理包埋和化學鍵合兩種方法載藥:化學鍵合法制備過程較復雜,只適用于含活潑基團的藥物,且可能導致藥物的變性;而物理包埋法操作簡單,不會改變藥物性質和化學結構,不需要聚合物載體及藥物帶活性基團,是目前制備載藥納米系統最常用的方法。刷狀PEG兩親性共聚物有多樣化的立體結構和組成,可以得到各種含獨特性能的載藥納米體系。
聚合物膠束等載藥體系能通過 EPR效應從腫瘤組織超通透的毛細血管中滲透進入腫瘤并富集,這就需要它們在體內有長的循環時間,從而得到更高的藥物利用率和療效[36]。表面疏水性較強或者帶電荷的納米顆粒在體內循環時會與血液中的蛋白發生非特異性結合,從而被網狀內皮系統(RES)的巨噬細胞識別并吞噬、清除[2,37]。納米顆粒的PEG外殼可以在表面形成致密水合層,通過排斥作用減少蛋白對載藥顆粒表面的粘附,顯著減少巨噬細胞的識別和攝取,使其在血液循環中“隱身”,從而延長體內循環時間,這被稱為 PEG的“nonfouling”特性[38-39]。PEG外殼的鏈段長度和密度都會影響水合層的形成及其對蛋白的排斥作用[40]。如圖9所示,以載藥膠束為例,在總的 PEG鏈長相同時,刷狀PEG共聚物形成的納米顆粒空間結構小而緊湊,表面 PEG密度相對更大,從而能更有效減少蛋白吸附、降低血液清除速率[8,40-41]。如 Hildgen等[42-43]分別合成連接聚乳酸的直鏈 PEG共聚物和刷狀PEG共聚物,通過體內外實驗發現刷狀 PEG共聚物能更有效地抑制蛋白的吸附及巨噬細胞的吞噬,延長體內循環時間。
載藥納米顆粒通過 EPR效應在腫瘤組織中富集,并通過細胞內吞作用進入癌細胞,進而釋放藥物產生療效。所以,癌細胞對載藥納米顆粒的攝取速度對于提高藥效和藥物利用率也非常重要,但是通常難以同時得到慢的血液清除速率和快的癌細胞攝取速率[44]。對于含 PEG親水外殼的載藥納米顆粒,癌細胞的攝取速度主要取決于載藥顆粒的尺寸、形態及表面結構[45]。與直鏈PEG共聚物相比,刷狀PEG共聚物納米顆粒的結構更復雜多變,在一些情況下能提高癌細胞的攝取速度[46]。如 Zhao等[47]合成連接聚己內酯的刷狀PEG共聚物,在水中自組裝形成載阿霉素的蠕蟲狀納米顆粒,其細胞攝取速率比同組成的直鏈共聚物膠束有很大提高,但是文章中并沒有血漿清除速率比較。

圖9 直鏈和刷狀PEG兩親性共聚物形成載藥膠束對比
3 結 語
刷狀 PEG兩親性共聚物在生物醫藥等領域有著良好的應用前景,受到國內外研究者的廣泛關注。大分子單體法和主鏈-側鏈偶聯法是得到刷狀 PEG共聚物的主要途徑,主要通過可控活性聚合、開環聚合及點擊化學等合成方法實現。結構規整的刷狀PEG兩親性共聚物具有獨特的體內外性能,能降低血漿清除速率,從而提高藥物利用率和藥效,但更多的合成方法及體內外性能還需進一步探索和研究。
[1]Deng C,Jiang Y J,Cheng R,et al. Biodegradable polymeric micelles for targeted and controlled anticancer drug delivery:Promises,progress and prospects[J]. Nano Today,2012,7(5):467-480.
[2]Nicolas J,Mura S,Brambilla D,et al. Design,functionalization strategies and biomedical applications of targeted biodegradable/biocompatible polymer-based nanocarriers for drug delivery[J]. Chemical Society Reviews,2013,42(3):1147-1235.
[3]Mikhail A S,Allen C. Block copolymer micelles for delivery of cancer therapy:Transport at the whole body,tissue and cellular levels[J]. Journal of Controlled Release,2009,138(3):214-223.
[4]Ding H,Wang X J,Zhang S,et al. Applications of polymeric micelles with tumor targeted in chemotherapy[J]. Journal of Nanoparticle Research,2012,14(11):1254.
[5]Kwon G S,Kataoka K. Block copolymer micelles as long-circulating drug vehicles[J]. Advanced Drug Delivery Reviews,2012,64:237-245.
[6]Liu Y K,Li M,Wang D X,et al. PolyPEGylation of protein using semitelechelic and mid-functional poly(PEGMA)s synthesized by RAFT polymerization[J]. Australian Journal of Chemistry,2011,64(12):1602-1610.
[7]Lee H I,Pietrasik J,Sheiko S S,et al. Stimuli-responsive molecular brushes[J]. Progress in Polymer Science,2010,35(1-2):24-44.
[8]Neugebauer D. Graft copolymers with poly(ethylene oxide)segments[J]. Polymer International,2007,56(12):1469-1498.
[9]Shen Y Q,Zhan Y H,Tang J B,et al. Multifunctioning pH-responsive nanoparticles from hierarchical self-assembly of polymer brush for cancer drug delivery[J]. AIChE Journal,2008,54(11):2979-2989.
[10]Lutz J F,Hoth A. Preparation of ideal PEG analogues with a tunable thermosensitivity by controlled radical copolymerization of 2-(2-methoxyethoxy)ethyl methacrylate and oligo(ethylene glycol)methacrylate[J]. Macromolecules,2006,39(2):893-896.
[11]Chen YM. Shaped hairy polymer nanoobjects[J]. Macromolecules,2012,45(6):2619-2631.
[12]Azzaroni O. Polymer brushes here,there,and everywhere:Recent advances in their practical applications and emerging opportunities in multiple research fields[J]. Journal of Polymer Science Part A:Polymer Chemistry,2012,50(16):3225-3258.
[13]Sheiko S S,Sumerlin B S,Matyjaszewski K. Cylindrical molecular brushes:Synthesis,characterization,and properties[J]. Progress in Polymer Science,2008,33(7):759-785.
[14]Xu P S,Tang H D,Li S Y,et al. Enhanced stability of core-surface cross-linked micelles fabricated from amphiphilic brush copolymers[J]. Biomacromolecules,2004,5(5):1736-1744.
[15]Siegwart D J,Oh J K,Matyjaszewski K. ATRP in the design of functional materials for biomedical applications[J]. Progress in Polymer Science,2012,37(1):18-37.
[16]Barbey R,Lavanant L,Paripovic D,et al. Polymer brushes via surface-initiated controlled radical polymerization:Synthesis,characterization,properties,and applications[J]. Chemical Reviews,2009,109(11):5437-5527.
[17]Moad G. The emergence of RAFT polymerization[J]. Australian Journal of Chemistry,2006,59(10):661-662.
[18]Boyer C,Bulmus V,Davis T P,et al. Bioapplications of RAFT polymerization[J]. Chemical Reviews,2009,109(11):5402-5436.
[19]Du J Z,Chen D P,Wang Y C,et al. Synthesis and micellization of amphiphilic brush-coil block copolymer based on poly(epsilon-caprolactone) and PEGylated polyphosphoester[J].Biomacromolecules,2006,7(6):1898-1903.
[20]Hadjiyannakou S C,Vamvakaki M,Patrickios C S. Synthesis,characterization and evaluation of amphiphilic diblock copolymer emulsifiers based on methoxy hexa(ethylene glycol) methacrylate and benzyl methacrylate[J]. Polymer,2004,45(11):3681-3692.
[21]Andruzzi L,Senaratne W,Hexemer A,et al. Oligo(ethylene glycol) containing polymer brushes as bioselective surfaces[J].Langmuir,2005,21(6):2495-2504.
[22]Johnson J A,Lu Y Y,Burts A O,et al. Drug-loaded,bivalent-bottle-brush polymers by graft-through ROMP[J].Macromolecules,2010,43(24):10326-10335.
[23]Le D,Montembault V,Soutif J C,et al. Synthesis of well-defined omega-Oxanorbornenyl Poly(ethylene oxide) macromonomers via click chemistry and their ring-opening metathesis polymerization[J].Macromolecules,2010,43(13):5611-5617.
[24]Zhang K,Lackey M A,Wu Y,et al. Universal cyclic polymer templates[J]. Journal of the American Chemical Society,2011,133(18):6906-6909.
[25]Gao H F,Matyjaszewski K. Synthesis of molecular brushes by“grafting onto” method:Combination of ATRP and click reactions[J].Journal of the American Chemical Society,2007,129(20):6633-6639.
[26]Bakkour Y,Lackey M A,Wu Y,et al. Brush-like amphiphilic copolymers based on polylactide and poly(ethylene glycol):Synthesis,self-assembly and evaluation as drug carrier[J].Polymer,2013,54(7):1746-1754.
[27]Zhao X.Y,Poon Z,Engler A C,et al. Enhanced stability of polymeric micelles based on postfunctionalized poly(ethylene glycol)-b-poly(gamma-propargyl L-glutamate):The substituent effect[J]. Biomacromolecules,2012,13(5):315-1322.
[28]Zhang K,Wang Y,Zhu W P,et al. Synthesis,characterization,and micellization of PCL-g-PEG copolymers by combination of ROP and "Click" chemistry via “Graft onto” method[J]. Journal of Polymer Science Part A:Polymer Chemistry,2012,50(10):2045-2052.
[29]Parrish B,Breitenkamp R B,Emrick T. PEG- and peptide-grafted aliphatic polyesters by click chemistry[J]. Journal of the American Chemical Society,2005,127(20):7404-7410.
[30]Rieger J,Van Butsele K,Lecomte P,et al. Versatile functionalization and grafting of poly(epsilon-caprolactone) by Michael-type addition[J]. Chemical Communications,2005(2):274-276.
[31]Wang Y C,Yuan Y Y,Du J Z,et al. Recent progress in polyphosphoesters:From controlled synthesis to biomedical applications[J]. Macromolecular Bioscience,2009,9(12):1154-1164.
[32]Huang S W,Zhuo R X. Recent advances in polyphosphoester and polyphosphoramidate-based biomaterials[J]. Phosphorus Sulfur and Silicon and the Related Elements,2008,183(2-3):340-348.
[33]Moffitt M,Khougaz K,Eisenberg A. Micellization of ionic block copolymers[J]. Accounts of Chemical Research,1996,29(2):95-102.
[34]Rapoport N. Physical stimuli-responsive polymeric micelles for anti-cancer drug delivery[J]. Progress in Polymer Science,2007,32(8-9):962-990.
[35]Blanazs A,Armes S P,Ryan A J. Self-assembled block copolymer aggregates:From micelles to vesicles and their biological applications[J]. Macromolecular Rapid Communications,2009,30(4-5):267-277.
[36]Sun Q H,Radosz M,Shen Y Q. Challenges in design of translational nanocarriers[J]. Journal of Controlled Release,2012,164(2):156-169.
[37]Owens D E,Peppas N A. Opsonization,biodistribution,and pharmacokinetics of polymeric nanoparticles[J]. International Journal of Pharmaceutics,2006,307(1):93-102.
[38]Photos P J,Bacakova L,Discher B,et al. Polymer vesicles in vivo:correlations with PEG molecular weight[J]. Journal of Controlled Release,2003,90(3):323-334.
[39]Gabizon A A. Stealth liposomes and tumor targeting:One step further in the quest for the magic bullet[J]. Clinical Cancer Research,2001,7(2):223-225.
[40]Norde W. Surface modifications to influence adhesion of biological cells and adsorption of globular proteins[J]. Surface Chemistry in Biomedical and Environmental Science,2006,228:159-176.
[41]Qiu L Y,Bae Y H. Polymer architecture and drug delivery[J].Pharmaceutical Research,2006,23(1):1-30.
[42]Sant S,Poulin S,Hildgen P. Effect of polymer architecture on surface properties,plasma protein adsorption,and cellular interactions of pegylated nanoparticles[J]. Journal of Biomedical Materials Research Part A,2008,87A(4):885-895.
[43]Essa S,Rabanel J M,Hildgen P. Characterization of rhodamine loaded PEG-g-PLA nanoparticles (NPs):Effect of poly(ethylene glycol) grafting density[J]. International Journal of Pharmaceutics,2011,411(1-2):178-187.
[44]Cuong N V,Hsieh M F,Chen Y T,et al. Synthesis and characterization of PEG-PCL-PEG triblock copolymers as carriers of doxorubicin for the treatment of breast cancer[J]. Journal of Applied Polymer Science,2010,117(6):3694-3703.
[45]Hu Y,Xie J W,Tong Y W,et al. Effect of PEG conformation and particle size on the cellular uptake efficiency of nanoparticles with the HepG2 cells[J]. Journal of Controlled Release,2007,118(1):7-17.
[46]Wu Q G,Du F,Luo Y,et al. Poly(ethylene glycol)shell-sheddable nanomicelle prodrug of camptothecin with enhanced cellular uptake[J]. Colloids and Surfaces B-Biointerfaces,2013,105:294-302.
[47]Zhao P,Liu L X,Feng X Q,et al. Molecular nanoworm with PCL core and PEO shell as a non-spherical carrier for drug delivery[J].Macromolecular Rapid Communications,2012,33(16):1351-1355.

