異丙酚對糖尿病大鼠缺血再灌注心肌NF-κB、TNF-α 和 IL-6的影響
王紅杰 張建新 解麗君 劉芳 蘇紅 蘇小華
心肌缺血再灌注損傷是多因素導致的病理過程,存在多種信號轉導途徑且有交互作用(cross-talk),其中,炎性反應貫穿于心肌缺血再灌注損傷的全過程[1]。研究表明,高血糖和氧化應激的主要靶點是核轉錄因子NF-κB,并通過其調控與炎癥、細胞增殖、細胞分化等密切相關的多種基因的表達[2]。NF-κB也存在于心肌細胞中,它的活化及其調控的一系列信號分子的表達在心肌缺血再灌注損傷中發(fā)揮了關鍵性的作用[3,4]。靜脈麻醉藥異丙酚通過抑制再灌注誘發(fā)的炎性反應可減輕心肌缺血再灌注損傷[5],但其對糖尿病大鼠心肌缺血再灌注時炎性反應的影響尚不明確。本研究擬通過觀察異丙酚對糖尿病大鼠心肌缺血再灌注時心肌細胞內NF-κB活性及其下游的炎性因子的影響,探討異丙酚對糖尿病心肌保護作用機制。
1 材料與方法
1.1 糖尿病模型的制備 健康雄性SD大鼠100只,體重230~280 g,隨機分為糖尿病組76只和非糖尿病組24只。禁食12 h,糖尿病組腹腔注射鏈脲佐菌素(streptozotocin,STZ)55 mg/kg,72 h后剪尾尖采血測定血糖,以后每周測血糖,連續(xù)3周血糖≥16.7 mmol/L為糖尿病大鼠(76只大鼠造模成功60只);非糖尿病大鼠腹腔注射等量緩沖液。
1.2 心肌缺血再灌注損傷模型制備 10%水合氯醛350 mg/kg腹腔注射麻醉,氣管插管,機械通氣,經右側頸總動脈插管,由 Powerlab/30八通道生理記錄儀同時記錄心率(HR)、平均動脈壓(MAP)。左側頸內靜脈插管,靜脈輸注異丙酚。結扎左冠狀動脈前降支30 min,再灌注120 min,制成心肌缺血再灌注損傷模型。
1.3 動物分組與給藥 24只非糖尿病大鼠隨機分為假手術組(Ⅰ組)和缺血再灌注組(Ⅱ組),60只糖尿病大鼠隨機分為假手術組(Ⅲ組)、缺血再灌注組(Ⅳ組)、異丙酚低(Ⅴ組)、中(Ⅵ組)、高(Ⅶ組)劑量組,每組12只,Ⅴ組、Ⅵ組、Ⅶ組分別從缺血前 10 min 開始持續(xù)靜脈滴注異丙酚 3、6、12 mg·kg-1·h-1,Ⅰ~Ⅳ組靜脈輸注等量的0.9%氯化鈉溶液。
1.4 主要試劑與儀器 異丙酚(批號0701221,四川蜀樂藥業(yè)股份有限公司),鏈脲佐菌素(STZ,Sigma公司,美國),鼠NF-κB p65單克隆抗體(美國 Santa Cruz公司),鼠血清及組織TNF-α、IL-6 ELISA檢測試劑盒(美國R&D公司),SP免疫組化檢測試劑盒和DAB顯色試劑盒(北京中杉金橋公司);One-Tonch血糖儀及One-Tonch血糖試紙(LifeScan公司,美國),八通道生理記錄儀Powerlab/8s(澳大利亞 AD Instrument公司),凝膠掃描分析系統(tǒng)BIO-PROFIF(法國VL公司),酶標儀Multiskan Ascent V1.24(芬蘭雷勃公司),顯微鏡Olympus BX40(日本Olympus光學株式會社)等。
1.5 觀察指標
1.5.1 血流動力學指標:分別于缺血前、缺血30 min、再灌注120 min記錄HR、MAP,并計算血壓-心率指數(血壓×心率)。
1.5.2 血清TNF-α、IL-6含量測定:再灌注120 min后,右頸動脈取血,雙抗體夾心ELISA法檢測血清中TNF-α、IL-6含量。具體步驟嚴格按試劑盒說明書操作,酶標儀450 nm處測定OD值,繪制標準曲線,計算樣品中TNF-α、IL-6含量。
1.5.3 心肌組織中TNF-α、IL-6含量測定:再灌注120 min時取左心室前壁組織約100 mg,冰水浴中用0.9%氯化鈉溶液制成10%勻漿,3 000 r/min離心10 min,取上清,雙抗體夾心ELISA法檢測心肌組織中TNF-α、IL-6含量。具體步驟嚴格按試劑盒說明書操作,酶標儀450 nm處測定OD值,繪制標準曲線,計算樣品中TNF-α、IL-6含量。
1.5.4 免疫組化染色觀察心肌組織NF-κB的表達:采用SABC(鏈酶親和素-過氧化物酶)法對心肌石蠟切片進行免疫組化染色,一抗為鼠抗NF-κB p65單克隆抗體,二抗為生物素化羊抗小鼠IgG,以0.1 mmol/L磷酸鹽緩沖液(PBS)代替一抗作陰性對照。NF-κB p65的陽性表達呈棕黃色顆粒,位于胞漿和胞核。每張切片取10個高倍視野,計數胞核陽性表達細胞數。
1.5.5 Westernblotting檢測心肌組織NF-κB的表達:提取心肌組織核蛋白并進行Westernblotting分析,陽性區(qū)域顯深棕色。拍攝濾膜照片,并通過凝膠成像系統(tǒng)掃描,確定雜交條帶的相對灰度值。
1.6 統(tǒng)計學分析 應用SPSS13.0統(tǒng)計軟件,計量資料以±s表示,組間比較采用單因素方差分析(One-Way ANOVA),P<0.05為差異有統(tǒng)學意義。
2 結果
2.1 血糖及體重的變化 腹腔注射STZ后72 h時Ⅲ組~Ⅶ組出現多飲、多食和多尿等癥狀,且隨機血糖≥16.7 mmol/L。與基礎值比較,腹腔注射STZ后3周時Ⅲ組~Ⅶ組隨機血糖升高,體重降低,Ⅰ組和Ⅱ組體重增加(P<0.05或<0.01),隨機血糖差異無統(tǒng)計學意義(P>0.05);與Ⅰ組和Ⅱ組比較,腹腔注射STZ后3周時Ⅲ組~Ⅶ組隨機血糖升高,體重降低(P<0.01),Ⅲ組~Ⅶ組間隨機血糖和體重差異無統(tǒng)計學意義(P>0.05)。見表1。
表1 7組隨機血糖及體重比較n=12,±s

表1 7組隨機血糖及體重比較n=12,±s
注:與基礎值比較,*P <0.05,#P <0.01;與Ⅰ組比較,△P <0.01;與Ⅱ組比較,☆P <0.01
組別 隨機血糖(mmol/L)體重(g)基礎值 腹腔注射STZ后3周 基礎值 腹腔注射STZ后3周Ⅰ組 4.4±0.9 4.6±0.8 249±14 308±51#Ⅱ組 4.6±1.2 4.8±0.9 246±12 307±36#Ⅲ組 4.6±0.7 25.3±4.8#△☆ 254±14 223±40*△☆Ⅳ組 4.8±0.8 24.2±5.4#△☆ 251±16 220±35*△☆Ⅴ組 4.5±1.1 24.8±4.7#△☆ 247±13 223±26*△☆Ⅵ組 4.4±1.0 25.1±4.2#△☆ 251±15 218±27#△☆Ⅶ組 4.7±1.3 25.3±5.1#△☆ 248±14 222±24*△☆
2.2 血流動力學變化 缺血前糖尿病5組大鼠HR、MAP及血壓-心率指數均低于非糖尿病組(P<0.05或<0.01)。分別與Ⅰ組和Ⅲ組相比,缺血再灌注后Ⅱ和Ⅳ、Ⅴ、Ⅵ、Ⅶ組大鼠的HR、MAP、血壓-心率指數均呈進行性下降(P<0.01),糖尿病各組上述指標變化更加顯著(P<0.05或<0.01)。Ⅵ組和Ⅶ組在缺血再灌注120 min時HR、MAP和血壓-心率指數明顯高于Ⅳ組(P<0.05或<0.01)且隨劑量升高呈量效關系。見表2。
表2 7組HR、MAP和血壓-心率指數比較n=12,±s

表2 7組HR、MAP和血壓-心率指數比較n=12,±s
注:與Ⅰ組比較,*P <0.05,#P <0.01;與Ⅱ組比較,△P <0.05,☆P <0.01;與Ⅲ組比較,▲P <0.01;與Ⅳ組比較,★P <0.05,■P <0.01
組別 HR(次/min) MAP(mm Hg) 心率-血壓指數(mm Hg×次/min)375±47 89.2±7.5 38.6±7.1Ⅱ組 326±46# 73.2±6.9* 26.8±2.3#Ⅲ組 324±44# 77.3±4.8 28.2±6.6Ⅳ組 253±53☆▲ 61.7±3.9☆▲ 19.1±4.6☆▲Ⅴ組 280±38 65.0±4.4 22.6±5.8Ⅵ組 292±27★ 67.4±2.7★ 25.1±4.9★Ⅶ組 314±26■ 71.4±5.0■ 26.4±3.9Ⅰ組■
2.3 血清中TNF-α、IL-6含量變化 分別與Ⅰ組和Ⅲ組相比較,Ⅱ組和Ⅳ組大鼠血清中TNF-α、IL-6含量分別明顯升高,Ⅲ組和Ⅳ組上述指標分別明顯高于Ⅰ組和Ⅱ組,Ⅵ組和Ⅶ組TNF-α、IL-6含量明顯低于Ⅳ組(P <0.05或<0.01)。見表3。
2.4 心肌組織TNF-α、IL-6含量的變化 Ⅱ組和Ⅳ組大鼠心肌組織TNF-α、IL-6含量分別明顯高于Ⅰ組和Ⅲ組,其中Ⅳ組較Ⅱ組變化顯著,與Ⅳ組比較,Ⅵ組和Ⅶ組大鼠心肌組織TNF-α含量明顯降低(P<0.05或<0.01)。見表3。
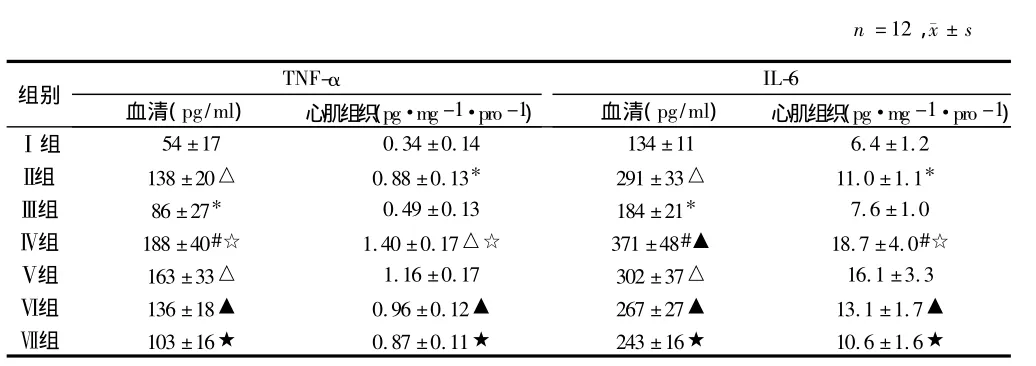
表3 7組血清、心肌組織TNF-α、IL-6含量的變化
2.5 心肌組織中NF-κB表達的變化 免疫組化結果顯示,Ⅰ組和Ⅲ組大鼠心肌組織中NF-κB呈低表達狀態(tài),且陽性表達出現在胞漿中;而Ⅱ組和Ⅳ組NF-κB活化,表達增強,陽性顆粒出現在胞漿和胞核,出現了核移位。Ⅵ組和Ⅶ組,NF-κB表達活性較Ⅳ組低,胞核陽性表達數明顯減少(P<0.05),即缺血再灌注后NF-κB從細胞漿向細胞核的移位被限制。Western蛋白印跡結果顯示,Ⅰ組和Ⅲ組僅有微量的NF-κB的表達,分別與Ⅰ組和Ⅲ組比較,缺血再灌注后的Ⅱ組和Ⅳ組NF-κB表達量均顯著增加(P<0.05或<0.01)。Ⅵ組和Ⅶ組NF-κB的表達明顯低于Ⅳ組(P<0.05或<0.01)。見表4。
表4 7組心肌組織NF-κB的表達n=12,±s

表4 7組心肌組織NF-κB的表達n=12,±s
注:與Ⅰ組比較,*P <0.05;與Ⅱ組比較,#P <0.05;與Ⅲ組比較,△P <0.01;與Ⅳ組比較,☆P <0.05,▲P <0.01
組別 NF-κB(positive cells/hpf) NF-κB p65(relative density)1.6±0.7 1.00±0.02Ⅱ組 10.9±3.8* 3.02±0.12*Ⅲ組 5.8±1.4 1.53±0.31Ⅳ組 16.4±4.7#△ 6.02±0.52#△Ⅴ組 14.3±4.5 4.83±0.12Ⅵ組 12.6±3.6☆ 3.53±0.37☆Ⅶ組 10.3±5.3▲ 2.96±0.24Ⅰ組▲
3 討論
腹腔注射STZ是制備大鼠糖尿病模型的常用方法[6],本研究結果顯示,腹腔注射STZ后72 h時Ⅲ組~Ⅶ組大鼠隨機血糖≥16.7 mmol/L,并出現多飲、多食和多尿等癥狀,腹腔注射STZ后3周時隨機血糖仍≥16.7 mmol/L,體重明顯降低,提示大鼠糖尿病模型制備成功。
本研究結果表明,糖尿病各組大鼠基礎HR、MAP及血壓-心率指數均低于非糖尿病大鼠,心肌缺血再灌注使心功能進一步下降,在缺血再灌注期間輸注6、12 mg·kg-1·h-1異丙酚改善了糖尿病大鼠心功能,說明本研究中復制糖尿病大鼠心肌缺血再灌注損傷模型可靠,異丙酚對糖尿病大鼠缺血再灌注心肌具有保護作用。
NF-κB是一個重要的多向性核轉錄調節(jié)因子,普遍存在于真核細胞中,可調節(jié)細胞因子、趨化因子、氧化應激相關酶等基因的表達,調控并介導多種病理生理過程。靜息狀態(tài)下NF-κB異源性二聚體與抑制性蛋白I-κB結合存在于胞漿中,呈無活性狀態(tài)。當細胞在一些刺激因素(如細胞因子、活性氧自由基等)作用下,I-κB發(fā)生磷酸化,隨之而產生泛素化,最終在蛋白酶體的作用下降解,從而釋放NF-κB二聚體,使其得以轉位進入細胞核中,與靶基因啟動子或增強子的κB位點發(fā)生特異性結合,啟動靶基因的轉錄[7]。研究表明,NF-κB是高血糖和氧化應激時細胞內靶點,同時,TNF-α、IL-6等參與缺血再灌注損傷的細胞因子均含有κB位點,受NF-κB的調控[8]。IL-6被認為是一種炎性狀態(tài)的標志,在免疫應答與免疫細胞生長中起重要作用,而TNF-α是一種促炎性細胞因子,其主要來源于巨噬細胞豐富的肝、脾以及心肌原位巨噬細胞和心肌細胞本身。TNF-α通過抑制心肌細胞GLUT4mRNA和蛋白質的表達,使葡萄糖利用減少,而脂肪酸和酮體成為心肌能量的主要來源[9]。而未經治療的糖尿病動物模型,心肌葡萄糖利用進一步下降,脂肪利用率上升至90% ~100%,使心肌 ATP水平下降近30%,心肌細胞結構和功能受到明顯損害[10]。本研究結果顯示,Ⅲ組血清TNF-α水平明顯高于Ⅰ組,而心肌TNF-α水平雖有升高趨勢,但尚無統(tǒng)計學意義,說明糖尿病是全身炎性反應疾病,3周病程糖尿病大鼠基礎心功能的降低可能與全身炎性反應所致血清TNF-α水平升高造成的心肌抑制有關。心肌缺血再灌注后,Ⅱ組和Ⅳ組血清及心肌TNF-α水平明顯均升高,說明缺血再灌注是心肌產生TNF-α的重要刺激因子。異丙酚中、高劑量組血清及心肌TNF-α水平明顯低于Ⅳ組,說明異丙酚能夠抑制糖尿病大鼠心肌缺血再灌注后TNF-αmRNA和蛋白表達,降低血清及心肌TNF-α水平,從而對糖尿病缺血再灌注心肌具有保護作用。
Murphy等[11]研究發(fā)現異丙酚結構類似于內源性抗氧化劑維生素E,可直接與自由基反應生成2,6-二異丙基苯酚基團,使自由基滅活。研究證實異丙酚通過增強細胞抗氧化作用、減少自由基脂質過氧化物的產生而減輕心肌缺血再灌注損傷[12]。因此,異丙酚可能通過減少糖尿病大鼠心肌缺血再灌注時氧自由基的產生或抑制氧自由基的活性,降低了氧自由基對NF-κB的激活作用,減少了TNF-α、IL-6的產生,從而具有心肌保護作用。
綜上所述,異丙酚6、12 mg·kg-1·h-1通過抑制3周病程糖尿病大鼠缺血再灌注心肌 NF-κB的激活,減少TNF-α、IL-6的釋放而具有保護作用。
1 Dandona P,Aljada A,Chaudhuri A,et al.Metabolic syndrome:a comp rehensive perspective based on interactions between obesity,diabetes,and inflammation.Circulation,2005,111:1448-1454.
2 Milne SE,Troy A,Irwin MG,et al.Relationship between bispectral index auditory evoked potential index and effect-site EC50 for propofol at two clinical end-points.Br Janaesth,2003,90:127-131.
3 Li C,Brbwder W,Kao RL.Early activation of transcription factor NF-κB during ischemia in perfused rat heart.Am J Physiol,1999,276:H543-552.
4 Elizabeth N,Morgan MD,Edward M,et al.An essential role of NF-κB in the cardioadaptive response to ischemia.Ann Thorac Surg,1999,68:377-382.
5 鄭勇萍,王焱林,王成夭,等.異丙酚預先給藥對心肌缺血再灌注損傷大鼠炎性反應的影響.中華麻醉學雜志,2006,26:919-921.
6 張春鴻,臧偉進,徐靜,等.建立糖尿病心肌病動物模型方法的實驗研究.衛(wèi)生研究,2006,35:707-711.
7 Baeuerle PA,Henkel T.Function and activation of NF-κB in the immune system.Ann Rev Immunol,1994,12:141-179.
8 Li C,Broder W,Kao L.Early activation of transcription factor NF-kapperB during ischemia in perfused rat heart.Am J Physiol,1999,276:H543-552.
9 Grigsby RJ,Dobrowsky RT.Inhibition of ceramide production reverses TNF-a induced insulin resistance.Biochem Bioph Res Co,2001,287:1121-1124.
10 Finck BN,Han X,Courtois M,et al.Acritical role for PPA Ralpha-mediated lipotoxicity in the pathogenesis of diabetic cardiomyopathy:modulation by dietary fat content.PNAS,2003,100:1226-1231.
11 Murphy PG,Myers DS,Davies WJ,et al.The antioxidant potential of propofol(2,6-diisopropylphenol).Br JAnaesth,1992,68:616-618.
12 Barbara JM,Elizabeth JK,Paul S,et al.Protection of cardiomyocyte function by propofol next term during simulated ischemia is associated with a direct action to reduce pro-oxidant activity.J Mol Cell Cardiol,2007,42:600-608.

