顆粒型環瓜氨酸肽抗原的制備及條件優化
付 琳,裘宇容,姜云飛,夏佳音,王海芳
(1.南方醫科大學南方醫院臨床檢驗中心,廣東 廣州510515;2.廣州市哈畢特實驗儀器有限公司,廣東 廣州510730)
2010年美國風濕病學學會和歐洲風濕病學聯盟聯合制定了新的類風濕關節炎診斷分類標準[1],抗環瓜氨酸肽抗體(抗CCP)被列入新的診斷標準中,成為診斷類風濕關節炎(RA)的新的血清學指標。目前,檢測抗CCP抗體的方法主要有酶聯免疫吸附測定法(ELISA)和化學發光分析法(CLIA)。ELISA法靈敏度較高,試劑成本較低,不需要昂貴的儀器設備,可在臨床上廣泛使用;但是,ELISA方法時間檢測時間長,操作繁雜,不適合單個零散標本的檢測,且需手工操作,檢測線性范圍窄,不易標準化。CLIA法檢測高度敏感,特異性及重復性較好,檢測范圍寬,試劑穩定無毒害無污染,操作簡單,檢測過程耗時短,而且易于自動化以及單個樣本的檢測;但是CLIA法成本高收費貴,發光劑的發光性能難以穩定。為此開展一種新型的檢測方法用于抗CCP抗體的檢測,不僅可以縮短標本的檢測時間,而且降低檢測成本已成為CCP抗體檢測的主要發展方向。研究開發一種新的試劑用于生化分析儀上檢測,由于CCP多肽是小分子多肽,采用生化分析儀難以直接檢測,因此必須將CCP與固相載體結合,增加其反應面積從而提高檢測靈敏度。本研究即是探索顆粒型環瓜氨酸肽抗原的制備并對實驗條件進化,為后續用于生化分析儀的測定奠定基礎。
1 材料與方法
1.1 主要試劑和儀器
膠乳微球(粒徑160nm),美國Bangslabs公司提供;瓜氨酸環肽,杭州中肽公司合成;牛血清白蛋白BSA、1-乙基碳酰二亞胺鹽酸鹽(EDC)、N-羥基琥珀酰亞胺(NHS),均為美國sigma公司生產;Bradford測蛋白試劑盒,南京凱基生物公司提供;其余所用化學試劑均為分析純;實驗用水為去離子水。
寧波新芝生物科技股份公司JY-92II型超聲波細胞粉碎機;美國MD-SpectraMax M5多功能酶標儀。
1.2 實驗方法
1.2.1 CCP多肽合成 由杭州中肽公司根據我們提供的氨基酸序列用Fmoc化學法合成,合成后經RP-HPLC純化使濃度大于95%。根據杭州中肽公司提供合成樣品的氨基酸序列分析資料、樣品的HPLC分析圖譜及樣品的質譜圖,證實合成物為CCP。
1.2.2 CCP與BSA偶聯蛋白的制備 取BSA溶解于PH9.0碳酸鹽緩沖液中,加入適量檸康酸酐,室溫反應過夜。凝膠過濾除去多余的檸康酸酐。修飾后的BSA通過EDC反應與CCP偶聯,通過對BSA與CCP偶聯量、偶聯pH及偶聯時間進行優化,最終使CCP與BSA偶聯產物蛋白大小在70-170kD之間,紫外吸收峰相對于BSA產生左移。然后在pH3.5的醋酸鹽緩沖液中還原已被封閉的氨基,37℃反應2h,4℃透析過夜,濃縮干燥備用。
1.2.3 膠乳顆粒偶聯方法 取0.1ml羧基化膠乳微球,加入0.9ml乙磺酸緩沖液(MES)混合均勻后加入EDC和NHS活化,室溫條件下溫和攪拌15 min。12 000g離心15min,用0.1mol/L磷酸緩沖液(PBS)重復清洗沉淀3遍,去上清,沉淀經0.1 mol/L PBS重懸、振蕩、超聲處理后即得到活化的膠乳微球。取2mg BSA-CCP溶于PBS,加入到1 ml經過活化的膠乳微球溶液中,室溫條件下溫和攪拌,達到反應時間后,12 000g離心15min,沉淀用含有0.05%Tween20的PBS重復清洗3遍,收集上清液,檢測上清液中未反應的蛋白含量。
1.2.4 蛋白偶聯量的測定
蛋白偶聯量通過Bradford法檢測反應前后溶液中的蛋白質含量變化求得:蛋白偶聯量=(加入蛋白總量—洗滌液中蛋白量)∕加入蛋白總量×100%,重復實驗3次,取平均值得蛋白偶聯的平均效率。
2 結果
2.1 CCP-BSA偶聯產物蛋白
根據先前文獻報道及蛋白特征,對BSA與CCP偶聯條件進行篩選。BSA與CCP偶聯質量比為1∶1,EDC與NHS用量比為2∶3,偶聯PH為6.0,BSA與CCP偶聯可以達到較好的效果。BSA與CCP偶聯產物蛋白條帶單純BSA條帶相比有明顯差異。SDS-PAGE電泳圖(圖1)表明,BSA和CCP的偶聯產物的電泳條帶則出現在70KD-170KD之間不等。由于實驗中無法控制CCP交聯的數量,所以會產生不等條帶的現象。紫外吸收光譜可以看出BSA在280nm處出現特征性吸收峰,BSA與CCP偶聯產物蛋白的紫外吸收峰有明顯左移,符合偶聯蛋白的特征,如圖2。
2.2 160nm羧基化膠乳微球偶聯條件優化結果
2.2.1 EDC用量對偶聯的影響
在相同條件下,取0.1ml微球(10mg干微球),加入pH6.0MES緩沖液中。取不同量的EDC以及NHS(EDC與NHS等量),混勻,室溫反應15 min,洗滌,超聲波重懸。取2mg BSA-CCP偶聯產物蛋白,與活化微球混勻,室溫反應2h,洗滌,檢測上清液中蛋白含量。偶聯結果如表1,EDC含量為0mg時,微球與偶聯蛋白之間為物理吸附,吸附效率為19.67%。隨著EDC用量由2.5mg/ml增加到10mg/ml,偶聯蛋白的量也隨之增加抗體的偶聯效率由36.5%上升到63.66%,當EDC用量達到7.5mg/ml時,偶聯蛋白效率達到63.66%,之后隨著EDC用量的增加,偶聯蛋白效率不再增加。EDC最佳用量為7.5mg/ml。
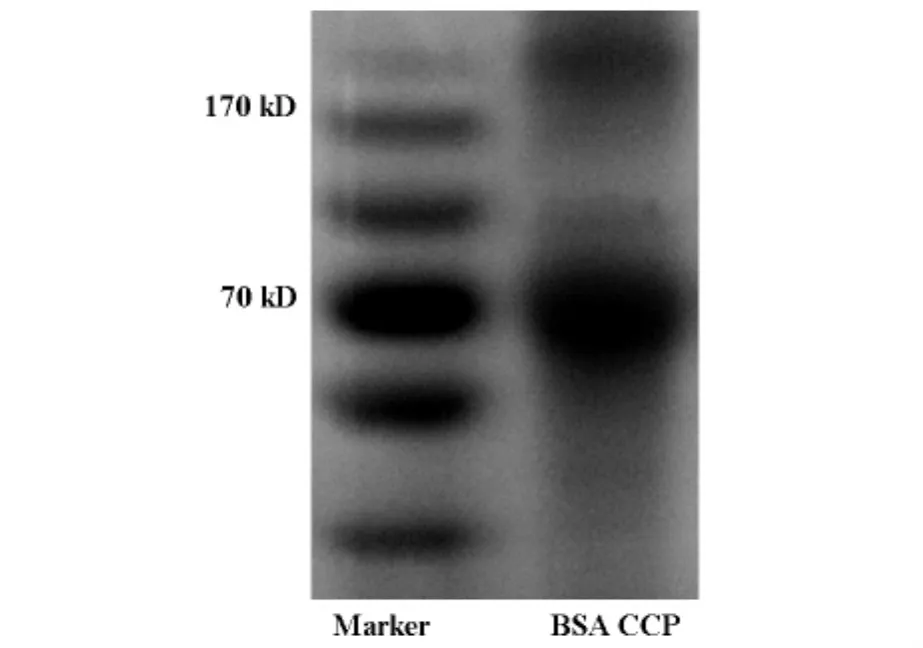
圖1 BSA-CCP偶聯產物SDS-PAGE電泳圖
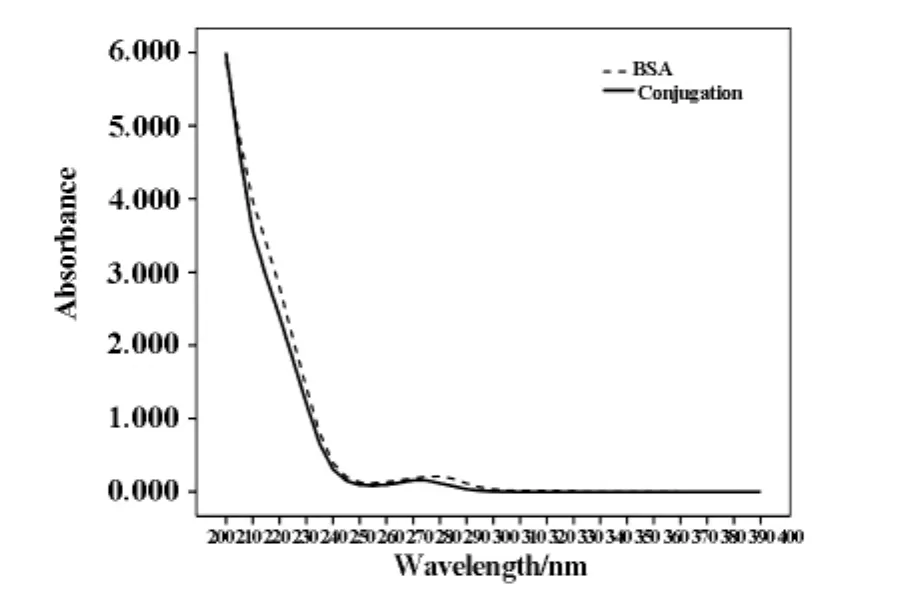
圖2 BSA-CCP偶聯抗原蛋白OD200-400掃描鑒定結果
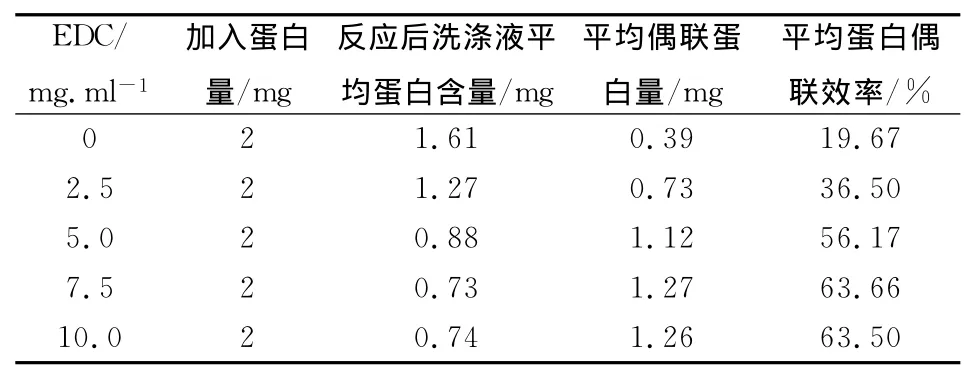
表1 不同EDC用量對偶聯效果的影響
2.2.2 偶聯時間的優化
EDC用量和緩沖液pH恒定的條件下(EDC用量7.5mg/ml,pH7.5),分別在反應0h、0.5h、1h、2h、3h、4h測定蛋白偶聯微球的效率。偶聯時間對微球偶聯效率的影響如圖3所示,隨著偶聯時間的延長,蛋白偶聯微球的效率不斷增加,在偶聯時間為0.5-2h內,偶聯效率增加最快,當反應時間2h后,反應趨于平衡。因此,最佳的偶聯時間為2-4h。
2.2.3 反應PH值的優化
采用水溶性碳二亞胺活化微球表面羧基,共價偶聯制備的偶聯產物蛋白,結果表明,緩沖液pH對偶聯有較大的影響。用0.1mol/L磷酸鹽緩沖液(PB),恒定其他反應條件不變(EDC用量為7.5 mg/mL,反應時間為2h)。反應前偶聯蛋白含量均為2mg,調節緩沖液的pH 分別為6.0、6.5、7.0、7.5、8.0、8.5,進行蛋白偶聯,在同樣條件下,測定偶聯前加入蛋白濃度和偶聯后上清液的蛋白濃度,得到微球偶聯蛋白量。由圖4可見,pH為7.5時偶聯效果最好,pH7.0-8.0為適宜偶聯的pH范圍。
3 討論
有研究證明,關節滑膜組織中的瓜氨酸化蛋白在RA發生發展過程中起著重要的作用。這種有抗原驅動和T淋巴細胞介導的自身免疫反應被認為是RA發病的啟動因子[2]。環瓜氨酸肽是21個氨基酸的多肽,其序列為其序列為HQCHQESTXGR SRGRCGRSGS,其中X代表瓜氨酸,其通過第3和第16位的半胱氨酸巰基氧化而形成環肽[3]。采用人工合成的CCP作為抗原檢測抗CCP抗體的方法,已成為目前檢測抗CCP抗體的主要方法。
聚苯乙烯微球是一種由苯乙烯聚合而成的高分子材料,表面帶有功能基團,活化后可通過共價鍵結合蛋白質、酶、抗體、細胞等,已經廣泛應用于免疫測定,親和層次及臨床診斷等領域[4,5]。包被有抗體/抗原的膠乳微球已被廣泛應用于免疫診斷中,將不同的抗原/抗體連接在膠乳微球表面,通過免疫檢測,可將一些常見疾病,如肝炎、流感等快速檢測出來[6,7]。常用的制備膠乳-蛋白復合物的方法有兩種:物理吸附法和共價偶聯法。由于吸附會引起固定于膠乳微球表面蛋白的部分解吸及結構的變化,所以用物理吸附法制備的膠乳-蛋白復合物特異性低,在生物診斷中的應用受到限制。共價偶聯法能在最大限度上控制吸附法中出現的問題,成為目前制備膠乳-蛋白復合物的主要方法。
本研究首先將CCP和一種無關蛋白(BSA)通過化學偶聯方法共價偶聯,后續采用BSA作為交聯臂使CCP間接偶聯到膠乳微球上,為后續建立檢測抗CCP抗體方法奠定基礎。采用的偶聯載體是帶有-COOH活性基團的聚苯乙烯微球。羧基化微球與蛋白質的偶聯是氨基和羧基間的成酰胺鍵反應,在EDC以及NHS活化羧基與蛋白分子上的氨基之間進行。結果顯示,EDC活化羧基與蛋白分子的氨基之間的反應受到多種因素的影響,如EDC用量、偶聯時間、反應pH等。羧基化微球經過EDC和NHS活化形成較穩定的中間產物,該中間產物的很容易和氨基反應形成酰胺鍵,所以羧基活化是偶聯反應的重要部分,羧基基團的活化直接影響蛋白偶聯效率。而羧基活化多少與EDC用量有直接關系,EDC用量太少則不足以活化微球上的羧基,偶聯效率較低;EDC用量過大則會使微球表面的羧基完全活化,蛋白偶聯效率不會持續上升而是趨于平衡,造成不必要的浪費。若偶聯時間過短,蛋白質則不能充分有效的和活化的微球反應;若偶聯時間過長,蛋白偶聯量達到飽和并且會出現一定程度的下降,而且長時間的反應可能會使蛋白分子在反應過程中氧化變性,蛋白偶聯效率降低。另外,由NHS介導的EDC兩步法偶聯反應,EDC活化羧基與NHS形成較穩定活化酯中間產物,同蛋白分子上的氨基反應一般在pH7-8之間進行。過高或者過低pH條件下,蛋白分子容易變性失活,從而不利于后續研究的進行。
本研究通過間接方法將CCP抗原肽共價偶聯到膠乳微球上。而偶聯上的CCP抗原肽在一定條件下可以與抗CCP抗體特異性結合,因此可用于抗CCP抗體的檢測。近年來,國內有不少研究微球和抗體偶聯的報道[8,9],報道微球與抗體的偶聯效率一般在16.8%~60%。本研究結果探索了聚苯乙烯微球與自制的CCP抗原肽偶聯蛋白的最佳偶聯條件,可使蛋白偶聯效率達到60%以上,為建立簡便快速檢測抗CCP抗體的方法奠定了良好的基礎,應用前景廣闊。
[1]Cohen S,Emery P.The American College of Rheumatology/European League Against Rheumatism criteria for the classification of rheumatoid arthritis:agame changer[J].Arthritis Rheum,2010,62(9):2592.
[2]虞 偉,張 瑾,顧晨曦,等.三種不同固相化方法用于抗環瓜氨酸肽抗體測定的研究[J].中華檢驗醫學雜志,2008,31(11):1227.
[3]Schellekens G A,Visser H,de Jong B A,et al.The diagnostic properties of rheumatoid arthritis antibodies recognizing a cyclic citrullinated peptide[J].Arthritis Rheum,2000,43(1):155.
[4]Murray D L,Ryu E,Snyder M R,et al.Quantitation of serum monoclonal proteins:relationship between agarose gel electrophoresis and immunonephelometry[J].Clin Chem,2009,55(8):1523.
[5]Vihola H,Marttila A K,Pakkanen J S,et al.Cell-polymer interactions of fluorescent polystyrene latex particles coated with thermosensitive poly(N-isopropylacrylamide)and poly(N-vinylcaprolactam)or grafted with poly(ethylene oxide)-macromonomer[J].Int J Pharm,2007,343(1-2):238.
[6]Garcia V S,Gonzalez V D,Caudana P C,et al.Synthesis of latexantigen complexes from single and multiepitope recombinant proteins.Application in immunoagglutination assays for the diagnosis of Trypanosoma cruzi infection[J].Colloids Surf B Biointerfaces,2012,101(C):384.
[7]Finney H,Newman D J,Gruber W,et al.Initial evaluation of cystatin C measurement by particle-enhanced immunonephelometry on the Behring nephelometer systems(BNA,BN II)[J].Clin Chem,1997,43(6Pt 1):1016.
[8]王啟輝,劉金華,周 潔,等.穿膜肽-抗體-微球偶聯物的制備方法研究[J].黑龍江醫藥,2011,24(4):558.
[9]王 愷,馬光輝.白蛋白微球的制備、改性和應用的研究進展[J].國際藥學研究雜志,2003,30(6):366.

