快速沉淀-碳熱還原法合成亞微米LiFePO4/C
彭忠東,裴振興,石迪輝,胡國榮
(1.中南大學冶金科學與工程學院,湖南長沙 410083;2.臨沂杰能新能源材料有限公司,山東臨沂 276023)
快速沉淀-碳熱還原法合成亞微米LiFePO4/C
彭忠東1,裴振興1,石迪輝2,胡國榮1
(1.中南大學冶金科學與工程學院,湖南長沙 410083;2.臨沂杰能新能源材料有限公司,山東臨沂 276023)
以FeSO4·7H2O、NH4H2PO4和 H2O2為原料,用快速沉淀法制備亞微米無定形 FePO4·2H2O,再將 FePO4·2H2O、Li2CO3和葡萄糖球磨混合,通過碳熱還原法合成LiFePO4/C復合材料。通過XRD、SEM和TEM分析及充放電測試考察了反應物濃度和反應溫度對FePO4·2H2O的影響。當溶液濃度為0.2 mol/L、反應溫度為50℃時,可制備形貌一致、粒度分布均勻且純度高的亞微米無定形FePO4·2H2O。合成的LiFePO4/C粒度分布均勻,碳包覆膜完整,在2.5~4.1 V充放電,1.0C和2.0C首次放電比容量分別為140.5 mAh/g和134.9 mAh/g,循環100次的容量保持率分別為100.0%和97.8%。
正極材料; 快速沉淀; 磷酸鐵(FePO4); 磷酸鐵鋰(LiFePO4)
針對磷酸鐵鋰(LiFePO4)電子導電率(<10-9S/cm)低、Li+擴散系數(10-14~10-16cm2/s)低和高倍率放電性能差的改性方法主要有:金屬陽離子摻雜提高導電性、表面碳包覆提高電子導電率和減小顆粒粒徑等[1]。在LiFePO4的合成方法中,溶膠-凝膠法的制備周期長、原料成本高、難以實現工業化;水熱法的高壓設備成本高、技術難度大,且產品價格高,不利于大規模應用。目前,工業上多采用高溫固相法,通常以草酸亞鐵為鐵源,工藝較成熟,但顆粒不均勻、粒徑分布范圍廣、難以控制產物的批次穩定性[2]。FePO4中Fe和P兩種元素的比例與LiFePO4一致,如果以FePO4代替草酸亞鐵作為鐵源,可減少原料的種類,提高物料混合效率、簡化工藝流程,還有望通過控制FePO4的形貌、粒度和化學成分,合成形貌一致性好、化學純度高的LiFePO4。高劍等[3]采用控制結晶工藝制備球形摻碳FePO4前驅體,經過熱處理合成球形LiFePO4/C,1C放電比容量達144.0 mAh/g,但摻碳共沉淀工藝復雜、反應條件難以穩定控制。與通常的沉淀結晶法相比,快速沉淀法的操控方便、反應速度快且成本低,可控制產物的形貌、粒度,制備亞微米甚至納米粉體材料。
本文作者用快速沉淀法制備前驅體亞微米 FePO4·2H2O,再用碳熱還原法合成LiFePO4/C復合材料,對FePO4·2H2O和LiFePO4/C進行結構和形貌分析,對LiFePO4/C進行電化學性能測試。
1 實驗
1.1 FePO4·2H2O的快速沉淀法制備
將0.10 mol FeSO4·7H2O(江蘇產,98.0%)和 0.10 mol NH4H2PO4(武漢產,98.0%)分別溶于等體積的去離子水中,然后量取0.06 mol H2O2(上海產,30.0%),在強烈攪拌的條件下將NH4H2PO4、FeSO4和H2O2溶液快速加入到燒杯中,控制水浴溫度、反應1 h。將得到的乳白色沉淀過濾、用去離子水洗滌5次,于110℃下鼓風干燥12 h,得到淺黃色粉末。

表1 實驗條件列表Table 1 The list of experimental conditions
1.2 LiFePO4/C的碳熱還原法合成
按物質的量比1∶1稱取自制FePO4·2H2O和Li2CO3(四川產,99.5%),每0.1 mol LiFePO4加入2.5 g葡萄糖(江蘇產,99.0%)作為碳源和還原劑,以乙醇(天津產,AR)為介質,在QM型行星式球磨機(江蘇產)上以200 r/min的轉速球磨(球料比10∶1)2 h,將得到的漿料在80℃下烘干后,于氮氣氣氛中升溫到650℃并保溫8 h,隨爐冷卻到室溫。
1.3 材料的分析
用Minflex型X射線衍射儀(日本產)進行晶體結構分析,CuKα,管壓40 kV、管流300 mA,步寬為0.02 °,掃描速度為2(°)/min;用JSM-5600LV型掃描電子顯微鏡(日本產)和Tecnai G12型透射電子顯微鏡(TEM,美國產)進行微觀形貌觀察;用HW2000型紅外碳硫分析儀(江蘇產)對LiFePO4進行碳含量分析;用比色法測定FePO4·2H2O中磷的含量,用重鉻酸鉀滴定法測定FePO4·2H2O中的鐵含量[4],并計算鐵和磷的物質的量比(鐵磷比);用MS2000激光粒度分析儀(英國產)分析LiFePO4的粒度分布。
1.4 電池的組裝與電化學性能測試
按質量比8∶1∶1將活性物質、導電劑乙炔黑(河南產,AR)和粘結劑聚偏氟乙烯(日本產,AR)在N-甲基吡咯烷酮(日本產,AR)中混勻,制成漿料,涂覆在20 μm厚的鋁箔(上海產,99.7%,)上,在120℃下真空(0.08 MPa)干燥4 h,再沖壓成Ф=11 mm圓形正極片(約含2 mg活性物質)。以金屬鋰片(江蘇產,AR)為負極,1 mol/L LiPF6/EC+DMC+EMC(體積比 1∶1∶1,江蘇產,電池級)為電解液,Celgard 2400膜(美國產)為隔膜,在充滿氬氣的手套箱中組裝CR2025型扣式電池。在室溫下,用BTI-10測試儀(湖北產)對電池進行電化學性能測試,電壓為2.5~4.1 V。
2 結果與討論
2.1 FePO4·2H2O 的制備
2.1.1 溶液濃度對FePO4·2H2O的影響
制備無定形FePO4·2H2O的化學反應見式(1):
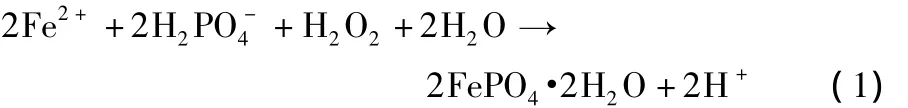
FePO4·2H2O 的室溫溶度積常數Ksp為 9.91 × 10-16,在快速沉淀反應過程中,Fe2+瞬間被氧化成 Fe3+,FeSO4和NH4H2PO4的濃度乘積大于FePO4·2H2O的Ksp,此時溶液處于FePO4·2H2O的過飽和區。瞬間形成的大量晶核來不及長大,因此可制得顆粒細小的粉體材料,獲得亞微米甚至納米級的 FePO4·2H2O 沉淀[5]。
圖1為不同濃度下制備的FePO4·2H2O的XRD圖。

圖1 不同溶液濃度制備的FePO4·2H2O的XRD圖Fig.1 XRD patterns of FePO4·2H2O prepared at different solution concentrations
從圖1可知,各樣品的XRD圖均無明顯的衍射峰,說明不同溶液濃度制備的FePO4·2H2O均為無定形沉淀。
圖2為不同溶液濃度制備的FePO4·2H2O的SEM圖。

圖2 不同溶液濃度制備的FePO4·2H2O的SEM圖Fig.2 SEM photographs of FePO4·2H2O prepared at different solution concentrations
從圖2可知,溶液濃度越高,制備的沉淀越細小,但團聚也越嚴重,低濃度時制備的沉淀形貌一致性較好,均為類球形且團聚不嚴重。濃度越高,反應溶液過飽和度越大,制備的沉淀越細小,但一次粒子小、表面能高,導致團聚嚴重。濃度為0.1~0.2 mol/L時,可制備形貌一致、粒度分布均勻的亞微米FePO4·2H2O沉淀。
反應過程中有H+產生,導致pH值的變化,會影響反應過程且對產物化學成分的影響很大,而反應物濃度直接決定溶液中H+的濃度,因此可通過改變反應物濃度來控制反應溶液的pH值,以影響產物化學成分。不同溶液濃度制備的FePO4·2H2O的鐵磷比見表2。
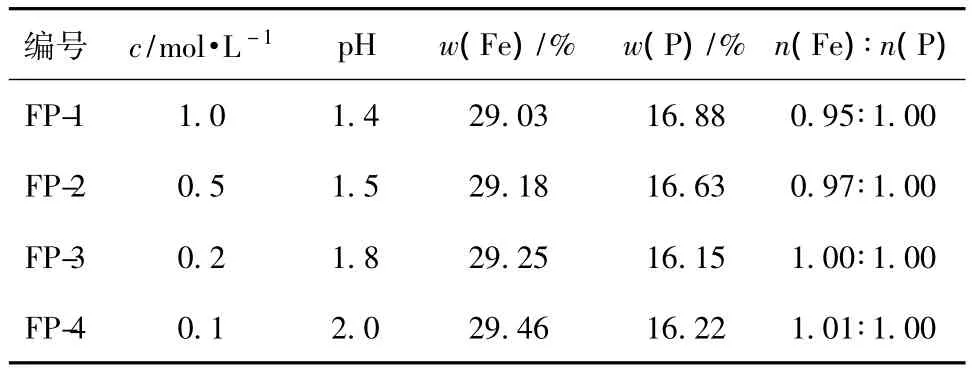
表2 不同溶液濃度制備的FePO4·2H2O的鐵磷比Table 2 The molar ratio of Fe and P for FePO4·2H2O prepared at different solution concentrations
從表2可知,溶液濃度較高、pH值較低時,產物的鐵磷比小于1,實驗現象為:產物的顏色偏黃,可能有多聚磷酸鹽產生。王志興等[6]認為,當 pH值較低時,有 H3Fe(PO4)2·2.5H2O和FeH2P3O10·1.5H2O產生。溶液中還存在式(2)所示的副反應,在反應過程中,會產生少量Fe(OH)3,尤其是當pH >1.8時。當反應物濃度減小后,反應過程中的pH值會增大,即H+濃度減小,會使產物中Fe(OH)3的含量增加,沉淀的顏色變黃,鐵磷比增大。
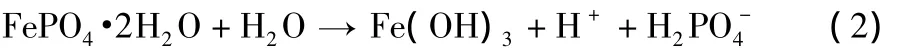
當反應物濃度為0.2 mol/L時,反應過程的pH值為1.8,產物鐵磷比為1.00,最接近理論值,可制備純度更高的LiFePO4,因此選取溶液濃度為0.2 mol/L。
2.1.2 溫度對FePO4·2H2O的影響
圖3是不同溫度下制備的FePO4·2H2O的SEM圖。

圖3 不同溫度下制備的FePO4·2H2O的SEM圖Fig.3 SEM photographs of FePO4·2H2O prepared at different temperatures
隨著反應溫度的升高,單位時間內生成的晶核增加,瞬間生成的大量晶核來不及長大,因此制備的沉淀越細小。從圖3可知,在90℃下制備的FePO4·2H2O的一次顆粒粒徑小于100 nm,已達到納米級別;但由于團聚嚴重,顆粒表面能較大,在燒結過程中會團聚凝結成大顆粒,不利于制備納米LiFePO4。在30℃和50℃下制備的亞微米FePO4·2H2O為類球形沉淀,形貌一致性好且團聚不嚴重。
在30℃和50℃下制備的FePO4·2H2O為接近白色的淺黃色,隨著反應溫度升高,制備的FePO4·2H2O的顏色由淺黃色變為黃色,在90℃下制備的沉淀為棕黃色。隨著反應溫度升高,Fe2+更易于被氧化成Fe3+,且較高溫度下Fe3+的水解反應更嚴重,鐵磷比大于1.00,如表3所示。
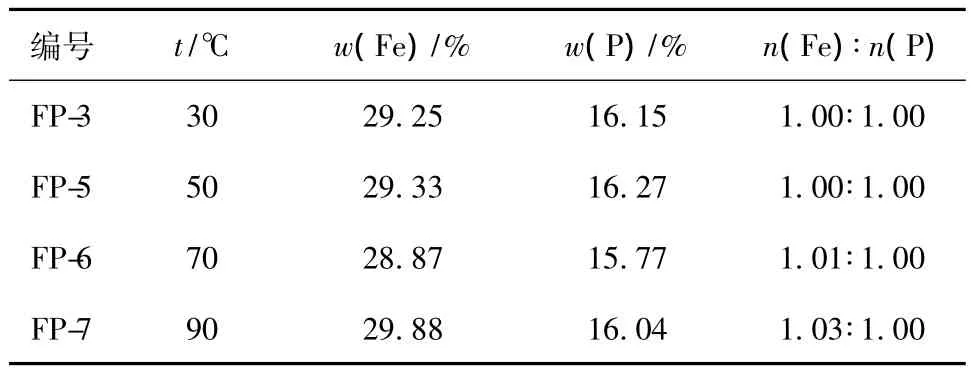
表3 不同溫度下制備的FePO4·2H2O的鐵磷比Table 3 The molar ratio of Fe and P for FePO4·2H2O prepared at different temperatures
綜上所述,在30℃和50℃下制備的FePO4·2H2O,鐵磷比最接近1.00,一次顆粒粒徑為200~300 nm,團聚不明顯,有利于制備形貌一致、粒度均勻、純度較高的LiFePO4。在50℃時,反應物質比在30℃時的化學活性更高、反應速度更快,有利于大規模應用,因此選擇反應溫度為50℃。制備FePO4·2H2O的優化條件為:溶液濃度0.2 mol/L、反應溫度為50℃。
2.2 LiFePO4/C的合成
以優化條件下制備的FePO4·2H2O為前驅體,通過碳熱還原法合成LiFePO4/C復合材料,進行相關分析。
2.2.1 LiFePO4/C的物相及形貌
圖4為LiFePO4/C復合材料的XRD圖。
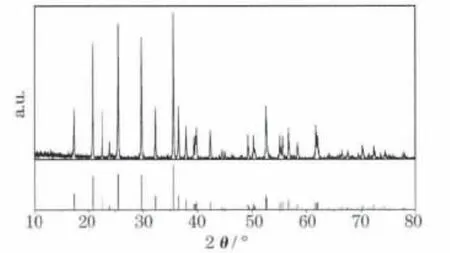
圖4 LiFePO4/C復合材料的XRD圖Fig.4 XRD pattern of LiFePO4/C composite
從圖4可知,樣品的衍射峰與LiFePO4的標準譜(JCPDS:81-1173)一致,為正交晶系橄欖石結構,屬Pnma空間群,特征峰明顯,背底較平整,無其他雜質峰,為純相LiFePO4。經計算,樣品的晶胞參數為:a=1.033 0 nm,b=0.600 7 nm,c=0.469 2 nm,與 LiFePO4的晶胞參數(a=1.033 2 nm,b=0.601 0 nm,c=0.469 2 nm)[7]基本吻合。
圖5為LiFePO4/C復合材料的SEM圖。

圖5 LiFePO4/C復合材料的SEM圖Fig.5 SEM photographs of LiFePO4/C composite
從圖5可知,樣品的粒度分布與前驅體FePO4·2H2O一致,一次顆粒分布于200~400 nm,粒度分布均勻一致、沒有嚴重的團聚。LiFePO4較小的顆粒粒徑有利于縮短Li+和電子的傳輸距離,提高材料導電性,改善材料的電化學性能。顆粒之間的間隙構成了蓬松多孔的亞微觀結構,有利于電解液的滲透擴散,可提高材料的比容量和倍率放電性能。
LiFePO4/C復合材料的粒度分布見圖6。
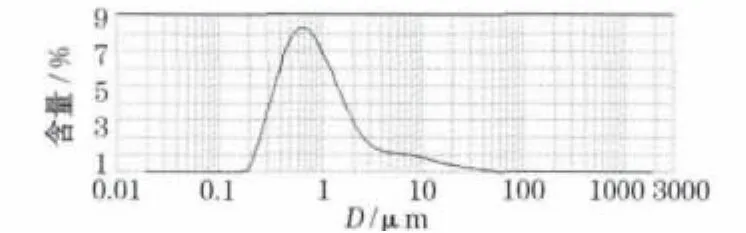
圖6 LiFePO4/C復合材料的粒度分布曲線Fig.6 Particle size distribution curve of LiFePO4/C composite
從圖 6 可知,材料的D10=0.367 μm、D50=0.830 μm、D90=4.029 μm。D50大于SEM圖中觀察到的一次顆粒粒徑,是LiFePO4/C材料中一次顆粒團聚成二次顆粒所致。粒度分布實驗結果表明:LiFePO4/C復合材料的粒度分布集中,與SEM圖中均勻的粒徑分布一致。
2.2.2 LiFePO4/C的碳含量與碳包覆碳硫分析儀測得,LiFePO4/C中的碳含量為2.1%。圖7為LiFePO4/C復合材料的TEM圖。

圖7 LiFePO4/C復合材料的TEM圖Fig.7 TEM photographs of LiFePO4/C composite
從圖7可知,顆粒表面都有較完整的碳膜包覆,碳膜的厚度為1~2 nm,顆粒之間也有絮狀碳膜連接,相鄰的兩個顆粒之間有較厚的碳膜相連,構成了較完整的電子導電網絡。在碳熱還原反應中,三價鐵的還原與碳的包覆同時進行,可在較低的碳含量下獲得完整的碳包覆導電網絡。這既可降低碳源的使用量,又可獲得較高的振實密度和較低的比表面積,提高LiFePO4/C復合材料的加工性能。
2.2.3 LiFePO4/C復合材料的電化學性能
LiFePO4/C復合材料的電化學性能測試結果見圖8。
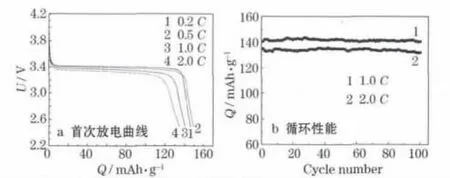
圖8 LiFePO4/C復合材料的電化學性能Fig.8 Electrochemical performance of LiFePO4/C composite
從圖8可知,LiFePO4/C在0.2C、0.5C、1.0C和2.0C時的首次放電比容量分別為146.6 mAh/g、149.6 mAh/g、140.5 mAh/g和134.9 mAh/g,電壓平臺良好。0.2C首次放電比容量低于0.5C時,是因為首次充放電時,電解液未完全滲透進入電極。LiFePO4/C復合材料第100次1.0C、2.0C循環的比容量分別為140.5 mAh/g、132.0 mAh/g,容量保持率分別為97.8%、100.0%。
3 結論
以FeSO4·7H2O和 NH4H2PO4為原料,H2O2為氧化劑,通過快速沉淀法制備FePO4·2H2O。當反應物為0.2 mol/L、反應溫度為50℃時,可制備形貌一致性好、粒度分布均勻、鐵磷比為1.00的無定形亞微米FePO4·2H2O。以亞微米無定形FePO4·2H2O為前驅體、葡萄糖為碳源,通過碳熱還原法可制得粒徑分布均勻、結晶性好且碳包覆完整的亞微米LiFePO4/C復合材料。以1.0C和2.0C循環,樣品的首次放電比容量分別為140.5 mAh/g和134.9 mAh/g,第100次循環的容量保持率分別為100.0%和97.8%。
[1]Wang J J,Sun X L.Understanding and recent development of carbon coating on LiFePO4cathode materials for lithium-ion batteries[J].Energy & Environmental Science,2012,5(1):5 163 -5 185.
[2]DING Dong(丁冬),WU Guo-liang(吳國良),PANG Jing(龐靜),et al.正極材料LiFePO4研究與產業化的進展[J].Battery Bimonthly(電池),2010,40(5):282 -284.
[3]GAO Jian(高劍),YING Jie-rong(應皆榮),JIANG Chang-yin(姜長印),et al.球形納米晶LiFePO4和Li4Ti5O12的制備及電池研究[J].Journal of Inorganic Materials(無機材料學報),2009,24(1):139-142.
[4]WANG Xiao-yan(王曉艷),WANG Xing(王星),WANG Yu-feng(王玉鋒).LiFePO4化學成分測定[J].Dianyuan Jishu(電源技術),2006,30(9):764 -767.
[5]Scaccia S,Carewska M,Wisniewski P,et al.Morphological investigation of sub-micron FePO4and LiFePO4particles for rechargeable lithium batteries[J].Mater Res Bull,2003,38(7):1 155 -1 163.
[6]WANG Zhi-xing(王志興),WU Ling(伍凌),LI Xin-hai(李新海),et al.LiFePO4的前驅體制備與性能[J].Journal of Functional Materials(功能材料),2008,39(4):614 -617.
[7]LI Shao-min(李紹敏),LIU Heng(劉恒),CHEN Liang(陳亮),et al.液相沉淀-多元醇還原法合成LiFePO4/C正極材料的電化學性能[J].The Chinese Journal of Nonferrous Metals(中國有色金屬學報),2012,22(5):1 311-1 318.
Submicro LiFePO4/C prepared by fast precipitation-carbothermal reduction method
PENG Zhong-dong1,PEI Zhen-xing1,SHI Di-hui2,HU Guo-rong1
(1.School of Metallurgical Science and Engineering,Central South University,Changsha,Hunan410083,China;2.Linyi Gelon Battery Material Co.,Ltd.,Linyi,Shandong276023,China)
Submicro amorphous FePO4·2H2O was prepared by fast precipitation method using FeSO4·7H2O,NH4H2PO4and H2O2as raw materials,LiFePO4/C composite was synthesized by carbothermal reduction method with the homogeneous mixture of FePO4·2H2O,Li2CO3and glucose.The effects of reagent concentration and reaction temperature to FePO4·2H2O were investigated by XRD,SEM and TEM analyses and charge-discharge test.Submicro amorphous FePO4·2H2O synthesized with solution concentration of 0.2 mol/L and reaction temperature at 50 ℃ had the same morphology,uniform particle size distribution and high purity.LiFePO4/C composite as prepared had uniform particle size distribution,complete carbon coating,when charged-discharged in 2.5 ~4.1 V,its 1.0Cand 2.0Cinitial specific discharge capacity was 140.5 mAh/g and 134.9 mAh/g,respectively,the capacity retention rate in the 100th cycle was 100.0%and 97.8%,respectively.
cathode material;fast precipitation;iron phosphate(FePO4);lithium iron phosphate(LiFePO4)
TM912.9
A
1001-1579(2013)05-0257-04
彭忠東(1969-),男,湖南人,中南大學冶金科學與工程學院副教授,研究方向:應用電化學;
裴振興(1986-),男,山東人,中南大學冶金科學與工程學院碩士生,研究方向:鋰離子電池材料,本文聯系人;
石迪輝(1980-),男,湖南人,臨沂杰能新能源材料有限公司總工程師,研究方向:鋰離子電池材料;
胡國榮(1963-),男,湖南人,中南大學冶金科學與工程學院教授,研究方向:應用電化學。
2012-02-02

