超濾法濃縮富集牡蠣蛋白抗氧化活性肽
郝更新,曹文紅,郝記明,章超樺,*
(1.中國科學院南海海研究所,廣東廣州510301;2.集美大學生物工程學院,福建廈門361021;3.中國科學院研究生院,北京100049;4.廣東海洋大學食品科技學院,廣東湛江524025)
牡蠣是四大養殖貝類之一,目前我國已成為世界上牡蠣養殖大國,年產量已經達到了35.0萬t,其中福建為14.5萬t[1]。國內對牡蠣的利用仍然以鮮食和干制品為主,少量加工成蠔油或其它調味品,對其深加工的研究相對較少,附加值較低。牡蠣營養價值非常高,以干基計,蛋白質(39.1%~53.1%),脂肪(7.8%~8.7%),糖原(21.6%~38.9%)[2]。同時,牡蠣是我國衛生部批準的第一批藥用兼保健的功能性食品,已有許多學者對其展開活性成分的提取和分析研究。然而水產動物蛋白作為主要的營養成分往往是沒有生物活性的,需要在消化過程中產生活性,也可以作為前體蛋白水解制備生物活性肽[3]。利用蛋白酶制備生物活性肽就是其中之一。盡管可以通過酶解工藝的優化獲得分子質量相對較為集中的組分,但是蛋白質分子質量的大小、組成、結構等方面的多樣性和復雜性不可避免地將導致蛋白質酶解液的成分復雜多樣。因此,尋找經濟合理分離富集牡蠣蛋白酶解液中的小分子活性肽的方法就成為技術關鍵。超濾法由于可以按膜的截留相對分子質量(MWCO)對物料進行分離,用于蛋白質制品的純化具有工藝流程短、耗用化學試劑少、操作簡單、成本低、易于工業化生產等優點,具有較大的推廣潛力[4]。本研究通過超濾工藝對牡蠣貝肉蛋白酶解液進行處理,分離富集抗氧化活性肽,同時為超濾技術分離純化其它生物活性肽提供參考。
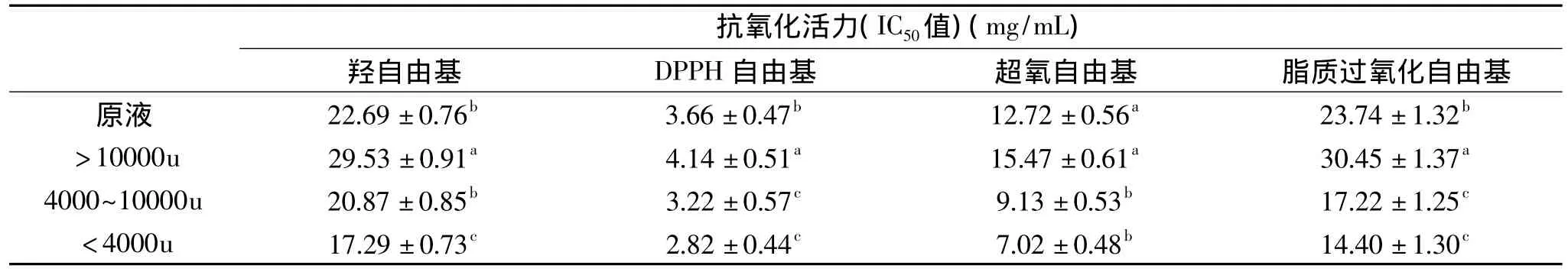
表1 超濾對清除自由基活性的影響Table 1 Scavenging activity of ultrafiltration against free radicals
1 材料與方法
1.1 材料與儀器
新鮮牡蠣 廈門集美人人樂購物廣場,塑料袋分裝,-18℃保存;葡聚糖凝膠(Sephadex)G-25 Sigma公司。
UV-5200型紫外可見分光光度計 上海元析儀器有限公司;日立835-50型高速氨基酸分析儀 日本Hitachi公司;SCM杯式超濾系統 上海斯納普膜分離科技有限公司。
1.2 實驗方法
1.2.1 牡蠣酶解液的制備 新鮮牡蠣洗凈,按料水比1∶3(mg∶mL)加入預冷的蒸餾水,高速勻漿后加入中性蛋白酶,加酶量為1500U/g底物,于43.7℃恒溫水浴酶解 225min,酶解結束后 100℃水浴滅酶15min,冷卻,再以 4000r/min,離心 10min,取上清液分裝,即得牡蠣酶解液,冷藏備用。
1.2.2 牡蠣酶解液的膜分離 使用截留分子量為10000u的聚醚砜超濾膜對牡蠣酶解液進行超濾處理,將可溶性物質分為 >10000u和 <10000u兩部分;再使用截留分子量為4000u的聚醚砜超濾膜對<10000u的超濾液進行超濾處理,又可分成4000~10000u和<4000u兩部分。超濾后的各組分的可溶性蛋白濃度采用Folin-酚法測定。
1.2.3 數據測定 分別測定羥自由基清除率[5]、DPPH 自由基清除率[6]、超氧陰離子清除率[7]、抑制肝脂質過氧化實驗[8]、還原力[9],并對氨基酸組成進行測定[10]。
1.2.4 超濾液分子量分析 超濾液分子質量的測定采用葡聚糖凝膠柱層析法。采用牛血清白蛋白(MW67000u)、抑 肽 酶 (MW6500u)、桿 菌 肽(MW1450u)和L-酪氨酸(MW181u)作為標準物質。凝膠層析條件:凝膠類型:葡聚糖凝膠(Sephadex)G-25;凝膠柱的規格:16mm(內徑)×90cm(長);洗脫液:雙重蒸餾水;收集方法:SBS-100-LCD型自動部分收集器;檢測波長:280nm。
4種標準物質的混合物經分離后,以各管在280nm的吸光值為縱坐標,以洗脫液收集管數為橫坐標,得到標準肽洗脫體積。再根據標準肽洗脫流速求出各標準肽的洗脫體積(Ve),然后制作標準肽的相對分子量的對數(x)與洗脫體積(y)關系的標準曲線:y=-38.653x+255.77,R2=0.956。
2 結果與討論
2.1 不同組分對各種自由基的清除效果
羥自由基是體內最具活性的自由基,主要來源于超氧自由基,過氧化氫,脂質、蛋白和核酸等生物大分子的氧化[11]。DPPH·是一種穩定的自由基,即使在室溫下也很穩定,它可以接受一個電子或是一個氫根離子變成一個穩定的分子[12]。超氧陰離子是體內最常見的自由基,它是氧分子通過接受一個電子后的復位形式。雖然超氧陰離子活性不高,但是它能通過歧化和其他反應產生過氧化氫和氫自由基,是體內自由基的來源,它可以殺死細胞,使酶失活,降解DNA、細胞膜和多糖[13]。生物細胞膜上的脂質過氧化被認為是需氧生物遇到氧化應激時細胞受損的主要機制之一。自由基攻擊肝脂質膜中不飽和脂肪酸的雙鍵,造成脂質過氧化,導致細胞器和細胞膜結構改變并引發功能障礙。同時,它也為體內進一步的過氧化反應連續不斷地提供自由基[14]。在本研究中將上述自由基作為研究抗氧化活性的指標,由表1可知,<10000u的2個超濾液組分與原液相比清除這些自由基的能力均有所提高;其中,<4000u超濾液對這些自由基的清除效果最好,且與原液和>10000u的組分均存在著顯著性差異(p<0.05)。
還原力是衡量抗氧化劑供電子能力的指標。由圖1可知,原液和各超濾組分的還原力都是隨著濃度的增加而增加,且相同的濃度下的<4000u超濾液的還原力最高,其次是4000~10000u超濾液、原液和>10000u超濾液。
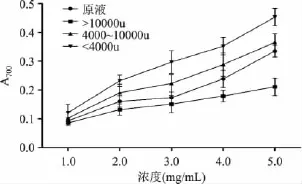
圖1 超濾對還原力的影響Fig.1 The effect of ultrafiltration on reducing power

表2 氨基酸組成(mmol/mL)Table 2 Amino acid composition(mmol/mL)

表3 超濾液中各組分的分子量分布及羥自由基清除活性Table 3 Distribution of MW and Hydroxyl radical scavenging activity of ultrafiltrate
類似地,劉成梅等[15]對羅非魚魚皮蛋白酶解液進行超濾處理,0.80mg/mL超濾液和0.03mg/mL抗壞血酸清除H2O2的能力相當;李琳等[16]采用連續串聯超濾技術對鳙魚蛋白酶解物進行分離,56.7%的肽段留在此濾過液中,且濾過物的抗氧化活性強于原酶解液;Zhou等[17]利用超濾膜截流玉米蛋白的中性蛋白酶酶解液得到的4個組分中以分子量為1~3ku的組分抑制脂質過氧化的活性最強。諸多實驗證實,超濾處理對大多數具有較強活性的肽段有濃縮作用。
2.2 氨基酸分析
抗氧化肽的活性與氨基酸組成、結構和疏水性密切相關[18]。酪氨酸、色氨酸、甲硫氨酸、賴氨酸、半胱氨酸和組氨酸等氨基酸可引起抗氧化活性[19]。芳香族氨基酸可以為失電子的自由基提供電子[20]。含有組氨酸的肽,其抗氧化活性與提供氫離子、吸附脂質過氧化氫自由基和咪唑基的螯合能力有關[21]。半胱氨酸的巰基由于可以直接與自由基作用因而具有抗氧化活性[22]。一般,富含組氨酸、脯氨酸、甲硫氨酸、半胱氨酸、酪氨酸、色氨酸及苯丙氨酸的肽鏈可能具有較高的抗氧化活性[3]。根據表2數據計算上述7種氨基酸在各自樣品中的含量,在原液和<4000u的超濾液中分別為18.1%和21.2%,說明這些氨基酸經過超濾處理有了一定的富集。前面的抗氧化實驗結果表明經過超濾處理抗氧化活性的提高,具有活性的物質得到了濃縮,這可能與這些氨基酸含量的升高有關。
2.3 凝膠層析
凝膠過濾層析是根據分離物質分子量大小不同而達到分離效果的一種色譜方法。將<4000u超濾液上柱分離,在280nm處測定接收液吸光度,繪制洗脫曲線,見圖2。由圖2可以看出,層析圖譜上有4個明顯的洗脫峰。組分1洗脫峰出現在洗脫開始第46管左右的收集液中,組分2洗脫峰出現在洗脫開始第57管左右的收集液中,組分3洗脫峰出現在洗脫開始第68管左右的收集液中,組分4洗脫峰出現在洗脫開始第77管左右的收集液中,且各組分沒有重疊,說明Sephadex G-25柱層析可將各組分分離。由于組分3和組分4無法測出可溶性蛋白,而且根據分子量標準曲線計算其分子量極低,可知它們為雜峰,因此不予以考察。分別合并39至50管,51管至62管。根據回歸方程計算得各組分的分子量范圍,測定可溶性蛋白濃度,檢測羥自由基清除活性求IC50值,如表3所示。由表3可知,超濾液的組分1對羥自由基清除活性的IC50值為13.59mg/mL,占超濾液的39.59%,主要是一些小分子蛋白質和肽類。超濾液的組分2對羥自由基清除活性的 IC50值為20.82mg/mL,占超濾液的26.12%,主要是一些肽類和氨基酸。

圖2 超濾液的Sephadex G-25凝膠過濾洗脫曲線Fig.2 Elution curve of enzymatic hydrolysate with gel filtration on Sephadex G-25
3 結論
牡蠣蛋白酶解液經超濾處理后,具有抗氧化能力的組分得到了濃縮。可能的原因是超濾后組氨酸、脯氨酸、甲硫氨酸、半胱氨酸、酪氨酸、色氨酸及苯丙氨酸等對抗氧化肽活性影響較大的七種氨基酸的含量得到了富集。<4000u的超濾液經Sephadex G-25分離及分子量分析,結果表明具有抗氧化活性的部分主要集中在550~3890u。經超濾處理后的牡蠣蛋白酶解液仍為混合物,建議下一步工作應分離并收集一系列單體化合物,以便專門研究結構與構效關系,對抗氧化能力較高的肽段氨基酸序列作進一步分析和研究。
[1]農業部漁業局.中國漁業年鑒[M].北京:中國農業出版社,2010:175.
[2]Linehan LG,O’Connor TP,Burnell G.Seasonal variation in the chemical composition and fatty acid profile of Pacific oysters(Crassostrea gigas)[J].Food Chemistry,1999,64(2):211-214.
[3]Chalamaiah M,Kumar BD,Hemalatha R,et al.Fish protein hydrolysates:proximate composition,amino acid composition,antioxidant activities and applications:a review[J].Food Chemistry,2012,135(4):3020-3038.
[4]Castel V,Andrich O,Netto FM,et al.Comparison between isoelectric precipitation and ultrafiltration processes to obtain Amaranth mantegazzianus protein concentrates at pilot plant scale[J].Journal of Food Engineering,2012,112(4):288-295.
[5]Li Y,Jiang B,Zhang T,et al.Antioxidant and free radicalscavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chemistry,2008,106(2):444-450.
[6]Wu HC,Chen HM,Shiau CY.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Research International,2003,36:949-957.
[7]Sánchez-Moreno C,Larrauri JA,Saura-Calixto F.Free radical scavenging capacity and inhibition of lipid oxidation of wines,grape juices and related polyphenolic constituents[J].Food Research International,1999,32(6):407-412.
[8]Srivastava A,Harish SR,Shivanandappa T.Antioxidant activity of the roots of Decalepis hamiltonii(Wight& Arn.)[J].LWT-Food Science and Technology,2006,39(10):1059-1065.
[9]張澤生,賀偉,劉甜甜,等.白藜蘆醇的體外抗氧化活性[J].食品科學,2012,33(11):266-268.
[10]郝更新,章超樺,曹文紅.蝦頭內源酶酶解物的ACE抑制活性分析[J].食品與發酵工業,2007,33(12):20-22.
[11]Sasipriya G,Siddhuraju P.Effect of different processing methods on antioxidant activity of underutilized legumes,Entada scandens seed kernel and Canavalia gladiata seeds[J].Food and Chemical Toxicology,2012,50:2864-2872.
[12]O’Sullivan AM,O’Callaghan YC,O’Grady MN,et al.In vitro and cellular antioxidant activitiesofseaweed extracts prepared from five brown seaweeds harvested in spring from the west coast of Ireland[J].Food Chemistry,2011,126:1064-1070.
[13]Sasipriya G,Siddhuraju P.Effect of different processing methods on antioxidant activity of underutilized legumes,Entada scandens seed kernel and Canavalia gladiata seeds[J].Food and Chemical Toxicology,2012,50:2864-2872
[14]Adefegha SA,Oboh G.In vitro inhibition activity of polyphenol- rich extracts from Syzygium aromaticum(L.)Merr.&Perry(Clove)buds against carbohydrate hydrolyzing enzymes linked to type 2 diabetes and Fe2+-induced lipid peroxidation in rat pancreas[J].Asian Pacific Journal of Tropical Biomedicine,2012,2:774-781.
[15]劉成梅,梁漢縈,劉偉,等.羅非魚魚皮多肽的超濾分離及其抗氧化活性研究[J].食品科學,2008,29(5):227-230.
[16]李琳,趙謀明,孫莉娜.連續串聯超濾對鳙魚酶解物抗氧化活性的影響[J].中國食品學報,2009,9(5):29-34.
[17]Zhou K,Sun S,Canning C.Production and functional characterisation of antioxidative hydrolysates from corn protein via enzymatic hydrolysis and ultrafiltration[J].Food Chemistry,2012,135(3):1192-1197.
[18]Chen HM,Muramoto K,Yamauchi F,et al.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,1998,46:49-53.
[19]Wang WY,De Mejia EG.A new frontier in soy bioactive peptides that may preventage - related chronic diseases[J].Comprehensive Reviews in Food Science and Food Safety,2005,4:63-78.
[20]Rajapakse N,Mendis E,Jung WK,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38:175-182.
[21]Chan KM,DeckerEA.Endogenousskeletalmuscle antioxidants[J].Critical Reviews in Food Science and Nutrition,1994,34:403-426.
[22]Qian ZJ,Jung WK,Kim SK.Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin,Rana catesbeiana Shaw[J].Bioresource Technology,2008,99:1690-1698.

