一株酯化功能菌分離鑒定及酶學特性研究
郭明遺,霍丹群,* ,侯長軍,王洪彬,唐玉明,任道群,鄧 波,盧中明,
(1.重慶大學生物工程學院,重慶400044;2.四川省瀘州市釀酒科學研究所,四川瀘州646000;3.國家固態釀造工程技術研究中心,瀘州老窖股份有限公司,四川瀘州646000)
我國釀酒歷史悠久,工藝獨特,在世界釀酒史上獨樹一幟。中國白酒年銷售收入上千億元,濃香型白酒屬于中國白酒四大香型之一,其產量在幾大香型白酒中名列前茅,其銷售量占全國白酒總量的70%左右[1]。己酸乙酯是濃香型白酒中最重要的主體香味成分,其含量高低與酒的風味和質量密切相關。利用微生物的酯化功能來提高酒中酯含量的研究與應用是近年來釀酒行業的熱點[2-5]。紅曲霉是非常重要的釀酒有益菌群,按真菌學的分類方法,紅曲霉錄屬于真菌門(Eumycophyta),子囊菌綱(Ascomycetes),真子囊菌亞綱(Euascomycetes),散子囊菌目(Eurotiales),紅曲菌科(Monascaceae),紅曲霉屬(Monascus)[6],所產酯化酶具有較強的催化己酸乙酯合成能力,是濃香型白酒釀造中一類重要的酯香菌種[7-8]。老窖出好酒,原因之一是釀酒微生物經長期馴化后,優良釀酒特性得到了很好的積淀和增強。傳統的釀酒微生物分類鑒定主要集中在觀察其形態和習性的水平,生理生化特征、培養特征、生態特征等方法[9-12]。使得中國傳統固態釀酒微生物研究水平尚低,釀酒機理研究解釋不足。隨著分子生物學技術的深入發展及其在分類鑒定中的應用[13-18],如DNA 信息分析法(尤其是ITS(ITS1-5.8SrDNAITS2))分析[19-23],依托功能強大的生物信息學數據庫,利用計算機進行數據分析,自動化和標準化程度高,大大簡化了鑒定程序,為菌株的快速、準確、簡便鑒定、以及利用提供了新型研究手段,將從根本上提升釀酒微生物菌種的分類鑒定與菌株區分,從而提升傳統行業的科技水平,推動發酵工業領域發展。本研究對得到的優良釀酒功能菌分類鑒定,酶學特性分析,以期對具有中國傳統特色的白酒釀造窖池中的微生物資源進行挖掘與保護,為進一步研究功能菌、利用功能菌、優化生產奠定基礎。
1 材料與方法
1.1 材料與儀器
酯化功能菌LZLJ 2103,分離篩選自瀘州老窖“1573 國寶窖池”。經實際應用生產實驗,顯示具有較強的己酸乙酯酯化能力,酯化力約為目前生產用低溫曲和次高溫曲的2.1 倍、高溫曲的12.5 倍。
MyCycler PCR 儀 美 國 Bio - Rad 公 司;GelDocXR 核酸/蛋白凝膠圖像分析管理系統 美國Bio-Rad 公司;GenomeLab GeXP(測序)分析系統 美國貝克曼庫爾特有限公司;VEGA3 XMH 掃描電子顯微鏡 捷克TESCAN 公司。
1.2 實驗方法
1.2.1 菌體培養 麥芽汁瓊脂(Wa)培養基,30℃,平皿培養7d,觀察菌絲體及菌落形態。麥芽汁培養基,30℃,120r/min,培養4d,過濾收集菌絲,用PBS 緩沖液沖洗3 次,紗布吸干殘余水分,-20℃保存備用。
1.2.2 形態觀察 平板培養,對菌落整體特征進行觀察鑒定。并挑取培養后長勢良好的菌絲體,固定于潔凈的硅片上,真空冷凍干燥,鍍金[24],采用VEGA3 TESCAN 掃描電子顯微鏡觀察。
1.2.3 總酯的皂化法測定 取50.00mL 樣液于250mL 回流瓶中,加兩滴酚酞指示劑,以NaOH 標準滴定溶液滴定至粉色,記錄消耗NaOH 標準滴定溶液的毫升數。再準確加入NaOH 標準滴定溶液25.00mL,搖勻,放入3 顆沸石,裝上冷凝管,于沸水浴上回流30min,取下,冷卻。將樣液移入100mL 燒杯中,用10mL 水分次沖洗回流瓶,洗液并入燒杯。插入電極,放入一枚轉子,置于電磁攪拌器上,開始攪拌,滴加硫酸標準滴定溶液,當pH9.00 后,放慢滴定速度,每次滴加半滴溶液直至pH8.70 為其終點,記錄消耗硫酸標準溶液的體積。同時,吸取乙醇(無酯)溶液50.00mL,按同樣操作做空白實驗。計算出總酯含量。
1.2.4 酯化酶活力的測定 取25mL 酶液,加0.3mL己酸、3mL 無水乙醇、1.7mL 純水(pH7.0),37℃酯化7d,采用皂化法測定總酯[25],計算出酶活力。
1.2.5 菌株所產酯化酶最適溫度的測定 設定反應溫度為10、20、30、40、50、60℃溫度梯度。測定不同溫度下的酶活力,以確定最適作用溫度。以最高酶活為對照記做100%。(每個梯度設置3 組重復)
1.2.6 菌株所產酯化酶最適pH 的測定 采用磷酸鹽(磷酸氫二鈉-檸檬酸緩沖體系、磷酸二氫鈉-磷酸二氫鉀緩沖體系),調節酶液與底物反應體系pH 分別為3.0、4.0、5.0、6.0、7.0、8.0,于最適作用溫度下,測定不同pH 下的酶活力,以確定最適作用pH。以最高酶活為對照記做100%。
1.2.7 金屬離子對菌株所產酯化酶活力的影響 在酶液中添加Na+、K+、Ca2+、Fe2+、Cu2+、Mg2+各金屬離子,使體系中各金屬離子終濃度為1mmol·L-1,最適溫度、pH 條件下,測定酶活性。以未加金屬離子的酶活性為100%,比較得出金屬離子的影響程度。
1.2.8 菌絲體基因組DNA 的提取及ITS 序列擴增 取菌絲體,液氮研磨后,采用改進的氯化芐法[26]提取基因組DNA,PCR 擴增ITS(ITS1-5.8SrDNA-ITS2)序列,1.5% 瓊脂糖凝膠200V、15min 電泳,Glodview核酸染料染色紫外檢測。擴增引物:通用引物ITS1 primer(5' - TCCGTAGGTGAACCTGCGG - 3')、ITS4 primer(5'- TCCTCCGCTTATTGATATGC-3')。PCR反應體系(25μL):DNA 模板3.0(L、10(PCR buffer 2.5μL、d-NTP mix 1.0μL 上游引物0.5μL、下游引物0.5μL、Tap 聚合酶0.5μL、雙蒸水17.0μL。反應程序:95℃預變性5min;94℃變性30s,55℃退火30s,72℃延伸2min,35 個循環;72℃補平10min。
1.2.9 序列測定、比對及系統發育分析 純化后的PCR 產物,經TA 克隆后,采用GenomeLab GeXP 分析系統測序。對測得的供試菌的ITS 序列,用NCBI GeneBank 數據庫BLAST 工具軟件在DNA 序列數據庫中搜索同源DNA 序列進行比對分析,選取與供試菌株親緣關系相近的代表菌株用ClustalX2.0 和DNAMAN 軟件進行比對分析,用Mega5 軟件構建NJ(Neighbor-joining)系統樹,同時采用DNAstar 軟件進行系列間距離系數的計算。
2 結果與討論
2.1 培養性狀及形態特征
在Wa 培養基上,30℃,7d 菌落直徑12~22mm,平坦,稀疏至豐厚,表面質地呈叢卷毛狀,淡玫瑰粉色[27],有輻射紋;氣生菌絲體初白色隨菌落成熟而變成粉紅色,絮狀;菌絲不規律地分枝,寬度3~5μm,個別菌絲粗壯,菌絲體頂端著閉囊殼,直徑15~30μm,分子孢子罕見,子囊孢子無色、卵形;菌落表面具有小而清楚的橙色滲出液;正反面具有差別,背面褶皺,燕頷紅[26]。
2.2 PCR 產物克隆測序結果
測得ITS 序列長度為579bp,提交NCBI 中的GeneBank 獲得Accession number 為JN869464,詳細序列信息為 Internal transcribed spacer 1 + 5.8S ribosomal RNA gene +Internal transcribed spacer 2,其序列如下:
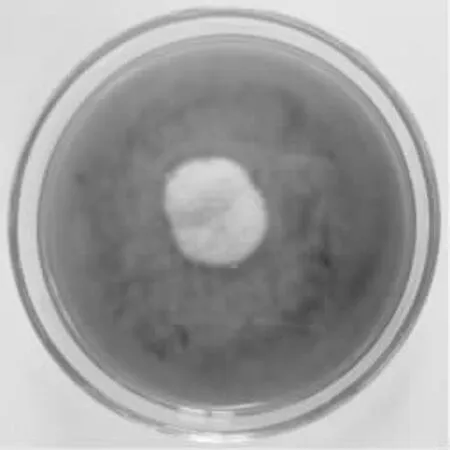
圖1 LZLJ 2103 菌株菌落形態Fig.1 Colonial morphology of LZLJ 2103
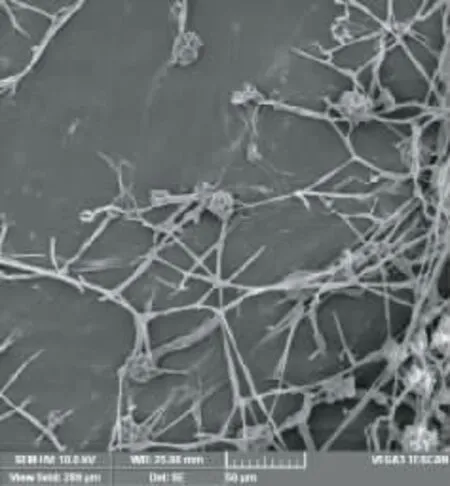
圖2 LZLJ 2103 菌株掃描電鏡圖譜Fig.2 Scanning electron micrograph of strain LZLJ 2103

2.3 系統發育分析
通過Blast 程序與GeneBank 中核酸序列進行比對分析,結果顯示LZLJ 2103(GenBank:JN869464)與紅曲霉屬Monascus spp.普遍具有較高的同源性。篩選的Monascus 屬典型菌株用于系統發育分析(表1)。rDNA ITS 序列相似性>95%,可初步鑒別為相同屬;序列相似性≥99.5%,可初步鑒定為相同種[28]。DNAstar 分析(圖3)顯示LZLJ 2103 ITS 序列與DQ978997.1 和HQ158608.1 相似性最高(≥99.5%),離散度小于0.5%。(G +C)%含量分別為57.34%、57.17%、57.17%,三者間有3 個堿基的差異。同時,結合進化樹(圖4)分析可以看出,該菌與HQ158608.1處于同一分支,與其發育關系最近。
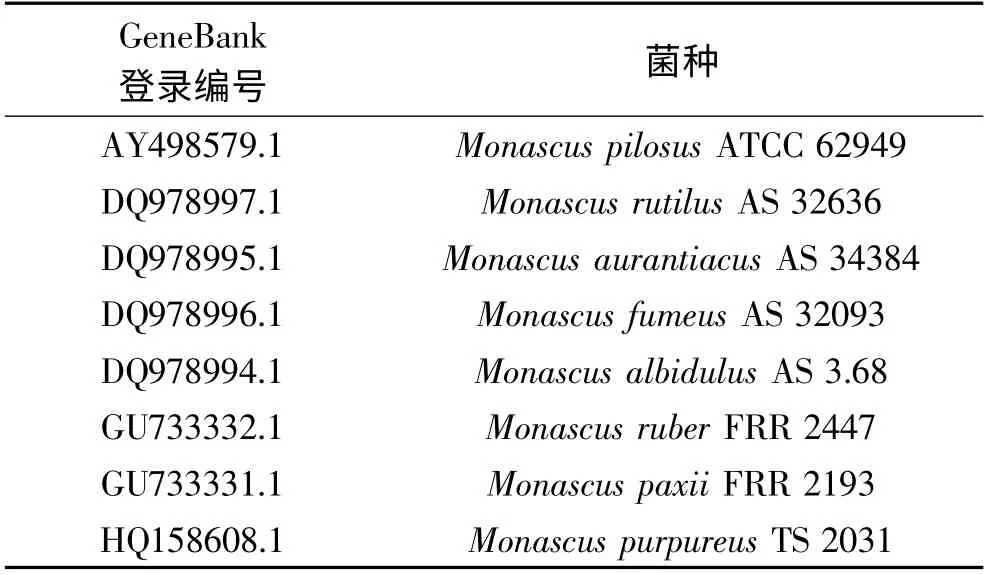
表1 用于系統發育分析的典型菌種Table 1 Names and accession numbers of strains used for phylogenetic analysis
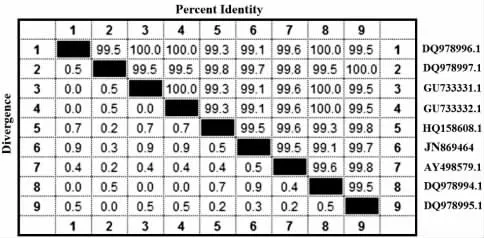
圖3 基于ITS 序列的距離矩陣Fig.3 Distance matrix of LZLJ 2103 based on sequence of ITS
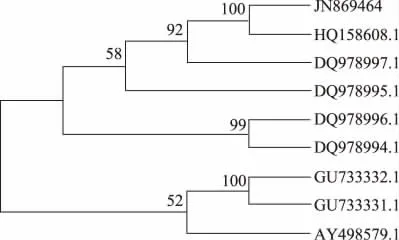
圖4 基于ITS 序列的系統進化樹Fig.4 Phylogenetic tree of LZLJ 2103 based on sequence of ITS
2.4 菌株所產酯化酶的酶學特性
2.4.1 最適作用溫度的測定 測定菌株LZLJ 2103 所產酯化酶與底物在不同反應溫度下的酶活力,如圖5所示。表明該酯化酶在20~40℃時活力較高,在40℃時達到最高,為該酶最適作用溫度。(p <0.05)
2.4.2 最適作用pH 的測定 pH 可改變酶構象,引起酶分子中活性中心結構變化,從而改變酶活力。圖6 酶活力結果表明,在偏酸性環境下該酶活力較高,反應的適宜pH 范圍為4.0~6.0,pH 為5.0 時,酶酯化活力最高。(p <0.05)
2.4.3 金屬離子的影響 金屬離子可以參與結合酶的活性部分,從而影響酶活。金屬離子對菌株所產酶化酶活力影響見圖7。結果顯示金屬離子Na+、K+、Mg2+、Fe2+對該酶有明顯的促進作用,而Ca2+、Cu2+對該酶有抑制作用。
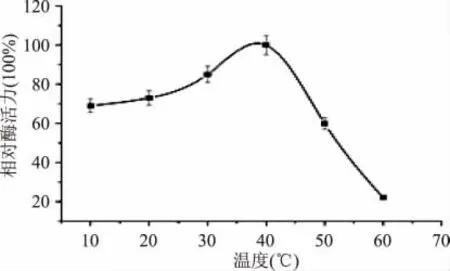
圖5 溫度對酶活力的影響Fig.5 Effect of temperature on esterifying activity of the crude esterase from LZLJ 2103
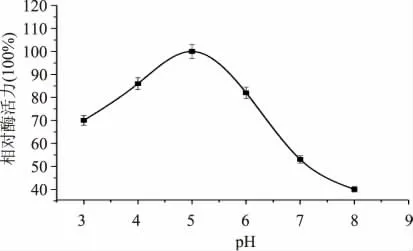
圖6 pH 對酶活力的影響Fig.6 Effect of pH on esterifying activity of the crude esterase from LZLJ 2103
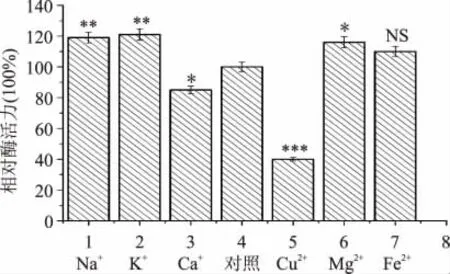
圖7 金屬離子對酶活力的影響Fig.7 Effect of metal ions on esterifying activity of the crude esterase from LZLJ 2103
3 結論
優良酯化功能菌LZLJ 2103 在麥芽汁瓊脂培養平皿上形成菌落形態特征與Monascus purpureus 類菌在麥芽汁培養基條件下的菌落特征相似[29]。對LZLJ 2103 的ITS 序列進行分子解析,遺傳距離矩陣分析顯示,LZLJ 2103 與Monascus purpureus 類典型菌種具有較高的同源性,且進化距離離散度為1%以下;同時進化樹結果顯示處于同一分支。因此,根據形態學特征支持以及分子解析結果,基本可以判斷LZLJ 2103 菌株為Monascus 屬purpureus 種的一株新型優良菌株,命名為Monascus purpureus LZLJ 2103。
菌株LZLJ 2103 所產酯化酶酶學特性研究表明,最適作用溫度為40℃;最適作用pH 為5.0;金屬離子Na+、K+、Mg2+、Fe2+對該酶有明顯的促進作用,而Ca2+、Cu2+對該酶有抑制作用。無機離子是微生物生長不可缺少的營養元素,在制曲、發酵生產中,兼顧總體平衡下,適當添加有益無機鹽,控制不利因素,積極為重要功能有益菌創造最適生長條件和產酶條件,促進酯化生香,可能將對提高發酵產品質量方面提供積極的作用。
對該菌的鑒定和特性分析,為開發利用這一新型的發酵功能菌資源提供了基礎數據,能為生產應用提供一定的指導。對酯化功能微生物的功能基因解析,調控模式分析,代謝通路的剖析等,有待進一步研究。
[1]中國白酒市場投資分析及前景預測報告2009-2012.中國經濟信息網.http: //www.cei.gov.cn/.
[2]LiC,Lin S,Wei Z,Wu Y.Alcohol maturing method comprises using ferment with esterifying function to esterify the alcohol,where esterifying reaction is carried out in supercritical carbon dioxide environment to reduce the maturing time:CN,101591612-A[P].2009-12-02.
[3]方春玉,周健,吳華昌,等.高酯化力低產桔霉素的紅曲霉誘變育種的研究[J].食品工業科技,2011,32(5) :203-205.
[4]方躍進.酯化紅曲在濃香型白酒生產中的應用及實例[J].釀酒,2011,38(2) :75-78.
[5]王牛牛,雷振河,呂利華,等.以紅曲霉酯化酶催化合成乳酸乙酯[J].食品工業科技,2011,37(1) :73-77.
[6]郭紅珍,楊潞芳.紅曲霉的研究進展[J].中國食品添加劑,2003(3) :61-63.
[7]任道群,唐玉明,姚萬春,等.濃香型酒酯化酶工程的研究及其應用[J].釀酒,2009,36(4) :36-37.
[8]李鐘慶,楊曉暾,郭芳.綜觀紅曲與紅曲菌[M].北京:中國輕工業出版社,2009:1-80.
[9]周德慶.微生物學教程[M].第二版.北京:高等教育出版社,2002:338-368.
[10]李紅,張磊,張文學,等.一株高產酒精酵母菌的篩選及特性研究[J].中國釀造,2010,215(2) :91-93.
[11]岳元媛,張文學,劉霞,等.濃香型白酒窖泥中兼性厭氧細菌的分離鑒定[J].微生物學通報,2007,34(2) :251-255.
[12]陜小虎.中國固態白酒中釀酒微生物研究進展[A].經濟發展方式轉變與自主創新——第十二屆中國科學技術協會年會( 第三卷) [C].中國福建: 中國科學技術協會學會,2011:1-6.
[13]盛偉,方曉陽,潘傳奇.核糖體RNA 基因在蕈菌分子系統學研究中的應用[J].食品科學,2008,29(6) :453-456.
[14]侯軍,林曉民,江蕓,等.基于ITS 序列分析對疑似白羊肚菌株的分子鑒定[J].食品科學,2009,30(5) :141-144.
[15]謝麗源,張勇,鄧科君,等.基于rDNA ITS 序列分析的桑黃真菌菌株分子鑒定[J].食品科學,2010,31(9) :182-186.
[16]Bogomolova T S,PITSIK E V,Mikhaylova Y V,et al.Molecular identification of Malassezia species by rDNA sequencing[J].Mycoses,2011,54(2) :129-130.
[17]Aditya K G,Teun B,Bart T,et al.Identification and Typing of Malassezia Species by Amplified Fragment Length Polymorphism and Sequence Analyses of the Internal Transcribed Spacer and Large-Subunit Regions of Ribosomal DNA[J].Journal of Clinical Microbiology,2004,42(9) :4253-4260.
[18]Ahmed M,Singh M,Bera A,et al. Molecular basis for identification of species/isolates of gastrointestinal nematode parasites[J].Asian Pacific Journal of Tropical Medicine,2011,4(8) :589-593.
[19]Jànos V,Beàta T,Krisztina R,et al.Phylogenetic analysis of Aspergillus section Circumdato based on sequences of the internal transcribed spacer regions and the 5.8S rRNA gene[J].Fungal Genetics and Biology,2000,30(1) :71-80.
[20]Chen Y Q,WangN,Qu L H,et al.Determination of the anamorph of Cordyceps sinensis inferred from the analysis of the ribosomal DNA internal transcribed spacers and 5.8S rDNA[J].Biochemical Systematics and Ecology,2001,29(6) :597-607.
[21]Chen X Y,Qi Y D,Wei J H,et al.Molecular identification of endophytic fungi from medicinal plant Huperzia serrata based on rDNA ITS analysis[J].World Journal of Microbiology &Biotechnology,2011,27(3) :495-503.
[22]Hanssen F,Wischnewski N,Moreth U,et al. Molecular Identification of Fitzroya Cupressoides,Seqoia Sempervirens,and Thuja Plicata Wood Using Taxon-specific rDNA-ITS Primers[J]. Iawa Journal,2011,32(2) :273-284.
[23]Hesham A E - L,Mohamed H M. Molecular Genetic Identification of Yeast Strains Isolated from Egyptian Soils for Solubilization of Inorganic Phosphates and Growth Promotion of Corn Plants[J].Journal of Microbiology and Biotechnology,2011,21(1) :55-61.
[24]Merritt S,David E,Wilford M H,et al.An endophytic Gliocladium sp.of Eucryphia cordifolia producing selective volatile antimicrobial compounds[J]. Plant Science,2003,165 ( 4) :913-922.
[25]中華人民共和國國家標準.白酒分析方法[S].GB/T 10345-2007.
[26]劉艷梅,朱建蘭,楊航宇.曲霉基因組DNA 提取方法研究[J].西北農業學報,2009,18(2) :55-58.
[27]全國信息與文獻標準化技術委員會出版物格式分技術委員會.設計與印刷國家標準色譜[M].遼寧: 遼寧科學技術出版社,2009:2-50.
[28]Renske L,Paula L,Thomw K,et al.Molecular identification of ectomy-corrhizal myceliumin soil horizons[J].Applied and Environ-mental Microbiology,2003,69(1) :327-333.
[29]李忠慶,郭芳.紅曲菌的形態與分類學[M].北京:中國輕工業出版社,2003:1-65.

