左旋多巴合成研究進展
馬強強,趙廣榮
(天津大學化工學院系統生物工程教育部重點實驗室,天津 300072)
左旋多巴(L-DOPA)化學名為β-3,4-二羥苯 基-α-丙氨酸(3,4-2dihydroxylphenylalanine)[圖1(a)],又名3-羥基-L-酪氨酸,為白色結晶性粉,無臭無味,不溶于乙醇、氯仿和丙酮,易溶于稀酸。左旋多巴為前體藥物,其作用機理為左旋多巴能通過血腦屏障,到達中樞神經系統,在脫羧酶的作用下,轉變為多巴胺[圖2(b)],進而發揮治療帕金森綜合癥的作用[1]。左旋多巴于1970年被美國食品藥品監督管理局批準為治療帕金森綜合癥的藥物[2],在2007年世界暢銷藥中排名第100名,2008年銷售金額突破9000萬美元。左旋多巴具有廣闊的市場前景[3]。
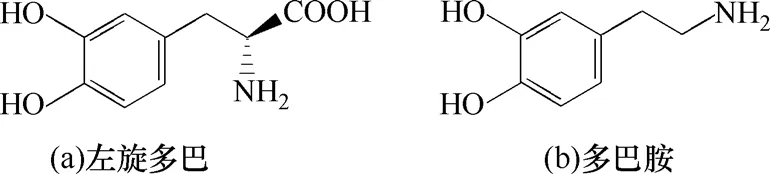
圖1 左旋多巴和多巴胺分子結構
目前左旋多巴的制備方法主要有化學合成、植物提取、生物酶催化以及微生物發酵。由于化學合成和植物提取方法具有一定的局限性。20 世紀60年代末,國內外一些學者開始探索生物酶法合成左旋多巴。日本學者Yamada 等[4]通過菌種選育及發酵條件的優化合成左旋多巴,其研究成果已用于工業化生產。彭珍榮等[5]在國內開展微生物法合成左旋多巴方面的研究。左旋多巴的產量已經達到了250 t/a,微生物酶法合成左旋多巴的生產效率已達到11.1 g/(L·h)[6]。本文重點針對生物酶催化和微生物發酵生產左旋多巴的研究進行評述,并對左旋多巴合成的研究方向進行了展望。
1 化學合成左旋多巴
1911年Funk C 首次利用3,4-碳酰二氧苯甲醛為原料合成左旋多巴[7]。左旋多巴中含有一個不對稱碳原子,因此在合成的過程中有必要保持其較高的旋光值。Knowles[8]發現雙膦配體 DiPAMP(phospHine ligand DiPAMP)的催化氫化,可以取得較高的對映選擇性,而且DiPAMP 第一次在脫氫氨基酸的不對稱氫化取得了大于95%ee的高對映選擇性,隨后該思路應用于左旋多巴的不對稱合成,并且得到了97.5%ee 的左旋多巴。王偉文等[9]成功以愈創木酚為原料,經過八步合成反應得到多巴,且具有較高的純度與收率(圖2)。
目前,工業化生產左旋多巴多以香草醛和乙內酰脲為原料,經過8 步的反應制得。盡管目前商品化左旋多巴主要通過不對稱法合成,但化學合成過程中需要大量的金屬催化物,并且過程繁雜,產物的轉化效率和旋光活性均較低,同時具有成本高、環境污染嚴重等問題[10]。所以開發新的合成方法和思路是今后研究的重點和方向。
2 天然植物中提取左旋多巴
天然植物中存在左旋多巴。1913年生物化學家Guggenheim 從蠶豆中提取得到左旋多巴。之后在很多植物中均發現存在左旋多巴,如貓豆、藜豆 等[11],其中貓豆中的左旋多巴含量最高達到6%~9%,是提取左旋多巴最主要的原料。通過改良提取技術,使得貓豆中左旋多巴的提取得率,從1.5%已提高到3.4%,純度達到99.9%[12]。雖然從植物中直接提取左旋多巴是目前的一種方法,但是由于受到原料來源的限制,并且提取步驟繁雜,產量小,遠不能滿足市場需求。
3 生物酶轉化合成左旋多巴
生物酶轉化法主要以L-酪氨酸或酚類物質為底物,通過來源于微生物的酶體外制取左旋多巴。目前已報道3 種酶可以催化多巴的生成:①酪氨酸酚解酶,該酶以鄰苯二酚、氨水以及丙酮酸為底物;②酪氨酸酶,該酶以酪氨酸為底物,羥化酪氨酸生成左旋多巴;③轉氨酶,該酶將來源于天冬氨酸或谷氨酸上的氨基轉移至3,4-二羥基苯丙酮酸,生成左旋多巴。
3.1 酪氨酸酚解酶法合成
酪氨酸酚解酶(tyrosine phenol lyase,TPL)(EC 4.1.99.2)可催化苯酚、丙酮酸和氨水生成酪氨酸,該反應為可逆反應。若將苯酚置換成鄰苯二酚,該酶即可催化生成左旋多巴(圖3),催化反應過程中需要磷酸吡哆醛(胺)為輔酶、鉀離子和氨離子為輔因子[13]。該酶廣泛存在于多種微生物中,如假單胞菌屬[14]、真菌[15]、鏈霉菌[16]等,其中草生歐文氏菌(Erwinia herbicola),弗氏檸檬酸菌(Citrobacter freundii)中的酪氨酸酚解酶活性較高。
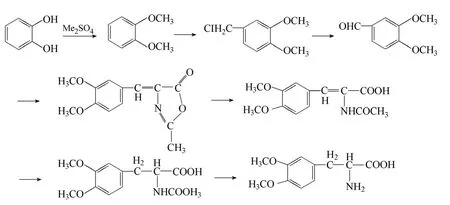
圖2 以愈創木酚為原料合成多巴
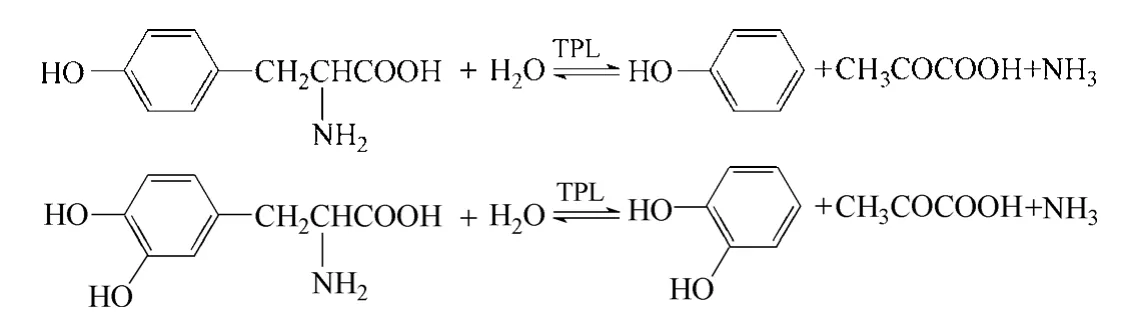
圖3 酪氨酸酚解酶催化合成左旋多巴
Lee 等[17]用來源于Symbiobacterium sp. SC-1 的酪氨酸酚解酶(TPL),將鄰苯二酚、丙酮酸和氨轉化為左旋多巴。反應15 h 以后,左旋多巴的產量可以達到65 g/L,收率可達到92%。上述催化體系中,當鄰苯二酚及丙酮酸的濃度較高時會對TPL 產生抑制作用甚至不可逆失活,在發酵體系中加入一些硼酸根離子可以減輕鄰苯二酚對酶的抑制作用[18]。然而該催化體系存在一些缺點[19],反應時間長、轉化效率不高、分離成本高、原料比較昂貴。
3.2 酪氨酸酶法合成
酪氨酸酶(tyrosinase)以酪氨酸直接作為底物,催化合成左旋多巴(圖4)。該酶同時具有單酚氧化酶和二酚氧化酶氧化還原作用,其中單酚氧化酶催化單酚羥基化,二酚氧化酶可將二酚類化合物氧化為醌類化合物。Krishnaveni 等[20]利用真菌Acremonium rutilum 轉化酪氨酸合成左旋多巴,該菌具有較高的酪氨酸酶生產能力,經過優化培養條件后,連續培養120 h,最大產量是0.89 mg/mL。Ho 等[21]將來源于蘑菇的酪氨酸酶通過固定化的方法轉化合成左旋多巴。酪氨酸酶用聚苯乙烯-聚酰胺苯乙烯(PSNH)和聚甲基氯苯乙烯(PSCL)固定,催化的最適pH 值和最適溫度分別為5.5 和60 ℃、3.0 和70 ℃。反應36 h 后,兩種固定化方式催化生成左旋多巴的產率分別為1.44 mg/(L·h)和2.33 mg/(L·h)。這兩種固定方式中,PSCL 上的酪氨酸酶穩定性明顯高于PSNH。Ates 等[22]將酪氨酸酶固定 于含銅離子的海藻酸鈉中,運用填充床酶法的方法生產左旋多巴,產量達1.2 mg/L。若在反應體系中引入空氣,左旋多巴產量可以提高6.4 倍,左旋多巴生產效率達到110 mg/(L·h)。然而這一過程需要耗費大量還原劑,同時產物左旋多巴不容易分離。

圖4 酪氨酸酶催化酪氨酸合成L-DOPA
由于酪氨酸酶具有二酚氧化還原酶的活性,會將左旋多巴繼續氧化生成多巴醌,為防止左旋多巴被氧化,可以引入化學還原劑,如抗壞血酸[21,23],NADH 或者羥胺[24],向多巴醌供應電子使其重新還原為左旋多巴。Mina 等[25]對這一方法進行了改進,將酪氨酸酶包被組成酪氨酸酶-碳納米-多吡咯電極,由電極供應還原多巴醌的電子,左旋多巴的產率提高95.9%,達到27 mg/(L·h)。
3.3 轉氨酶法合成
轉氨酶(transaminase)可將L-天冬氨酸或L-谷氨酸中的氨基轉移到3,4-二羥基苯丙酮酸上,進而生成左旋多巴(圖5)。Sandler 等[26]認為在左 旋多巴中轉氨基作用是非常重要的一步。隨后Nagasaki 等[27-28]研 究 了 Enterobacter cloacae NB320,Alcaligenes faecalis 轉氨基作用生成左旋多巴的能力。然而由于轉氨作用存在諸多問題,隨后相關利用轉氨酶生成左旋多巴的研究比較少見。
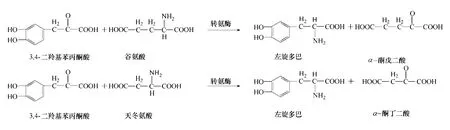
圖5 轉氨基作用合成多巴
4 代謝工程策略合成左旋多巴
李華鐘等[29-30]將來源于Citrobacter freundii 的酪氨酸酚解酶基因導入大腸桿菌中進行異源表達,并對發酵培養基進行了優化。優化的反應體系中添加了底物丙酮酸,鄰苯二酚及0.1%EDTA,0.2%亞硫酸鈉。氨水調節pH=8,15 ℃反應16 h,左旋多巴的產量可達15.36 g/L。Katayama 等[4,31]對Erwinia herbicola 進行代謝工程改造,合成左旋多巴。他們發現TyrR 是酪氨酸酚解酶基因的轉錄激活因子,通過隨機突變篩選得到TyrR 突變體TyrV67A Y72C E201G,提高酪氨酸酚解酶基因的表達量,進而提高左旋多巴的生成。發酵末期左旋多巴產率由0.357 g/(L·h)提高到了11.l g/(L·h)。Kurt 等[32]將來源于Vitreoscilla 血紅素基因導入Citrobacter freundii 和Erwinia herbicola 中,左旋多巴的產量分別由未導入之前的30.4 mg/L 和33.8 mg/L 提高到112 mg/L和97 mg/L。
Munoz 等[33]改造大腸桿菌代謝通路合成左旋多巴。他們首先敲除葡萄糖磷酸轉移酶基因和過表達轉酮醇酶基因,增加磷酸烯醇式丙酮酸和4-磷酸赤蘚糖的積累,為酪氨基酸合成提供足夠前體,結果顯示L-酪氨酸比生產速率提高3 倍。敲除酪氨酸合成代謝中的抑制因子基因,L-酪氨酸比生產速率提高1.9 倍。解除酪氨酸的反饋抑制,將代謝通量由磷酸烯醇式丙酮酸引向合成L-酪氨酸。進一步通過表達分支酸變位酶基因和來源于 Zymomonas mobilis 的環己二烯脫羥酶基因,增大該代謝通路的通量。在基本鹽培養基中發酵,左旋多巴比生產速率達13.6 mg/(g·h),得率為51.7 mg/g,在發酵罐中發酵結果顯示左旋多巴產量達1.51 g/L。
5 總結和展望
隨著我國人口老齡化速度的加快,左旋多巴的需求將迅速增加。隨著代謝工程、合成生物學的發展,天然產物藥物的異源生物合成已經成為可能并受到越來越多的關注。由于化學合成和植物提取存在很多問題,通過生物轉化法和微生物發酵法合成左旋多巴是今后研究的重要方向。
(1)開發新型高效的生物酶催化體系,為生物轉化提供技術支撐。挖掘新型高效催化合成左旋多巴相關酶,對已有酶進行突變,高通量篩選高活性酶。探索高效酪氨酸酚解酶和酪氨酸酶的固定化方法,進一步提高酶的壽命和使用周期。
(2)運用代謝工程和合成生物學的思路,從細胞整體角度,從頭設計左旋多巴的微生物合成途徑,探明左旋多巴生物合成中的限制因素,并對其進行系統改造,構建高效生產左旋多巴的工程微生物。目前,植物來源的紫杉醇和青蒿素前體在大腸桿菌和酵母中得到高效合成,為左旋多巴工程菌創建具有示范價值。同時開發新型左旋多巴的工程菌株,如在鏈霉菌中發現了具有合成左旋多巴的基因,可改造使其具有較高的工業化應用潛力。
(3)開發新型左旋多巴衍生物的生物合成路線。左旋多巴的很多衍生物如甲基多巴、氧-甲基多巴、卡比多巴、左旋多巴酯、咪唑啉酮等均具有重要的生理功能和臨床應用。探索這些衍生物的生物轉化或者微生物合成路線也是今后研究的一個 方向。
[1] Poewe W,Antonini A,Zijlmans J,et al. Levodopa in the treatment of Parkinson’s disease:An old drug still going strong[J]. Clinical Interventions in Ageing,2010,5:229-238.
[2] Abbott A. Levodopa:The history so far[J]. Nature,2010,466:S6-S7.
[3] Huynh T. The Parkinson’s disease market[J]. Nature Reviews Drug Discovery,2011,10:571-572.
[4] Yamada H,Kumagai H. Synthesis of L-tyrosine related amino acids by β-tyrosinase[J]. Advances in Applied Microbiology,1975,19:248-288.
[5] 彭珍榮,萬品珍.L-酪氨酸合成L-多巴的研究[J].氨基酸雜志,1989,4:1-2.
[6] Koyangi T,Katayama T,Suzuki H,et al. Hyperproduction of 3,4-dihydroxyphenyl-L-alanine(L-DOPA) using Erwinia herbicola cells carrying a mutant transcriptional regulator tyrR[J]. Bioscience,Biotechnology,and Biochemistry,2009,73(5):1221-1223.
[7] Hornykiewicz O. L-DOPA:From a biologically inactive amino acid to a successful therapeutic agent[J]. Amino Acids,2002,23:65-70.
[8] Knowles W S. Asymmetric hydrogenation[J]. Account of Chemical Research,1983,16:106-112.
[9] 王偉文,惠云身.左旋多巴合成工藝研究[J]. 西北藥學雜志,1994,9(4):172-173.
[10] Valdes R H,Puzer L,Gomes M,et al. Production of L-DOPA under heterogeneous asymmetric catalysis[J]. Catalysis Communications,2004,5(10):631-634.
[11] Behera A,Sankar D G,Moitra S K,et al. Isolation,characterization and quantification of levodopa in seeds of Mucuna pruriens and herbal formulation by spectrophotometry[J]. Pharm Analysis and Quality Assurance,2011(2):135-146.
[12] 黃增瓊,蔣偉哲,巫世紅.毛豆的研究[J].進展藥學專論,2008,17(24):15-16.
[13] Fitzpatrick P F. Mechanism of aromatic amino acid hydroxylation[J]. Biochemistry,2003,42(48):14083-14091.
[14] 彭珍榮.假單胞菌屬細菌產酪氨酸酶的研究[J].氨基酸雜志,1990,1:7-9.
[15] Hap I,Ali S,Qadeer M A. Biosynthesis of L-DOPA by Aspergillus oryzae[J]. Bioresource Technology,2002,85(1):25-29.
[16] Neusser D,Schmidt H,Spizek J,et al. The genes lmbB1 and lmbB2 of Streptomyces lincolnensis encode enzymes involved in the conversion of L-tyrosine to propylprolane during the biosynthesis of the antibiotic lincomycin A[J]. Archieves of Microbiology,1998,164(4):322-333.
[17] Lee S G,Hong S P,Sung M H. Development of an enzymatic system for the production of dopamine[J]. Enzyme and Microbial Technology,1999,25:298-302.
[18] Kumagai H,Yamada H,Matsui H,et al. Tyrosine phenol lyase Ⅰ purification crystallization and properties[J]. The Journal of Biological Chemistry,1970,245:1767-1772.
[19] Huang S Y,Shen Y W,Chan H S. Development of a bioreactor operation strategy for L-DOPA production using Stizolobium hassjoo suspension culture[J]. Enzyme and Microbial Technology,2002,30(6):779-791.
[20] Krishnaveni R,Rathod V,Thakur M S,et al. Transformation of L-tyrosine to L-dopa by a novel fungus,Acremonium rutilum under submerged fermentation[J]. Current Microbiology,2009,58(2):122-128.
[21] Ho P Y,Chiou M S,Chao A C. Production of L-DOPA by tyrosinase immobilized on modified polystyrene[J]. Applied Biochemistry and Biotechnology,2003,111(3):139-152.
[22] Ates S,Cortenlioglu E,Bayraktar E,et al. Production of L-DOPA using Cu-alginate gel immobilized tyrosinase in a batch and packed bed reactor[J]. Enzyme and Microbial Technology,2007,40(4):683-687.
[23] Mariam I,Ali S,Rehman A,et al. L-Ascorbate,a strong inducer of L-dopa (3,4-dihydroxy-L-phenylalanine) production from pre-grown mycelia of Aspergillus oryzae NRRL-1560[J]. Biotechnology and Applied Biochemistry,2010,55(3):131-137.
[24] Seetharam G,Saville B A. L-DOPA production from tyrosinase immobilized on Zeolite[J]. Enzyme and Microbial Technology,2002,31(6):747-753.
[25] Mina K,Parkb D H,Yoo Y J. Electroenzymatic synthesis of L-DOPA[J]. Journal of Biotechnology,2010,146:40-44.
[26] Sandler M,Johnson R D,Ruthven C J,et al. Transamination is a major pathway of L-dopa metabolism following peripheral decarboxylase inhibition[J]. Nature,1974,247:364-366.
[27] Nagasaki T,Sugitia M,Fukawa H,et al. DOPA production with Enterobacter cloacae NB320 by transamination reaction[J]. Agriculture Biology and Chemistry,1975,39(2):363-369.
[28] Nagasaki T,Sugitia M,Fukawa H. Studies on DOPA transaminase of Alcaligenes faecalis[J]. Agriculture Biology and Chemistry,1973,37:1701-1706.
[29] 李華鐘,孫偉,劉吉泉,等.弗氏檸檬酸細菌酪氨酸酚解酶基因在大腸桿菌中的克隆與表達[J]. 工業微生物,2001,31(3):9-12.
[30] 李華鐘,孫偉,王樹英,等.重組大腸桿菌合成左旋多巴條件的優化[J]. 工業微生物,2002,32(2):5-9.
[31] Katayama T,Suzuki H,Koyanagi T,et al. Cloning and random mutagenesis of the Erwinia herbicola tyrR gene for high-level expression of tyrosine phenol-lyase[J]. Applied and Environmental Microbiology,2000,66(11):4764-4771.
[32] Kurt A G,Aytan E,Ozer U,et al. Production of L-DOPA and dopamine in recombinant bacteria bearing the Vitreoscilla hemoglobin gene[J]. Biotechnology Journal,2009,4(7):1077-1088.
[33] Munoz A J,Chavez G H,Anda R,et al. Metabolic engineering of Escherichia coli for improving L-3,4-dihydroxyphenylalanine (L-DOPA) synthesis from glucose[J]. Journal of Industrial Microbiology and Biotechnology,2011,38(11):1845-1852.

