誘導型一氧化氮合酶對二甲氧乙二酰甘氨酸預處理晚期腎保護作用的影響
陸文俊 張曉麗 葉志斌 夏世金
急性腎損傷(acute kidney injury,AKI)是一種常見的臨床危急重癥,普通住院患者發(fā)病率為2% ~7%,重癥監(jiān)護室中的發(fā)病率則高達10% ~30%。雖然臨床上針對AKI 采取了一系列的防治措施,但該病的病死率仍高達30% ~80%。腎缺血再灌注損傷(ischemia reperfusion injury,IRI)是AKI 的最常見病因,至今缺乏有效防治手段[1]。低氧誘導因子(hypoxia induced factor 1α,HIF-1α)是調節(jié)細胞適應性反應的核心調控因子[2-3]。我們前期研究發(fā)現(xiàn),脯氨酸羥化酶(prolyl hydroxylases domain-containing protein,PHD)抑制劑二甲氧乙二酰甘氨酸(dimethyloxallyl glycine,DMOG)預處理可穩(wěn)定腎小管上皮細胞HIF-1α 表達,減輕腎IRI[4-5],但關于其晚期腎保護作用及其機制研究尚未見報道。本研究旨在證實DMOG 預處理對小鼠腎IRI 的晚期保護作用,并利用誘導型一氧化氮合酶(inducible nitric-oxide synthase,iNOS)特異性抑制劑干預的方法探討iNOS 在此過程中的作用。
1 材料與方法
1.1 實驗動物與分組 雄性C57BL/6N 小鼠24 只,體質量22 ~26 g(SPF 級,中科院上海實驗動物中心),隨機分為4 組:假手術(sham)組、IRI 組、DMOG 預處理組(DMOG + IRI)和GW274150 干預組(GW274150+DMOG+IRI),每組各6 只。
1.2 模型制作 2%戊巴比妥鈉(50 mg/kg)腹腔注射麻醉小鼠,取腹正中切口,鈍性分離腎蒂,無創(chuàng)動脈夾夾閉雙側腎蒂造成腎缺血,持續(xù)夾閉30 min 后松開動脈夾,恢復血流,觀察1 min,腎臟由暗紫色逐漸轉為鮮紅色,表明再灌注成功,縫合傷口。sham 組只分離腎蒂,然后關腹;DMOG 預處理組在缺血術前24 h 腹腔注射DMOG (40 mg/kg,Cayman 公司,美國);GW274150 干預組在DMOG 預處理后的術前30 min予腹腔注射iNOS 特異性抑制劑GW274150(10 mg/kg,Enzo Life Sciences,美國)。缺血再灌注24 h 后,采血并處死小鼠,留取腎組織備用。
1.3 指標檢測
1.3.1 腎功能檢測:眶下靜脈叢采血,分離血清,酶法測定小鼠血清肌酐(SCr)濃度(日立全自動生化分析儀)。
1.3.2 腎組織病理學檢查:10%中性甲醛固定腎組織,制作石蠟切片,常規(guī)HE 染色,顯微鏡下觀察腎臟病理改變。根據(jù)腎小管細胞扁平、管腔擴張、細胞脫落壞死、腎小管管型堵塞、間質水腫,炎癥細胞浸潤及出血等觀察腎小管間質損傷情況。
1.3.3 Western blot 檢測:分別提取組織核蛋白和總蛋白,BCA 法測定組織蛋白濃度。行PAGE 電泳、轉膜、封閉后,鼠抗HIF-1α 單克隆抗體(Novus Biologicals 公司,美國)或兔抗iNOS 多克隆抗體(Cell Signaling Technology 公司,美國)或兔抗Actin 多克隆抗體(Sigma-Aldrich,美國)4 ℃孵育過夜,TPST 洗膜,加入辣根過氧化物酶標記的羊抗鼠或羊抗兔lgG(Jackson公司,美國)37 ℃孵育1 h,曝光、顯影、成像。應用圖像分析軟件對HIF-1α 和iNOS 特異性條帶進行吸光度分析。
1.3.4 細胞凋亡的檢測:采用脫氧核苷酸末端轉移酶介導的缺口末端標記法(Tunel 法),按試劑盒(Roche公司,德國)說明書進行操作。每一切片選取10 個視野,在200 倍光鏡下,盲法觀察染色陽性細胞數(shù)。
1.4 統(tǒng)計學分析 數(shù)據(jù)采用SPSS 13.0 統(tǒng)計軟件進行統(tǒng)計學處理。計量資料采用均數(shù)±標準差(±s)表示,多組間的比較采用單因素方差分析(One-way ANOVA)。P <0.05 為差異有統(tǒng)計學意義。
2 結果
2.1 各組小鼠腎功能測定 與sham 組相比,IRI 組小鼠SCr 明顯升高;DMOG 預處理可降低IRI 小鼠的SCr 水平;然而,如果在IRI 前事先應用iNOS 特異性抑制劑GW274150 可使DMOG 預處理小鼠SCr 升高。見表1。
2.2 各組小鼠腎臟病理學改變 HE 染色結果顯示,IRI 組小鼠腎組織病理學改變明顯,受損部位集中在外髓內帶的近端小管,主要表現(xiàn)為刷狀緣脫落,腎小管細胞扁平、脫落,管腔擴張,腎小管管腔內被管型堵塞,間質水腫,炎癥細胞浸潤和出血;DMOG 預處理組腎組織病理學改變較IRI 組顯著改善;iNOS 特異性抑制劑GW274150 干預則使DMOG 預處理小鼠腎組織損傷加重。見圖1。
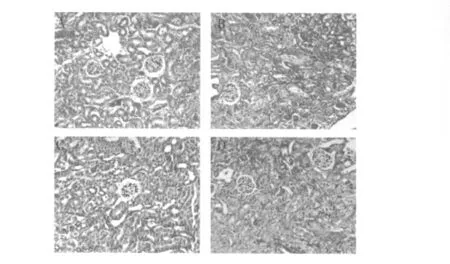
圖1 4 組小鼠腎組織病理光鏡下改變(HE,×200)
2.3 各組小鼠腎組織細胞凋亡的檢測 結合蘇木素染色結果顯示,sham 組小鼠腎組織腎組織中僅見少量腎小管上皮細胞凋亡;IRI 組小鼠腎小管上皮細胞呈現(xiàn)出明顯的凋亡跡象,凋亡細胞主要集中在皮髓交界、髓質,DMOG 預處理組腎組織細胞凋亡數(shù)目較IRI 組明顯減少;iNOS 特異性抑制劑GW274150 干預可使DMOG 預處理小鼠腎組織細胞凋亡數(shù)目增加。見圖2及表1。
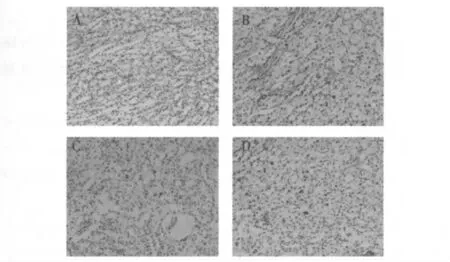
圖2 各組小鼠腎組織細胞凋亡情況(×200)
2.4 DMOG 預處理24 h 后小鼠腎組織中的HIF-1α蛋白的表達 小鼠予腹腔注射40 mg/kg 的DMOG 進行預處理,24 h 后小鼠腎組織中HIF-1α 蛋白表達較注射磷酸鹽緩沖液的對照小鼠明顯增加[(2.36 ±0.25)%比(0.57 ±0.06)%,P <0.05]。見圖3。
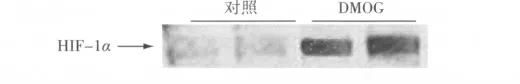
圖3 HIF-1α Western blot 檢測結果
2.5 4 組小鼠腎組織中iNOS 蛋白的表達 sham 組幾乎沒有iNOS 表達,IRI 組iNOS 表達增加,DMOG 預處理后iNOS 進一步增加,DMOG 預處理前予iNOS 特異性抑制劑GW274150 可減弱iNOS 的表達。見圖4及表1。
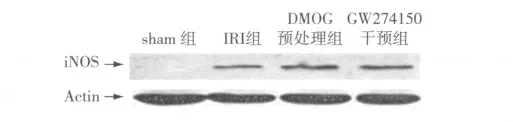
圖4 iNOS Western blot 檢測結果
表1 各組小鼠SCr 水平、腎組織細胞凋亡水平及iNOS 蛋白的表達(±s,n=6)
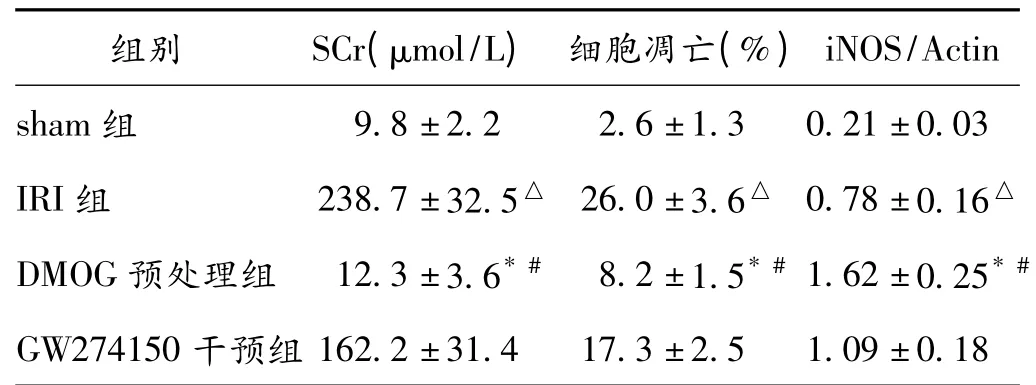
表1 各組小鼠SCr 水平、腎組織細胞凋亡水平及iNOS 蛋白的表達(±s,n=6)
注:與sham 組比較,△P <0.05;與IRI 組比較,* P <0.05;與GW274150干預組比較,#P <0.05
組別SCr(μmol/L) 細胞凋亡(%)iNOS/Actin sham 組9.8 ±2.22.6 ±1.30.21 ±0.03 IRI 組238.7 ±32.5△ 26.0 ±3.6△ 0.78 ±0.16△DMOG 預處理組12.3 ±3.6* #8.2 ±1.5* # 1.62 ±0.25* #GW274150 干預組162.2 ±31.417.3 ±2.51.09 ±0.18
3 討論
過去的20 年中,人們對細胞缺血缺氧環(huán)境下的適應性反應進行了不少研究,但其機制仍未完全闡明。HIF-1 是哺乳動物細胞低氧應答的核心調節(jié)因子,由α亞基和β 亞基組成,其中α 亞基是低氧調控的功能性亞基。常氧條件下,HIF-1 極不穩(wěn)定,通過脯氨酸羥化酶羥基化啟動泛素-蛋白酶體途徑迅速發(fā)生降解;缺氧條件下,脯氨酸羥化酶功能喪失,阻斷了HIF-1α 羥基化降解,積聚的HIF-1α 轉位入核,與HIF-1β 結合,啟動一系列下游功能基因的轉錄表達,以適應低氧環(huán)境。截止目前,已發(fā)現(xiàn)受其調控的靶基因多達百余種,它們在血管新生、糖代謝及細胞生存、增殖和凋亡等過程中發(fā)揮極其重要的作用[6-7]。我們前期研究證實,通過預處理穩(wěn)定腎小管上皮細胞HIF-1α 的表達,可以模擬缺血預適應,增強腎小管上皮細胞對IRI 的耐受,減輕腎小管上皮凋亡,其機制可能與HIF-1α 激活后促進了一系列保護基因如血紅素氧合酶-1(heme oxygenase,HO-1)、促紅細胞生成素(erythropoietin,EPO)和熱休克蛋白70(heat shock protein,HSP70)的轉錄表達有關[4-5]。
缺血預適應的保護作用具有雙時相性,根據(jù)時間早晚分為早期缺血預適應和晚期缺血預適應。早期缺血預適應在預缺血幾分后即可出現(xiàn),一般持續(xù)2 ~4 h;晚期缺血預適應在缺血預處理12 ~24 h 后出現(xiàn),能持續(xù)幾天甚至數(shù)周[8];同樣,藥物預處理也存在這種晚期腎保護作用,但關于DMOG 晚期腎保護作用及其機制研究尚未見報道。本實驗表明,DMOG 通過改善IRI小鼠的腎功能,減輕腎組織病理學損傷,減少腎組織細胞凋亡,對小鼠腎IRI 產(chǎn)生晚期保護作用。
機體中存在3 種一氧化氮合酶:內皮型(endothelial NOS,eNOS)、神經(jīng)型(neuronal NOS,nNOS)和誘導型(iNOS)。iNOS 刺激后釋放一氧化氮(NO)較慢,持續(xù)時間長,既往研究證實,iNOS 是晚期預適應的觸發(fā)和調節(jié)因子,它參與了缺血預處理及多種藥物預處理的晚期心、腎保護作用[8-10]。GW274150 是一種特異性iNOS 抑制劑,對于其他2 種一氧化氮合酶幾乎沒有作用。本實驗中通過Western blot 方法檢測了iNOS 在各組小鼠腎組織中的表達,結果發(fā)現(xiàn),IRI 組存在一定程度的iNOS 表達,DMOG 預處理后iNOS 增加更加明顯,而DMOG 預處理后予GW274150 可明顯減弱小鼠IRI 腎組織中iNOS 的表達。由此說明,iNOS 特異性抑制劑GW274150 可大大削弱脯氨酸羥化酶抑制劑DMOG 對小鼠IRI 的晚期保護作用。
iNOS 主要通過合成NO 來發(fā)揮作用。NO 可以激活鳥苷酸環(huán)化酶,產(chǎn)生環(huán)鳥苷酸(cGMP),進而激活蛋白激酶G 并通過開放線粒體鉀通道而產(chǎn)生腎保護作用[8]。值得指出的是,低水平的NO 對腎臟具有保護作用,而過高水平的NO 將對腎臟具有損傷作用,我們推測DMOG 預處理恰恰是產(chǎn)生了中等程度的iNOS/NO,進而啟動保護性信號途徑對抗之后的腎IRI。另外,有報道,常氧條件下,NO 供體可刺激HIF-1α 表達[11]。因此,我們推測DMOG 預處理可穩(wěn)定HIF-1α,促進HIF-1α 靶基因iNOS 表達,使NO 合成增多,進而通過陽性反饋作用進一步觸發(fā)HIF-1α 活化,放大其腎保護作用。
總之,本研究提示了DMOG 預處理對小鼠IRI 腎臟產(chǎn)生晚期保護作用,iNOS 特異性抑制劑可削弱這種保護性作用,這意味著iNOS 參與了HIF-1α 活化引發(fā)的腎保護作用。
[1] Thadhani R,Pascual M,Bonventre JV. Acute renal failure[J]. N Engl J Med,1996,334(22):1448-1460.
[2] Haase VH. Hypoxia-inducible factors in the kidney[J]. Am J Physiol Renal Physiol,2006,291(2):F271-F281.
[3] Myllyharju J. HIF prolyl 4-hydroxylases and their potential as drug targets[J]. Curr Pharm Des,2009,15 (33):3878-3885.
[4] 張曉麗,劉紅,鄒建洲,等.二甲氧乙二酰甘氨酸對小鼠腎缺血/再灌注損傷的保護作用[J]. 中華急診醫(yī)學雜志,2008,17(4):26-29.
[5] 張曉麗,盛蔚文,陳偉軍,等.二甲基乙二酰基甘氨酸對缺氧復氧誘導的腎小管上皮細胞損傷的保護作用及其機制[J].中華腎臟病雜志,2010,26(3):210-214.
[6] Matsumoto M,Makino Y,Tanaka T,et al. Induction of renoprotective gene expression by cobalt ameliorates ischemic injury of the kidney in rats[J]. J Am Soc Nephrol,2003,14(7):1825-1832.
[7] Jaakkola P,Mole DR,Tian YM,et al. Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation[J]. Science,2001,292(5516):468-472.
[8] Park KM,Byun JY,Kramers C,et al. Inducible nitric-oxide synthase is an important contributor to prolonged protective effects of ischemic preconditioning in the mouse kidney[J]. J Biol Chem,2003,278(29):27256-27266.
[9] Wakeno-Takahashi M,Otani H,Nakao S,et al. Isoflurane induces second window of preconditioning through upregulation of inducible nitric oxide synthase in rat heart[J]. Am J Physiol Heart Circ Physiol,2005,289(6):H2585-H2591.
[10]Zhao T,Xi L,Chelliah J,et al. Inducible nitric oxide synthase mediates delayed myocardial protection induced by activation of adenosine A(1)receptors:evidence from geneknockout mice[J]. Circulation,2000,102(8):902-907.
[11]Kimura H,Weisz A,Kurashima Y,et al. Hypoxia response element of the human vascular endothelial growth factor gene mediates transcriptional regulation by nitric oxide:control of hypoxia-inducible factor-1 activity by nitric oxide[J].Blood,2000,95(1):189-197.

