烷基鋅與醛的催化不對稱加成反應研究進展
趙文獻,張朋飛,王瑾,劉冠軍,趙瑞娟,張安安,陳東麗,劉念,雷曉明
(1.鄭州大學化學與分子工程學院,河南 鄭州 450052;2.商丘師范學院化學化工學院,商丘師范學院有機新材料合成重點實驗室,河南商丘 476000)
在手性配體作用下,有機鋅試劑對醛的選擇性加成可以制得具有光學活性的二級醇.該類反應是重要的,同時也是手性仲醇的最基本的不對稱合成方法之一.手性二級醇是許多手性藥物、精細化學品和天然產物的重要前體物質,它們同樣是合成各種官能團的中間體,比如:鹵素、氨、酯等.
自從1984年Oguni和Omi首次報道了二乙基鋅在催化量的(S)-亮氨酸存在下對苯甲醛的加成中取得中等對映選擇性(49%ee)以來[1],有機鋅試劑對羰基化合物的不對稱加成研究得到迅猛發展.1986年,Noyori等獲得了第一個高對映選擇性手性配體(-)-3-exo-二甲氨基異冰片醇[(-)-DAIB],用2 mol%該配體催化二甲基鋅對苯甲醛的不對稱加成,產物(S)-1-苯基乙醇的ee值高達95%[2],之后有機鋅對前手性的羰基化合物的加成被化學家們廣泛的關注,而且出現了各種各樣的手性配體催化該類反應,包括氨基醇配體[3]、雙氧配體[4]、二胺配體[5]等等.其中很多的手性配體具有很高的對映選擇性.二乙基鋅對醛的不對稱加成也成了檢驗各種新手性配體對映識別效能的模型反應.
本文對近年來在烷基鋅試劑對醛的不對稱加成反應中表現較好的手性配體進行了總結.
1 簡單的氨基醇配體
迄今為止,對于二烷基鋅對醛的不對稱加成反應,手性氨基醇系列的化合物已經成為該反應中種類最多,性能最好,研究最廣泛的配體.在眾多的手性氨基醇中,最具代表性且應用最成功的莫過于是β–氨基醇、樟腦衍生物和麻黃堿衍生物等.Noyori等對該類反應的催化和立體識別機理進行了詳細的研究[6](Scheme 1).根據這一假定的機理,手性配體1首先與一分子的二甲基鋅配位生成2,2中的Zn-Me并不能與醛加成,必須有第二分子的二甲基鋅通過鋅原子與配體烷氧基中的氧配位生成3,3中第一個鋅原子與苯甲醛底物中的羰基氧配位生成4,根據分子軌道和密度泛函計算表明,4中苯甲醛相對于手性配體是反式配位的,這有利于形成Scheme 1中所示的5/4/4三環過渡態5,第二分子二甲基鋅的一個甲基從苯甲醛羰基平面的Si面進攻,最終生成(S)構型的苯乙醇6.由上可知,這一加成反應至少需要2當量的二烷基鋅,缺乏源自經濟性是其不足之處.
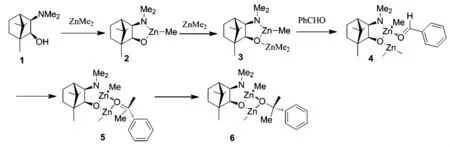
Scheme 1
2007年,由Hirose等[7]報道的手性1,3-氨基酚配體7,在10 mol%配體量條件下,芳香醛與二乙基鋅的加成產物最高ee值可達99%,脂肪族醛也有95%的ee值,且產物構型傾向于(R)構型.從反應的過渡態(Figure 1)可以看出,當6位上的叔丁基與第二分子二乙基鋅Zn原子上的乙基處于四元環異側時,過渡態更穩定,因此酚的鄰位上具有大體積的叔丁基是反應具有高對映選擇性以及生成(R)構型產物的原因.
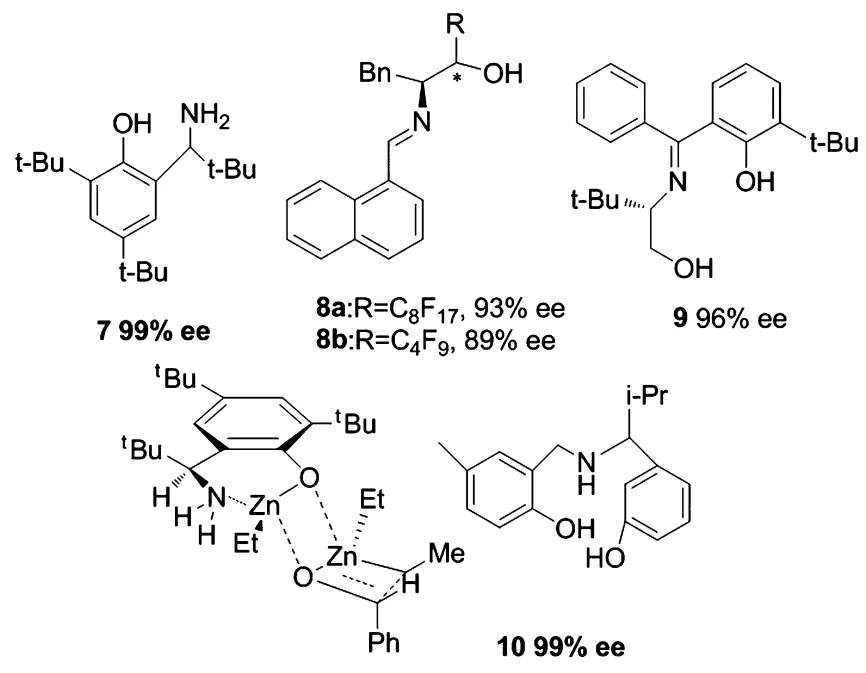
圖1 簡單的手性氨基醇手性配體及配體7形成的可能的過渡態Figure 1 Simpe chiral amino alcohol ligands and proposed transtion states of 7
在催化二乙基鋅對醛的不對稱加成反應中,西弗堿類手性配體由于與二乙基鋅的配位能力較弱,常常需要借助路易斯酸Ti(O-i-Pr)4提高產物的對映選擇性,因此未被廣泛的研究.2007年,由Ando等[7]合成了配體8a,8b.配體中氟原子的強吸電子能力導致配體有足夠的酸性而不需要加入路易斯酸.10 mol%配體8a催化二乙基鋅對苯甲醛的不對稱加成反應,可得到93%的ee值,而具有較短R鏈的配體8b,在10 mol%催化量的條件下,催化效果稍微有所降低,得到89%的ee值,因此配體中R鏈的長度也是影響不對稱催化能力的重要因素.
2008年,Hayashi等[8]報道的西弗堿手性配體9在芳香醛的烷基化反應中取得了優秀的對映選擇性和化學產率.5 mol%的該配體催化苯甲醛的乙基化得到94%的產率和96%的ee值,甚至當配體量降至0.1 mol%時,仍可得到88%的產率和96%的ee值.配體9(1 mol%)催化脂肪醛也可得到94%的ee.
手性三齒配體在過去并未廣泛報道,2008年Hirose[9]等報道了三齒配體10,發現溶劑對反應的對映選擇性影響較大,在二氯甲烷或四氫呋喃中反應效果較差,而甲苯或甲苯∕正己烷體積比1∶1為溶劑時,有很好的反應效果.在10 mol%配體量條件下,芳香醛與二乙基鋅的加成產物最高ee值可達99%;脂肪族醛的乙基化加成產物也有95%的ee值;α,β-不飽和醛的加成產物也有94%的ee值,所有產物都是(R)構型.

圖2 麻黃堿類手性配體及配體12,13形成可能的過渡態Figure 2 ephedrine as chiral ligands and the possible transition state of 12 and 13
2008年,由Hitchcock等[10]報道的麻黃堿衍生物手性氨基醇配體11,在二乙基鋅對苯甲醛的不對稱加成反應中,10 mol%配體量催化得到產物的對映異構體的比率從87.5∶12.5到91.0∶9.0,產物構型為(S).研究表明產物的絕對構型主要隨麻黃堿上芐基構型的改變而改變.而產物對映異構體比率主要受N上取代基的影響,當增大取代基體積時,產物對映選擇性降低.且當N上取代基為三苯基時,催化過程不能進行完全,產生了超過10%的芐醇,表明配體N原子上取代基為三苯基時不適合催化二乙基鋅對醛的不對稱加成.
2009年,Hitchcock等[11]對配體11做了修飾,在氮原子上引入吡啶甲基,合成了配體12,并討論了吡啶甲基的引入對反應的影響.結果表明當芐基換為吡啶甲基時,反應過渡態發生了改變,吡啶基團上的N原子參與了配位,產物的構型發生了反轉,且對映選擇性明顯下降(Figure 2).當在配體的氮原子上引入烷氧基側鏈[12],如配體13,產物的ee值范圍在63% ~90%,與未引入烷氧基側鏈相比ee值有所提高 ,可能是因為烷氧基的空間體積較大,不易形成Figure 2所示的過渡態所致.
2009年,Singaram等[13]人,將手性異構的配體14a和14b應用于苯甲醛的不對稱加成反應中,兩者均取得了很好的催化效果.在配體14a作用下,醛的乙基化得到(S)構型的產物,而在配體14b作用下得到(R)構型的產物,且兩配體均使得產物的對映選擇性均達到99%.對于脂肪醛和不飽和醛類也取得了很高產率和對映選擇性.更可貴的是,與苯甲醛的乙基化相比,甲基化取得了同樣的對映選擇性.
2 剛性骨架的氨基醇配體
2008年,Esfandyari等[14]首次報道了一種嗎啡堿類氨基醇手性配體15,進行催化二乙基鋅對醛的不對稱加成反應.在相同的實驗條件下,通過加入催化量的苯甲酸,均使產物的構型發生翻轉.通過優化反應條件,發現降低反應溫度和增加配體的使用量可以提高反應的ee值.其中配體15c催化效果最好,可以達到95%的ee,而15a、15b分別達到78%的ee和66%的ee.接下來作者又考察了底物上取代基的電子效應,發現電子效應對轉化率并沒有太大影響,但對對映選擇性有較大影響,當底物的鄰位上有取代基,或取代基具有給電子性質時,均會降低反應的對映選擇性.
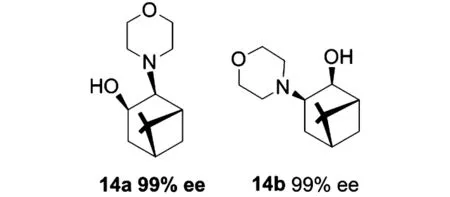
圖3 Singaram的手性氨基醇手性配體Figure 3 Singaram's chiral amino alcohol ligands
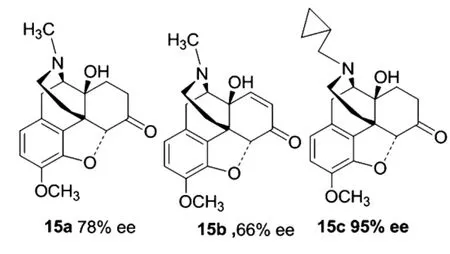
圖4 Esfandyar的剛性氨基醇配體Figure 4 Esfandyar's amino alcohol ligands

圖5 六元環修飾的剛性氨基醇配體Figure 5 rigid amino alcohol ligands decorated by hexatomic ring
2009年,Uang小組[15]報道了氨基醇配體16.該配體具有較高的反應活性,2 mol%的該配體催化二乙基鋅對芳香醛的加成可得到91%~94%的ee值,對脂肪醛的烷基化反應同樣得到了很好的效果(89-94%ee).反應僅需要等當量的二烷基鋅,在25℃下,15 min內完成,故在手性誘導生成二級醇反應中,該配體更具經濟性.
2010年,由Nieto等[16]報道的配體17(10 mol%)在催化二乙基鋅對芳香醛的加成反應中表現出很好的手性誘導效果,產率和ee值均大于99%.作者通過考察底物醛的適用范圍,發現該配體對雜環芳醛、α,β-不飽和醛同樣有很好的催化效果,其中只有肉桂醛的ee值低于90%.除了較高的ee值,反應時間也均不超過45 min.值得注意的是該配體在催化反應結束以后,通過乙醚萃取后可回收80%,繼續催化2-萘酚甲醛的乙基化反應兩次,且產率和ee值均沒有明顯減少.經實驗證明,配體中所含的3-羥基吡咯醇是產率和對映選擇性提高的關鍵因素.
2011年,Kilic[17]等報道的雙環[2,2,2]辛烷骨架的配體18,通過優化配體結構發現,當羥基碳上取代基為乙基時,配體活性較高,當換為苯基時,產物的對映選擇性反而降低,可能是苯基位阻較大所致.在5 mol%配體量條件下,反應可以得到99%的ee值.通過拓展底物發現,芳香醛鄰位存在給電子取代基的催化結果優于吸電子基,而在對位或間位,無論存在吸電子還是給電子取代基,反應有相同的對映選擇性.
3 氮雜環骨架的氨醇配體
2007年,Dogan等[18]報道了二茂鐵骨架的氮雜三元環手性配體19,在配體量為3 mol%的條件下,芳香醛的乙基化的產率及ee值均可達到99%;α,β-不飽和醛也可以有96%的產率和84%的ee值;對于脂肪醛最高也有94%的ee值.通過研究發現,產物的構型主要受氮雜三元環上立體中心的構型影響.
2008年,我們小組和Wang[19]共同報道了含二茂鐵基的氮雜三元環、四元環的手性配體20a、20b.在催化二乙基鋅對芳香醛的不對稱加成反應中,ee值分別可達92.7%和98.4%,且該類催化劑不需要鈦,鎳等金屬就可以實現反應的高對映選擇性.研究表明氮雜三、四元環的剛性結構以及體積龐大的二茂鐵的位阻效應是造成高對映選擇性的主要原因.
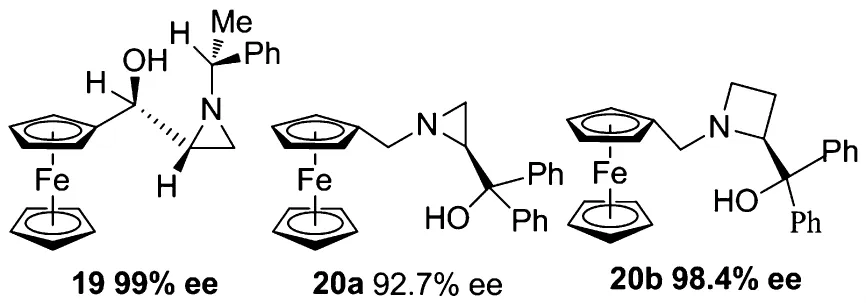
圖6 二茂鐵骨架的氮雜環配體Figure 6 Ferrocenyl-base N-heterocycle ligands
2008年,由Pericas等[20]報道的配體21是一類優秀的配體,該類配體具有較高的反應活性.在配體21a的作用下,反應可在1h之內達到99%的轉化率,因此在反應速率方面,配體21a要優于其它3個配體.在對映選擇性方面,4個配體均表現出很好的催化效果,21a、21b在苯甲醛的乙基化反應中分別有98%的ee值和96%的ee,配體21c催化對位取代的芳香醛可以有98%的ee值,21d對于鄰位取代的芳香醛也有99%的ee值.
2008年,Zi小組[21]合成的氮雜四元環氨基醇22a和22b是一類高效的配體.在優化的反應條件下,配體22a(10 mol%)在Ti(O-i-Pr)4-Et2Zn體系下反應24 h,苯甲醛的烷基化反應得到98%的產率和94%的ee值.在相同的反應條件下,22b得到98%的產率和97%的ee.在配體22a作用下,對其它底物的醛得到92% ~98%的產率和94% ~97%的ee.
2009年,Lesniak和Kiebasinski等[22]共同報道的三齒氮雜三元環手性配體23,在醛的不對稱乙基化反應中表現出較高的活性,產物可以達到99%的產率和97%的ee值.對于配體中亞砜基團上的硫原子及氮雜環上的立體中心對反應的影響,作者通過考察發現,產物的絕對構型主要受氮雜環上立體構型的控制,而亞砜基團上的立體中心對反應的影響也不能忽視,因為當氮雜環上不存在立體中心時,反應仍能得到50%的對映選擇性.
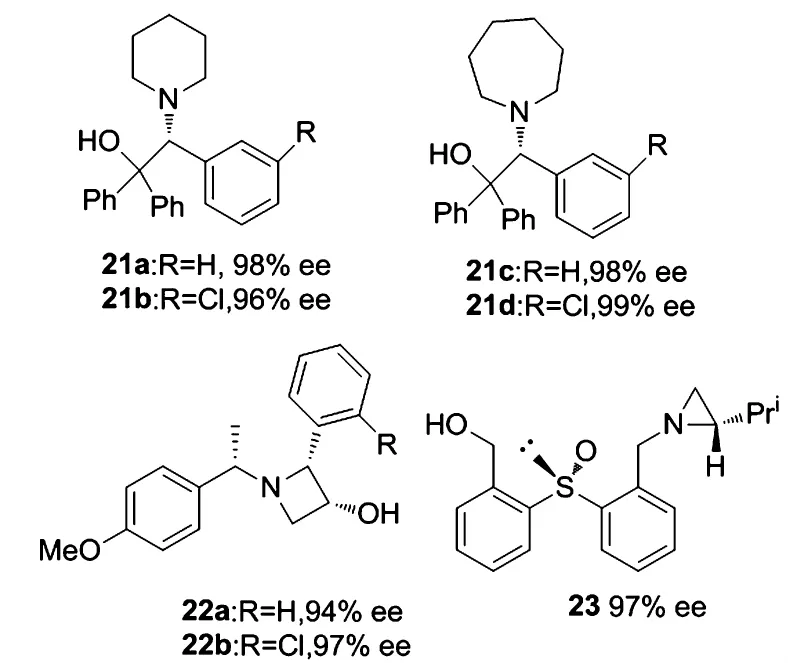
圖7 三,四,六,七氮雜環配體Figure 7 three,four,six and seven N-heterocycle ligands
4 聯萘酚骨架及其修飾的手性配體
2007年,Li小組[23]報道的(S)-BINOL的衍生物配體24,在Ti(O-i-Pr)4-Et2Zn體系下催化二乙基鋅對苯甲醛的加成反應中,得到93%的產率和89%的ee值.在不加Ti(O-i-Pr)4的情況下,只能得到67%的產率和32%的ee值,說明Ti(O-i-Pr)4的加入能促進配體與Et2Zn的絡合作用,因而較好地提高了反應的對映選擇性.該配體在同樣的催化體系下,對其它芳香醛的烷基化反應,催化效果也有高達90%的ee值,對α、β-不飽和醛的烷基化反應也可得到80%的ee值.2008年,該小組對配體24進行修飾[24],得到其還原產物25,并將氮原子上的取代基修飾為聯萘基團,在配體25作用下,1-萘醛的乙基化反應產率高達100%,ee值也可提高至92%.2008年,該小組首次把聯萘配體酚與硫原子結合,合成出了一系列的硫醚配體26a、26b、26c和26d[25].在 Ti(O-i-Pr)4-Et2Zn體系下,反應在極其溫和的條件下進行,他們用于催化二乙基鋅對芳香醛的不對稱加成,顯示出高的對映選擇性.該類催化劑即使對于脂肪醛也很有效,大多數情況下醛的轉化率都超過90%及較高的ee值.其中配體26c活性最高,取得了97%的產率和93%的ee值.這對于新配體的設計、合成有重大的指導意義.

圖8 Li的BINOL配體Figure 8 Li's BINOL ligands
2007年,由Harada等[26]報道的3位上烷基取代的H8-BINOL配體27在醛的烷基化反應中表現出很好的活性.2 mol%的配體量,在Ti(O-i-Pr)4-Et2Zn體系下反應1 h后,產物的產率及ee值均高達98%,當配體量減少至1 mol%時,ee值稍微有所降低(96%ee).作者考察了不同芳香醛的乙基化效果,發現無論是吸電子基、給電子基取代的芳香醛,均有很好的催化效果(94% ~98%ee);對脂肪族醛和α、β-不飽和醛也可達到90% ~94%的ee值.值得注意的是,在用配體27催化反應時,反應過程中不需要嚴格無水.
2007年,由Arai等[27]報道的以聯萘為手性骨架的配體28,在配體量為15 mol%條件下,催化二乙基鋅對苯甲醛的不對稱加成反應,可使產物達到80%的ee值,但其催化二乙基鋅對脂肪醛的不對稱加成反應卻只能得到31%~58%的ee值.
2008年,Superchi等[28]報道了(S)-BINOL的衍生物配體29(0.08 mol%),該配體在催化二烷基鋅對芳醛的不對稱加成反應中有不錯的催化效果,產物ee值可達97%,且反應可在10-20 min之內完成.對于n-Bu2Zn與醛的加成反應,可以在2 h完成,得到90%的產率和96%的ee值.而對于苯甲醛的甲基化反應,在該配體的催化下可以得到96%的產率和80%的ee值.
2009年,由Judeh等[29]報道的配體30,通過優化配體結構發現苯環上含有羥基是反應具有高對映選擇性的關鍵.該配體在Ti(O-i-Pr)4-Et2Zn體系下催化一系列芳香醛的乙基化反應中取得了優秀的結果.在配體量為10 mol%和120 mol%的Ti(O-i-Pr)4的作用下,芳香醛上取代基無論具有吸電子或給電子性質,乙基化反應均可取得有較好的催化效果,最高達到95%的產率和89%的ee值.
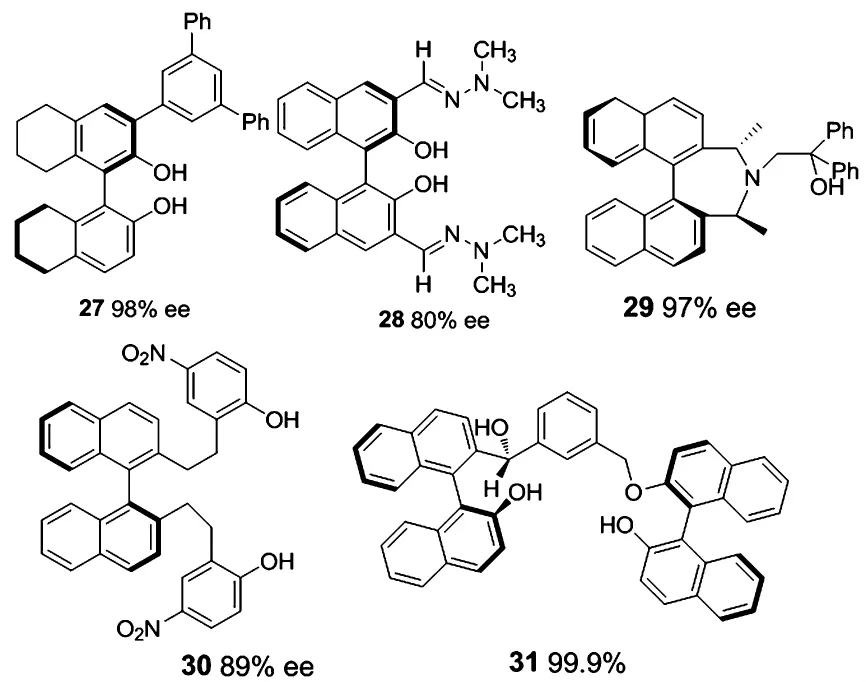
圖9 BINOL衍生的其它配體Figure Other BINOL-derived ligands
2011年,Xu和Lai等[30]報道的聯萘酚配體31,在苯甲醛的乙基化反應中表現出了很好的催化效果.以乙醚為溶劑,該配體(10 mol%)在和Ti(O-i-Pr)4(1 mmol)組合作用下對苯甲醛的乙基化得到99%的ee值,對其它芳香醛的不對稱加成,產率為89% ~94%,ee值為96% ~99.9%.
5 二氧/二氮手性配體
對于配體中有兩個可以形成螯合配位的氧原子或氮原子的手性配體,許多研究已表明這類手性配體在有機鋅對醛的不對稱加成中,也是很好的手性催化劑.

圖10 二氧手性配體Figure 10 dioxo chiral ligand
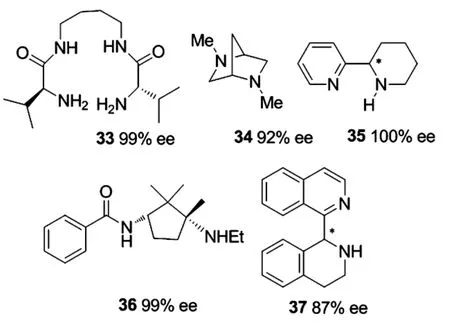
圖11 二氮手性配體Figure 11 diazo chiral ligand
2010年,Frejd小組[31]合成了二氧配體32,在反應條件為乙醚∕正己烷體積比2∶3,5 mol%的配體在0℃下反應40 h,達到83%的產率和90%的ee值.作者對配體結構進行優化:當6位上氧原子的位置移至5位時,產率和ee值分別降至66%和82%,表明增大兩個配體氧原子之間的距離對配體活性影響較大.
2008年,Burguete等[32]報道了配體33,通過優化反應條件,發現不具有配位能力的正己烷是最好的溶劑,5 mol%配體量下,0℃反應取得了很高的對映選擇性(可達到99%ee),對于其它底物醛,體積較大的1-萘醛得到97%的ee,4-甲氧基苯甲醛得到98%的ee,但對于脂肪族醛無論在0℃還是室溫條件下均不發生反應.
2008年,Regla等[33]報道的剛性結構的二氮配體34在催化苯甲醛的乙基化反應中得到92%的ee值,反應可在4-8 h內完成,但化學收率只能達60%,延長反應時間15-20 h可使化學收率增加至98%,反應的對映選擇性會稍微降低(88%ee),雖然反應的ee值較高,但是配體用量要達50 mol%.
2008年,由Gao小組[34]報道的雙氮手性配體35具有較高的活性,5 mol%的配體量條件下,產物的ee值高達100%,可貴的是對脂肪醛加成反應也有極高的對映選擇性.但是該配體需經過合成其外消旋體并經過手性拆分才可以獲得.
2010年,Murtinho小組[35]合成的二氮配體36,該配體在苯甲醛的烷基化反應中是很優秀的配體,可以達到96%的ee值.在一系列的芳香醛的烷基化反應中ee值最高達99%,配體中氨基上乙基的引入使反應具有較快反應速率(6 h達95%的產率)和較高對映選擇性,當引入兩個乙基時,反應轉化率迅速降低,可能是位阻較大所致.
2010年,Judeh小組[36]報道了雙氮配體37,該配體結構中,兩個氮原子處于不同的兩個六元環上,其中處于芳香環中的氮原子與芳香環共平面,而另一氮原子處于具有船式構型的非平面六元環中,這使得配體中兩個氮原子之間的夾角可以通過金屬離子或處于非芳香環上氮原子上的取代基大小來控制,作者通過一系列不同取代基來調節該配體的空間結構,以期望提高反應的對映選擇性,但最終結果表明氮上所連為氫原子時配體的活性最高,15 mol%的配體量下得到87%的ee值.
6 磺酰胺手性配體
2007年,Singh等[37]合成了雙磺酰胺配體38,通過優化配體結構發現,當磺酰基上連接苯環取代基時配體活性較高,在Ti(O-i-Pr)4-En2Zn催化體系下,只需要4 mol%的38,可達到99%產率和96%的ee值.若將取代基換為對硝基苯基、對溴苯基、甲基、三氟甲基時ee值均高于91%,但在苯基取代基上連有羥基時ee值降至76%.

圖12 碘酰胺手性配體Figure 12 sulfamid chiral ligands
2008年,Zhu等[38]報道了西弗堿-樟腦骨架磺酰胺配體39,在配體優化過程中發現樟腦骨架上的羥基是反應具有高對映選擇性的關鍵.配體對溶劑有很強的依賴性,正己烷是最佳的選擇,10 mol%的39,在0℃條件下可以得到91%的產率和93%的ee值;對不同底物的醛而言,在對位或鄰位有吸電子基團時往往有較高的ee值,對于脂肪醛也可以達到82%的ee值.
2010年,Parrodi等[39]報道了C2-軸對稱的雙磺酰胺配體40,這類具有C2-軸對稱的配體在形成雙核金屬絡合物時能形成很重要的協同作用,在Ti(O-i-Pr)4-En2Zn催化體系下,苯甲醛的烷基化可以達到98%的產率和81%的ee值.
2010年,由Bauer小組[40]報道的手性配體41,在苯甲醛的烷基化反應中表現出非常好的催化活性,在0.1當量的配體41與Ti(O-i-Pr)4催化作用下,反應可以在少于1.5 h內完成,且有94%的ee值,甚至將用量降低到0.01當量,反應仍可以達到相同的對映選擇性,只是化學收率稍微降低.作者對芳香醛底物進行拓展時發現醛上的電子效應對反應有較大的影響,ee值最高可以超過99%,也可低至10%.對于脂肪醛以及α,β-不飽和醛也可達到88%的ee值,研究表明具有強吸電子性質及體積相對較大的三氟甲基對催化效果起著至關重要的作用.
2011年由hirose小組[41]報道的手性1,3-氨基磺酰基42a、42b配體,在催化過程中表現出非常好的效果.配體的優點:一是通過互換氨基和磺酰基的位置可以使產物的構型發生反轉;二是此配體具有很高的活性,對于兩種構型的產物均有大于99%的產率,在配體42a(10 mol%)的作用下主要得到(S)構型的產物,ee值可達94%,配體42b(5 mol%)主要得到(R)構型的產物,ee值高達98%.結構研究表明氨基為三級氨、磺酰胺位于苯基的對位是該配體具有高活性的重要因素,因為苯基的作用使得磺酰胺上的質子具有更強的酸性,更有利于氮原子與二烷基鋅配位.
7 噁唑烷手性配體
2007年,Hitchcock等[42]合成了噁唑烷配體43,其中配體43b的催化效果最好,10 mol%的配體量下得到手性二級醇59%的ee值.在配體43a、43b作用下得到的是(R)構型的產物,配體43c、43d得到的(S)構型的產物.研究結果表明配體上氮原子上的甲基取代基是產物立體選擇性的控制因素.2008年,該小組對該類配體做了修飾[43],得到配體44,將氮原子上的甲基換為位阻更大的異丙基,以期望提高反應的對映選擇性,然而對于苯甲醛的乙基化反應得到的二級醇只能得到55%的ee值.2010年,Jaworska對配體43b做了進一步修飾[44],得到配體45,考察了噁唑啉上苯環取代基上的立體效應對產物對映選擇性的影響,在配體45a、45b、45c作用下,分別得到43%、39%和35%的ee值,該結果表明要取得較高的對映選擇性除了氮原子上的烷基取代基,噁唑烷上苯環取代基的立體效應也很重要.
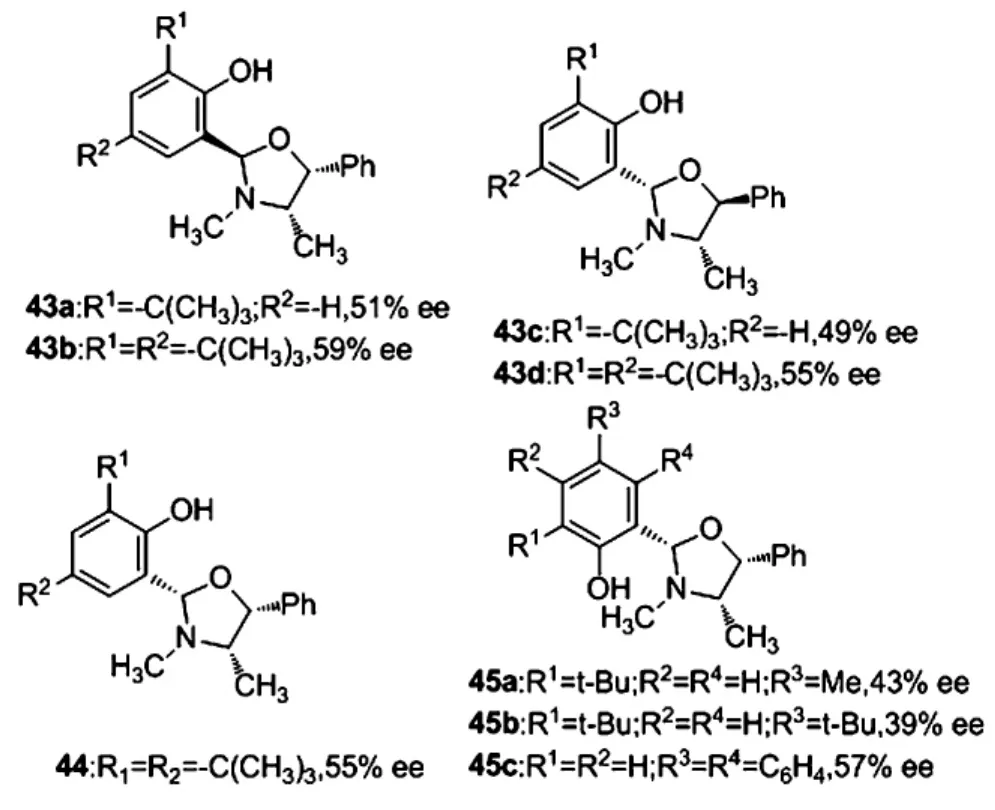
圖13 Hitchcock的噁烷配體Figure 13 Hitchcook's oxazolidine ligands
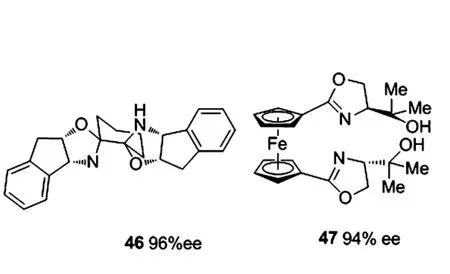
圖14 雙噁唑烷配體Figure 13 Chiral axial symmetric oxazolidine ligands
2007年,Wolf等[45]報道了雙噁唑啉手性配體46,最佳的反應條件是手性配體為2 mol%,以正己烷和甲醇(體積比為4∶1)作為溶劑,在室溫條件下進行.該配體對具有吸點子取代基和給電子取代基的底物醛均具有很好的耐受性,產物二級醇可以得到78% ~96%的ee值;對雜環芳香醛也有71%的ee值;環己基醛也可以達到90%的ee值.
2007年,Zhang小組[46]報道了二茂鐵骨架的雙噁唑啉配體47,10%mol的該配體在催化芳香醛的烷基化反應中達到94%的ee,但需要6 d的反應時間,且產率只有40%.作者考察了配體上取代基體積對反應的影響,當取代基由甲基換為乙基和苯基時,ee值分別下降到45%和41%.作者又考察了底物上取代基的影響,發現鄰位有取代基與對位有取代基時得到更低的ee值.
8 負載型手性配體
2007年,由Gros小組[47]報道了聚苯乙烯負載的手性三齒配體48,通過優化反應條件發現溶劑的極性對反應有較大的影響,當以甲苯為溶劑時配體表現出較高的活性,室溫條件對反應有利,降低反應溫度使得對映選擇性有所降低.5 mol%的配體48在苯甲醛的不對稱乙基化反應中可以達到大于99%的產率和93%的ee值.該配體可以通過簡單的過濾進行回收,并且進過5次重復使用后,仍可以達到95% ~97%的產率而ee值均沒有任何損失(92% ~93%).
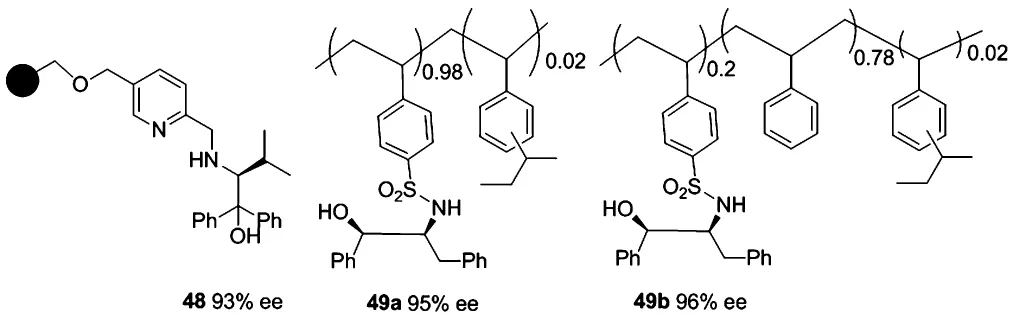
圖14 聚苯乙烯負載的手性配體Figure 14 PS-based supported chiral ligands
2007年,Gau小組[48]報道的聚苯乙烯負載的磺酰胺手性配體49a,在Ti(O-i-Pr)4-En2Zn催化體系下催化苯甲醛的乙基化反應,得到100%的產率和92%的ee值.配體使用量為10 mol%,對其它底物的醛也可以達到88%~95%的產率和89%~95%的ee值.該配體在循環使用6次以后對映選擇性稍微有所降低,從92%降至81%,然而重復使用第7次時,ee值又升至86%.2008年,該小組對配體49a的負載位點以及載體做了修飾[49],得到了配體49b,仍然在Ti(O-i-Pr)4-En2Zn催化體系下考察該配體的活性,當49b與Ti(O-i-Pr)4的摩爾比為1∶1.2時,反應的對映選擇性最高,可達96%的ee.該配體對其它底物醛也有較廣的適用性,ee值范圍在90% ~96%.配體在循環使用過程中活性隨著次數的增加有所降低.
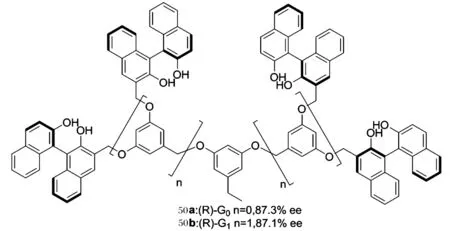
圖14 Frechet-typ型樹狀高分子負載的手性配體Figure 14 Frechet-type dendritic-based supported chiral ligands
2007年,Ma小組[50]報道的樹狀高分子負載的聯萘酚骨架配體50a、50b,在苯甲醛的乙基化反應中分別得到87.3%和87.1%的ee值,可見增加高分子的代數對配體的活性沒有較大的影響,但與未負載前的手性配體相比,對映選擇性稍微有所提高.通過配體在不同的溶劑中溶解性的不同,可以將負載的手型配體進行回收,回收3次后的配體50b在對映選擇性方面沒有任何的降低,仍可達到89.2%的ee值.
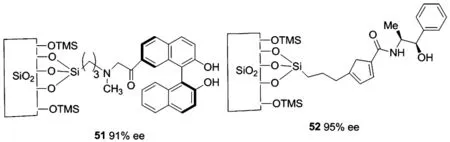
圖15 無機物二氧化硅固載的氨基醇配體Figure 15 silica-immobilized amino alcohol ligands
2008年,由Abdi小組[51]報道的無機物二氧化硅固載的聯萘酚配體51,在Ti(O-i-Pr)4-En2Zn存在下,對苯甲醛的乙基化可達大于99%的產率和94%的ee值,對其它底物的醛也有68%~91%的ee值.該配體在循環使用7次后活性也沒有明顯降低.載體硅孔徑的大小以及硅羥基上連有三甲基硅基團是配體具有高對映選擇性的關鍵.
2012年,由Vinu小組[52]報道的二氧化硅固載的氨基醇配體52,在Ti(O-i-Pr)4-En2Zn催化體系下,在二乙基鋅對醛的不對稱加成反應中表現出較高的活性和對映選擇性,在室溫條件下,手性二級醇可以得到92%的產率和95%的ee值,而配體用量很大(20 mol%),該配體對許多底物醛有較好的耐受性,得到47%~96%的ee值.催化循環兩次后對映選擇性降至70%,對映選擇性降低的原因可能是配體表面的活性位點被形成的產品所覆蓋所致.
9 結論
由于研究者們不懈的努力,烷基鋅對醛的不對稱加成已經成為合成手性二級醇的一種成熟方法,各種結構類型的手性配體已經顯示出很好的反應活性,如上述配體14、18、19、20等.然而目前沒有報道表明存在一種配體對各種醛的不對稱烷基化反應均能表現出很高的手性誘導作用,并且很多手性配體合成路線較長,甚至常常需要加入過量重金屬才能表現出較好的手性誘導效果,代價較高,這就需要我們繼續探索發展新的手性配體以滿足:高效率、普適性、低用量、對環境友好等條件.
[1]Oguni N,Omi T.Enantioselective addition of diethylzinc to benzaldehyde catalyzed by a small amount of chiral 2-amino-1-alcohols[J].Tetrahedron Lett.,1984,25(26):2823-2824.
[2]Kitamura M,Suga S,Kawai K,et al.Catalytic asymmetric induction.Highly enantioselective add-ition of dialkylzincs to aldehydes[J].J.Amer.Chem.Soc,1986,108(19):6071-6072.
[3](a)Noyori R,Kitamura M.Enantioselective Addition of Organometallic Reagents to Carbonyl Co-mpounds:Chirality Transfer,Multiplication,and Amplification[J].Angew.Chem.Int.Ed.,1991,30(1):49-69;(b)Soai K,Yokoyama S,Hayasaka T.Chiral N,N-di alk-yl no rephedrines as catalysts of the highly enantioselective addition of dialkylzincs to aliphatic and aromatic aldehydes.The asymmetric synthesis of secondary aliphatic and aromatic alcohols of high optical purity[J].J.Org.Chem.,1991,56(13):4264-4268;(c)Soai K,Niwa S.Enantioselective addition of organozinc reagents to aldehydes[J].Chem.Rev.,1992,92(5):833-856.
[4](a)Schmidt B,Seebach D.2,2-Dimethyl-α,α,α',α'-tetrakis(β-naphthyl)-1,3-dioxolan-4,5-dimet-hanol(DINOL)for the Titanate-Mediated Enantioselective Addition of Diethylzinc to Aldehydes[J].Angew.Chem.Int.Ed.,1991,30(10):1321-1323;(b)Harada T Kanda.Enantioselective Alkylation of Aldehydes Catalyzed by a Highly Active Titanium Complex of 3-Substituted Unsymmetric BINOL[J].Org.Lett.,2006,8(17):3817-3819;(c)Hatano M,Miyamoto T,Ishihara K 3,3‘-Diphosphoryl-1,1‘-bi-2-naphthol-Zn(II)Complexes as Conjugate Acid-Base Catalysts for Enantioselective Dialkylzinc Addition to Aldehydes[J].J.Org.Chem.,2006,71(17):6474-6484.
[5](a)Amat,M,Coll M D,Bosch J,et al.Total syntheses of the Strychnos indole alkaloids(-)-tubifoline,(-)-tubifolidine,and(-)-19,20-dihydroakuammicine[J].Tetrahedron:Asymmetry,1997,8(6):935-948;(b)Soai K,Niwa S,Yamada Y,et al.Chiral piperazine as a new chiral catalyst for the enantio-selective addition of dialkyl zincs to aryl aldehydes[J].Tetrahedron Lett.,1987,28(41):4841-4842;(c)Richmond M L,Seto C T.Modular Ligands Derived from Amino Acids for the Enantioselective Addition of Organozinc Reagents to Aldehydes[J].J.Org.Chem.,2003,68(19):7505-7508.
[6]Yamakawa M,Noyori r.Asymmetric Addition of Dimethylzinc to Benzaldehyde Catalyzed by(2S)-3-exo-(Dimethylamino)isobornenol.A Theoretical Study on the Origin of Enantioselection[J].Organometallics,1998,18(2):128-133.
[7]Omote M,Eto Y,Tarui A,et al.Syntheses of chiral β-amino α-perfluoroalkylpropanol derivatives[J].Tetrahedron:Asymmetry,2007,18(23):2768-2772.
[8]Tanaka T,Sano Y,Hayashi M.Chiral Schiff Bases as Highly Active and Enantioselective Catalysts in Catalytic Addition of Dialkylzinc to Aldehydes[J].Chemistry– An Asian Journal,2008,3(8-9):1465-1471.
[9]Yang X F,Hirose T,Zhang G Y.Synthesis of novel chiral tridentate aminophenol ligands for enantioselective addition of diethylzinc to aldehydes[J].Tetrahedron:Asymmetry,2008,19(14):1670-1675.
[10]Parrott Ii,R W,Hitchcock S R.β-Amino alcohols derived from(1R,2S)-norephedrine and(1S,2S)-pseudonorephedrine as catalysts in the asymmetric addition of diethylzinc to aldehydes[J].Tetrahedron:Asymmetry,2008,19(1):19-26.
[11]Banerjee S,Groeper J A,Standard J M,et al.N-Pyridylmethylephedrine derivatives in the catalytic asymmetric addition of diethylzinc to aldehydes and diphenylphosphinoylimines[J].Tetrahedron:Asymmetry,2009,20(18):2154-2161.
[12]Dean M A,Hitchcock S R.A structural examination of the impact of oxygenated side chains in Ephedra compounds in the catalytic asymmetric addition of diethylzinc to aldehydes[J].Tetrahedron:Asymmetry,2009,20(20):2351-2356.
[13]Binder C M,Bautista A,Zaidlewicz M,et al.Dual Stereoselectivity in the Dialkylzinc Reaction Using(-)-β -Pinene Derived Amino Alcohol Chiral Auxiliaries[J].J.Org.Chem.,2009,74(6):2337-2343.
[14]Dabiri M,Salehi P,Kozehgary G,et al.Enantioselective addition of diethylzinc to aromatic aldehydes catalyzed by 14-hydroxylsubstituted morphinans[J].Tetrahedron:Asymmetry,2008,19(16):1970-1972.
[15]Wu Z L,Wu H L,Wu P Y,et al.Asymmetric addition of diethylzinc to aldehydes catalyzed by a camphor-derived[small beta]-amino alcohol[J].Tetrahedron:Asymmetry,2009,20(13):1556-1560.
[16]Andres C,Infante R,Nieto J.ChemInform Abstract:Perhydro-1,3-benzoxazines Derived from(-)-8-Aminomenthol as Ligands for the Catalytic Enantioselective Addition of Diethylzinc to Aldehydes[J].ChemInform,2011,42(7):no-no.
[17]Sahin E,Kilic H.Synthesis of sterically constrained tricyclic pyrrolidinyl alcohol ligands for the enantioselective ethylation of aryl aldehydes:assessment of the influence of ring strain and N-alkyl chain length on asymmetric induction[J].Tetrahedron:Asymmetry,2011,22(3):277-282.
[18]Bulut A,Aslan A,Izgü E ,et al.Catalytic enantioselective addition of diethylzinc to aldehydes using aziridine based chiral ligands[J].Tetrahedron:Asymmetry,2007,18(8):1013-1016.
[19]Wang M C,Zhang Q J,Zhao W X,et al.Evaluation of Enantiopure N-(Ferrocenylme-thyl)azetidin-2-yl(diphenyl)methanol for Catalytic Asymmetric Addition of Organo-zinc Reagents to Aldehydes[J].J.Org.Chem.,2008,73(1):168-176.
[20]Rodriíguez-Escrich S,Reddy K S,Jimeno C,et al.Structural Optimization of Enantiopure 2-Cyclialkylamino-2-aryl-1,1-diphenylethanols as Catalytic Ligands for Enantioselective Additions to Aldehydes[J].J.Org.Chem.,2008,73(14):5340-5353.
[21]Liu R,Bai X,Zhang Z,et al.Efficient asymmetric addition of diethylzinc to aldehydes using 3-hydroxyazetidine derivatives as chiral ligands[J].Appl.Organomet.Chem.,2008,22(12):671-675.
[22]Lesniak S,Rachwalski M,Sznajder E,et al.New highly efficient aziridine-functionalized tridentate sulfinyl catalysts for enantioselective diethylzinc addition to carbonyl compounds[J].Tetrahedron:Asymmetry,2009,20(20):2311-2314.
[23]Jiang F Y,Liu B,Dong Z B,et al.Titanium(IV)as an essential promoter in the asymmetric addition of diethylzinc to aldehydes catalyzed by aminonaphthol and imine ligands based on 3-substituted binaphthol[J].J.Organomet.Chem.,2007,692(20):4377-4380.
[24]Liu B,Dong Z B,Fang C,et al.3-Substituted BINOL Schiff bases and their reductive products for catalytic asymmetric addition of diethylzinc to aldehydes[J].Chirality,2008,20(7):828-832.
[25]Dong Z B,Liu B,Fang C,et al.A facile synthesis and the asymmetric catalytic activity of BINOL-based thiazole(thiadiazole)thioether ligands[J].J.Organomet.Chem.,2008,693(1):17-22.
[26]Harada T,Ukon T.Practical and highly enantioselective alkylation of aldehydes catalyzed by a titanium complex of 3-aryl H8-BINOL[J].Tetrahedron:Asymmetry,2007,18(21):2499-2502.
[27]Arai T,Endo Y,Yanagisawa A.Salicylhydrazone ligands for enantioselective addition of diethylzinc to aldehydes[J].Tetrahedron:Asymmetry,2007,18(2):165-169.
[28]Pisani L,Superchi S.1,1'-Binaphthylazepine-based ligands for the enantioselective dialkylzinc addition to aromatic aldehydes[J].Tetrahedron:Asymmetry,2008,19(15):1784-1789.
[29]Gou S,Judeh Z M A.Enantioselective addition of diethylzinc to aromatic aldehydes catalyzed by Ti(IV)complexes of C2-symmetrical chiral BINOL derivatives[J].Tetrahedron Lett.,2009,50(3):281-283.
[30]Gao G,Bai X F,Yang H M,et al.Ar-BINMOLs with Axial and sp3 Central Chirality– Characterization,Chiroptical Properties,and Application in Asymmetric Catalysis[J].Eur.J.Org.Chem.,2011,2011(26):5039-5046.
[31]Manner S,Hansson C,Larsson J M,et al.Asymmetric baker’s yeast reductions of bridgehead-substituted bicyclo[2.2.2]octane-2,6-dione derivatives followed by conversion into catalytically active BODOLs for the diethylzinc addition to benzaldehyde[J].Tetrahedron:Asymmetry,2010,21(11–12):1374-1381.
[32]Burguete M I,Escorihuela J,Luis S V,et al.New chiral tetraaza ligands for the efficient enantioselective addition of dialkylzinc to aromatic aldehydes[J].Tetrahedron,2008,64(41):9717-9724.
[33]Melgar-Fernández R,González-Olvera R,Olivares-Romero J L,et al.Synthesis of Novel Derivatives of(1S,4S)-2,5-Diazabicyclo[2.2.1]heptane and Their Evaluation as Potential Ligands in Asymmetric Catalysis[J].Eur.J.Org.Chem.,2008,2008(4):655-672.
[34]Cheng Y Q,Bian Z,Kang C Q,et al.Chiral ligand 2-(2'-piperidinyl)pyridine:synthesis,resolution and application in asymmetric diethylzinc addition to aldehydes[J].Tetrahedron:Asymmetry,2008,19(13):1572-1575.
[35]Murtinho D,Elisa Silva Serra M,Rocha Gonsalves A M d A.Enantioselective ethylation of aldehydes with 1,3-N-donor ligands derived from(+)-camphoric acid[J].Tetrahedron:Asymmetry,2010,21(1):62-68.
[36]Qi G,Judeh Z M A.Structurally constrained C1-1,1'-bisisoquinoline-based chiral ligands:geometrical implications on enantioinduction in the addition of diethylzinc to aldehydes[J].Tetrahedron:Asymmetry,2010,21(4):429-436.
[37]Bisai A,Singh P K,Singh V K.Enantioselective diethylzinc addition to aldehydes catalyzed by Ti(IV)complex of unsymmetrical chiral bis(sulfonamide)ligands of trans-cyclohexane 1,2-diamine[J].Tetrahedron,2007.63(3):598-601.
[38]Sun J,Pan X,Dai Z,et al.Synthesis of new Schiff base-camphorsulfonyl amide ligands and in situ screening in the asymmetric additions of organozinc reagents to aldehydes[J].Tetrahedron:Asymmetry,2008,19(21):2451-2457.
[39]Venegas A,Rivas L,Huelgas G,et al.Asymmetric addition of diethylzinc to benzaldehyde catalyzed by novel chiral C2-symmetric tetrakis(sulfonamide)– titanium(IV)complexes[J].Tetrahedron:Asymmetry,2010,21(24):2944-2948.
[40]Bauer T,Smoliński S.Enantioselective addition of diethylzinc to aldehydes catalyzed by d-glucosamine derivatives:Highly pronounced effect of trifluoromethylsulfonamide[J].Applied Catalysis A:General,2010,375(2):247-251.
[41]Hirose T,Sugawara K,Kodama K.Switching of Enantioselectivity in the Catalytic Addition of Diethylzinc to Aldehydes by Regioisomeric Chiral 1,3-Amino Sulfonamide Ligands[J].J.Org.Chem.,2011,76(13):5413-5428.
[42]Parrott Ii,Hitchcock R W S R.Intramolecular chiral relay at stereogenic nitrogen:oxazolidine catalysts derived from Ephedra alkaloids[J].Tetrahedron:Asymmetry,2007,18(3):377-382.
[43]Parrott R W,Hamaker C G,Hitchcock S R.Salicylaldehyde based oxazolidines as catalysts for the asymmetric addition of diethylzinc to aldehydes[J].J.Heterocycl.Chem.,2008,45(3):873-878.
[44]B ocka E,Jaworska M,Kozakiewicz A,et al.Structural and electronic effects of oxazolidine ligands derived from(1R,2S)-ephedrine in the asymmetric addition of diethylzinc to aldehydes[J].Tetrahedron:Asymmetry,2010,21(5):571-577.
[45]Liu S,Wolf C.Chiral Amplification Based on Enantioselective Dual-Phase Distribution of a Scalemic Bisoxazolidine Catalyst[J].Org.Lett.,2007,9(16):2965-2968.
[46]Hua G,Liu D,Xie F,et al.The synthesis and application of novel C2-symmetric chiral N,N,O,O bisoxazoline ligands with a ferrocene backbone[J].Tetrahedron Lett.,2007,48(3):385-388.
[47]Kelsen V,Pierrat P,Gros P C.Enantioselective ethylation of aldehydes using a regenerable polymer-supported N-picolylvalinol tridentate ligand[J].Tetrahedron,2007,63(43):10693-10697.
[48]Hui X P,Chen C A,Wu K H,et al.Polystyrene-supported N-sulfonylated amino alcohols and their applications to titanium(IV)complexes catalyzed enantioselective diethylzinc additions to aldehydes[J].Chirality,2007,19(1):10-15.
[49]Chen C A,Wu K H,Gau H M.Synthesis and application of polymer-supported N-sulfonylated aminoalcohols as enantioselective catalysts[J].Poly,2008,49(6):1512-1519.
[50]Yin L,Li R,Wang F,et al.The synthesis of dendritic BINOL ligands and their applications in the asymmetric addition of diethylzinc to benzaldehyde[J].Tetrahedron:Asymmetry,2007,18(11):1383-1389.
[51]Pathak K,Ahmad I,Abdi S H R,et al.,The synthesis of silica-supported chiral BINOL:Application in Ti-catalyzed asymmetric addition of diethylzinc to aldehydes[J].J.Mol.Catal.A:Chem.,2008,280(1 –2):106-114.
[52]Balakrishnan U,Ananthi N,Velmathi S,et al.Immobilization of chiral amide derived from(1R,2S)-(-)-norephedrine over 3D nanoporous silica for the enantioselective addition of diethylzinc to aldehydes[J].Microporous Mesoporous Mater.,2012,155(0):40-46.

