替比夫定治療慢性乙型肝炎的效果及其對血清Th細胞因子水平的影響
邱春婷,王 怡,高麗英,韓 旭,郭 潔,馬 萍(天津市第二人民醫(yī)院,天津300192)
病毒持續(xù)復制和機體免疫清除反應,是慢性乙型肝炎發(fā)病的兩個基本因素。抗病毒治療能夠阻斷疾病進展,是慢性乙型肝炎的主要治療策略,但抗病毒治療應答程度與機體免疫狀態(tài)息息相關(guān)。在機體清除乙型肝炎病毒(HBV)的過程中,Th細胞通過分泌細胞因子發(fā)揮著重要作用。抗病毒治療過程中,細胞因子水平變化可反映機體免疫狀態(tài)的變化,并可能影響抗病毒治療的臨床結(jié)局。本研究通過觀察替比夫定治療期間HBeAg陽性慢性乙型肝炎患者外周血Th細胞相關(guān)細胞因子的變化,探討替比夫定對機體免疫功能的可能影響,為抗病毒治療預后提供參考。
1 資料與方法
1.1 臨床資料 納入標準:①慢性乙型肝炎臨床診斷符合2000年西安全國病毒性肝炎會議制定的診斷標準[1];②治療前 HBsAg、HBeAg陽性且陽性史至少6個月;③血漿HBV DNA≥105copies/mL;④ALT水平升高且≥1倍正常參考值上限(ULN)。排除標準:①肝細胞癌;②失代償性肝病;③血清膽紅素≥10倍ULN;④凝血機制異常;⑤由其他原因造成的活動性肝病,包括同時感染丙肝病毒、丁肝病毒、獲得性免疫缺陷病毒者,或存在自身免疫性肝病者。收集2009年10月~2011年1月在天津市傳染病醫(yī)院就診的HBeAg陽性慢性乙型肝炎患者58例,依肝功能損傷程度分為輕度組14例、中度組24例、重度組20例。輕度組男9例、女5例,年齡(32.6±15.2)歲;ALT(156.8 ± 26.2)U/L,TBIL(26.6 ±6.2)μmol/L,ALB(37.8 ±2.6)g/L,HBV DNA 載量 7~8 log10 copies/mL ,HBeAg定量 >4 000 COI。中度組男15 例、女9 例,年齡(36.4 ±14.6)歲;ALT(258.6±108.2)U/L,TBIL(58.4 ±16.2)μmol/L,ALB(34.6±3.2)g/L,HBV DNA 載量6 ~6.99 log10 copies/mL,HBeAg定量2 000~3 999 COI;重度組男16例、女4例,年齡(39.8 ± 15.4)歲;ALT(486 ± 146.8)U/L,TBIL(92.6 ± 26.8)μmol/L,ALB(31.4 ± 2.8)g/L,HBV DNA 載量5~5.99 log10 copies/mL,HBeAg定量 <2 000 COI。
1.2 方法
1.2.1 治療方法 患者給予替比夫定600 mg/d抗病毒治療,療程為48周。
1.2.2 觀察指標 治療前后,檢測各時相點肝功能、HBV DNA載量、HBeAg定量;治療前及治療12、24、48周時,留取各時點血清,-70℃凍存,檢測血清Th1細胞相關(guān)細胞因子IFN-γ和Th2細胞相關(guān)細胞因子IL-4、IL-10。肝功能采用美國貝克曼公司CX7型全自動生化分析儀檢測,試劑由貝克曼公司提供;HBeAg定量采用羅氏公司全自動生化免疫工作站檢測,HBeAg<1.0 COI為陰性,>1.0 COI為陽性,采用羅氏公司原裝試劑;HBV DNA定量檢測采用羅氏COBASAMPLICOR HBV MONITOR進行,檢測下限為103copies/mL,試劑購自達安公司;采用ELISA 法檢測 IFN-γ、IL-4、IL-10,試劑盒購自美國PeproTech公司,單位為pg/mL。
1.2.3 療效評價標準[2]①生化學應答:完全應答為ALT、TBIL和ALB水平恢復正常,未達上述標準為無應答。②病毒學應答:完全應答為HBV DNA<103copies/mL,部分應答為未達完全應答標準但HBV DNA定量下降≥2個對數(shù)級,無應答為未達上述標準。③血清免疫學應答:完全應答為HBeAg/HBeAb血清轉(zhuǎn)換,部分應答為HBeAg未轉(zhuǎn)陰或轉(zhuǎn)陰但未出現(xiàn)HBeAb,未達上述標準為無應答。綜合療效評價:完全應答為療程結(jié)束時,生化學、病毒學和血清免疫學指標均達到完全應答者;部分應答為療程結(jié)束時,取得生化學完全應答、病毒學指標定量下降≥2個對數(shù)級但未發(fā)生HBeAg血清轉(zhuǎn)換;無應答為未達到以上標準。
1.2.4 統(tǒng)計學方法 采用SPSSl7.0統(tǒng)計軟件。各組數(shù)據(jù)采用M(四分位間距Q)表示,多組比較采用H檢驗(Kruskal-Wallis H),多個獨立樣本兩兩比較采用Nemenyi法檢驗。P≤0.05為差異有統(tǒng)計學意義。
2 結(jié)果
2.1 替比夫定治療48周后總體應答情況 患者均有不同程度應答,其中完全應答15例(25.86%)、部分應答43例(74.14%)。輕度組完全應答1例(7.10%)、部分應答 13 例(92.86%),中度組分別為3 例(8.33%)、21 例(87.5%),重度組分別為11例(55.00%)、7 例(45.00%)。三組之間比較,P <0.05。
2.2 替比夫定治療后各組血清細胞因子水平變化與同組治療前比較,重度組治療12、24、48周血清IFN-γ 水平逐漸升高(P 均 <0.05),治療24、48周血清IL-4、IL-10水平逐漸下降(P均<0.05);輕、中度組各時點 IFN-γ、IL-4和 IL-10比較,P 均 >0.05。見表1。完全應答者治療12周后血清IFN-γ水平逐漸升高(P<0.05),治療24周后血清IL-4和IL-10水平逐漸下降(P均<0.05);部分應答者治療后各時點血清 IFN-γ、IL-4和 IL-10比較,P 均 >0.05。見表2。
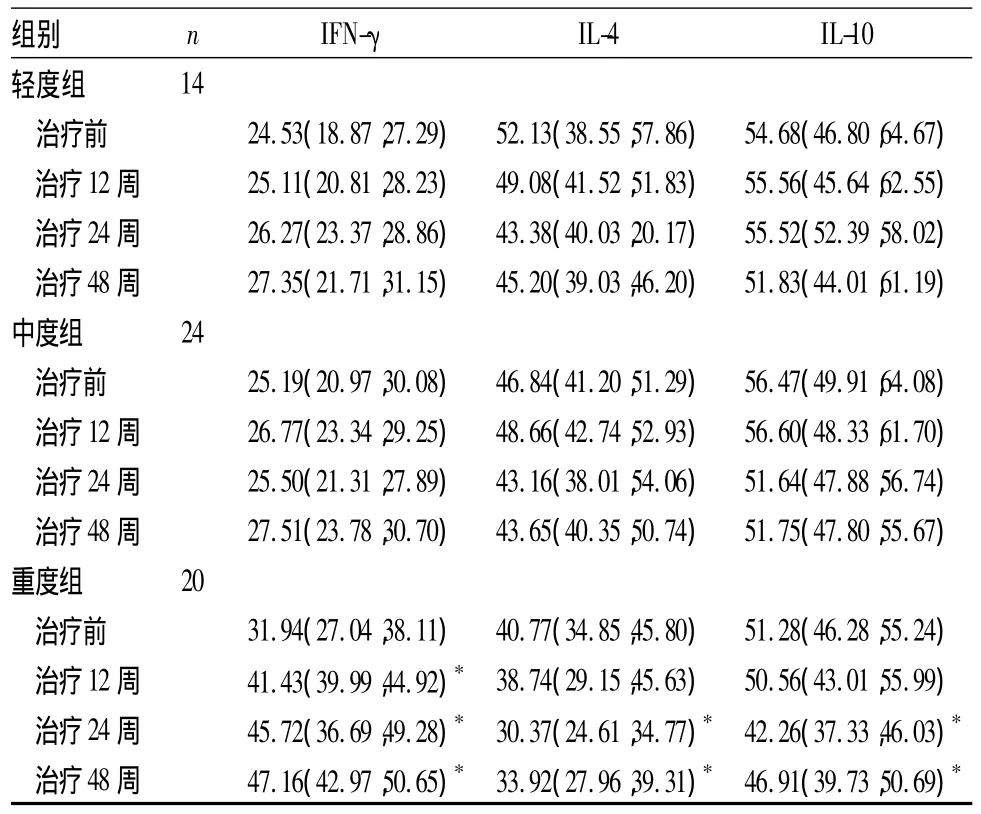
表1 治療前后各組血清IFN-γ、IL-4和IL-10水平變化[pg/mL,M(Q1,Q3)]
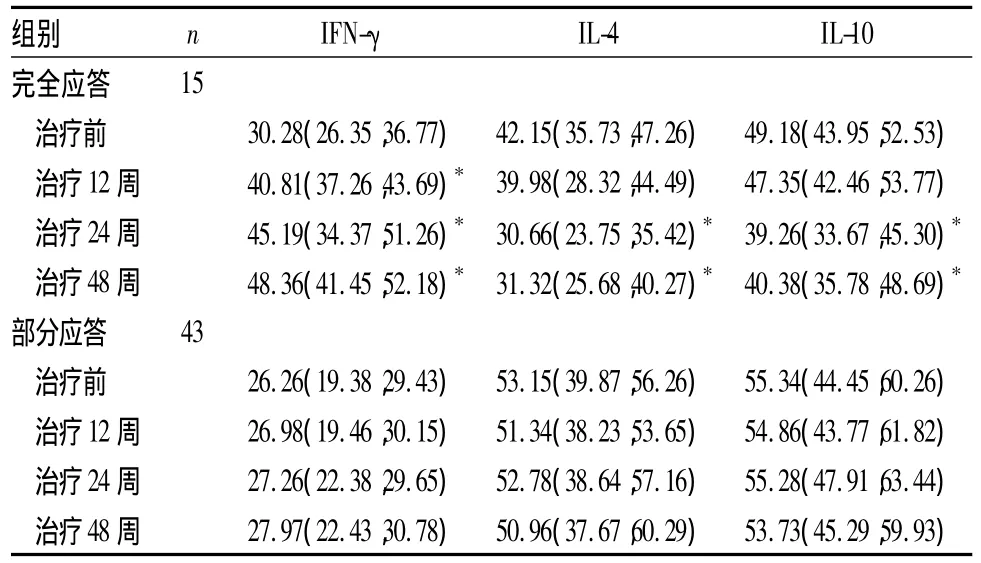
表2 慢性乙型肝炎不同應答患者血清IFN-γ、IL-4和 IL-10水平變化[pg/mL,M(Q1,Q3)]
3 討論
慢性乙型肝炎是一種世界范圍的高發(fā)性、慢性傳染病,病程長,不易根治[3]。我國的慢性乙型肝炎病情嚴峻,嚴重危害人民的身體健康,抗病毒治療尤為重要。替比夫定是一種新型的左旋核苷類似物,抗病毒作用強,能有效抑制HBV復制,起效快,不良反應小,臨床耐藥率低[4]。本研究結(jié)果顯示,患者經(jīng)替比夫定治療均取得不同程度應答,其中完全應答率為25.86%,部分應答率為74.14%;重度組完全應答率為55.00%,部分應答率為45.00%。結(jié)果表明,替比夫定具有快速、強效抑制HBV復制及較好的HBeAg血清學轉(zhuǎn)換作用,與季尚瑋等的研究結(jié)果一致[5]。另外,本研究還顯示,肝功能損傷重度患者抗病毒應答率高,考慮與重度肝損傷患者免疫系統(tǒng)被激活,免疫應答增強所致,更進一步支持HBV感染人體后引起肝臟病變及抗病毒治療效果與人體的免疫狀態(tài)有關(guān)。
目前研究認為,慢性乙型肝炎是一種免疫介導的疾病,細胞因子在其發(fā)病過程中的作用日益受到重視。Th細胞是機體內(nèi)一類重要的免疫調(diào)節(jié)細胞,根據(jù)細胞因子分泌模式的差異可分為Th1、Th2兩類[6]。Th1 細胞主要分泌 IFN-γ、IL-2、IL-12、TNF-α,介導細胞免疫應答,對細胞毒性T細胞的功能有輔佐作用[7];Th1細胞有利于B淋巴細胞產(chǎn)生有調(diào)理作用的抗體(如IgG、IgA)和與補體相結(jié)合的抗體(如IgM、IgG),促進巨噬細胞的活化,引起T淋巴細胞介導的細胞毒作用和細胞免疫,同時加重肝損傷[8];另外,Th1型細胞在抗細胞內(nèi)微生物感染方面發(fā)揮重要作用。Th2細胞主要分泌IL-4、IL-6、IL-10等細胞因子,主要調(diào)節(jié)體液免疫反應,在抵抗細胞外致病因子方面發(fā)揮作用[9]。IFN-γ是Th1細胞主要分泌的一種細胞因子,可以抑制病毒復制,并可增加Ⅰ類主要組織相容性抗原分子的表達,以促進細胞毒性T淋巴細胞(CTL)介導的病毒感染細胞的殺傷,增強免疫應答,促進 HBV 清除[10]。IL-4、IL-10主要由Th2細胞產(chǎn)生,其中IL-10是一種強有力的免疫和炎癥抑制因子,能抑制自然殺傷細胞因子的產(chǎn)生,降低細胞免疫功能及T淋巴細胞的功能,減弱機體的抗病毒免疫,能介導體液免疫使機體不能有效清除受病毒感染的肝細胞,造成感染的慢性化。有文獻報道,Th1/Th2的平衡在HBV感染人體后病情發(fā)展中起決定作用[11]。
有學者認為,抗病毒藥物除直接抗HBV外,通常還通過影響細胞因子變化來達到調(diào)節(jié)免疫的作用[12]。已有動物實驗研究證實,替比夫定可提高Th1細胞因子的產(chǎn)生,抑制Th2細胞因子,提示替比夫定具有免疫調(diào)節(jié)作用[13,14]。本研究通過應用替比夫定對HBeAg陽性慢性乙型肝炎患者進行干預治療,檢測治療后不同時點Th1/Th2細胞因子水平,分析應答情況與細胞因子的關(guān)聯(lián)性,并觀察不同肝功能損傷程度替比夫定治療后細胞因子的變化規(guī)律,試圖從免疫學方面得出預測抗病毒治療療效的有價值指標。
本文研究結(jié)果顯示,肝功能損傷重度者替比夫定抗病毒治療后Th1細胞因子IFN-γ水平顯著升高,較治療前比較差異有統(tǒng)計學意義,提示細胞免疫功能激活,能有效清除體內(nèi)的HBV;而輕、中度損傷者IFN-γ水平治療前后無明顯變化,考慮與患者的細胞免疫功能低下,不能有效清除體內(nèi) HBV,使HBV持續(xù)感染,形成機體對HBV的免疫耐受。與之相對應,肝功能損傷重度者抗病毒治療后有更高的完全應答率,提示IFN-γ與抗病毒治療應答狀況有相關(guān)性;抗病毒治療可促進Th1細胞因子分泌,特別是IFN-γ的分泌,從而調(diào)動機體對HBV的細胞免疫,有利于病毒的清除[15]。另外,經(jīng)替比夫定治療后,肝功能損傷重度者血清IL-4、IL-10水平較治療前明顯下降,差異有統(tǒng)計學意義;而輕、中度損傷者治療后血清IL-4、IL-10水平較治療前均無明顯變化,提示IL-4、IL-10與抗病毒治療應答亦有相關(guān)性,完全應答率高者這兩種細胞因子的水平降低更明顯。上述結(jié)果表明,替比夫定有提升慢性乙型肝炎患者血清Th1細胞因子水平、降低Th2細胞因子水平的作用,與王煜等的研究結(jié)果一致[16]。
綜上所述,替比夫定在發(fā)揮抗HBV感染的同時,還能從免疫學方面通過調(diào)節(jié)細胞因子水平發(fā)揮清除HBV的作用。因此,早期測定血清IFN-γ、IL-4、IL-10等細胞因子水平,可預測抗病毒治療的療效,并根據(jù)患者免疫狀況選擇合適的時機對機體免疫應答進行干預,盡可能在短的時間內(nèi)實現(xiàn)較高的HBeAg血清轉(zhuǎn)換率與持久應答。
[1]中華醫(yī)學會傳染病與寄生蟲病學分會、肝病學分會.病毒性肝炎防治方案[J].中華肝臟病雜志,2000,8(6):342-329.
[2]拉米夫定臨床應用專家組.2004年拉米夫定臨床應用專家共識[J].中華肝臟病雜志,2004,12(7):425.
[3]趙學輝,楊介鉆,魏麗,等.抗病毒治療過程中慢性乙型肝炎患者外周血漿IL-18和IL-10水平變化及臨床意義[J].中國衛(wèi)生檢驗雜志,2010,20(11):2852-2853.
[4]黃遵仁.替比夫定對慢性乙肝患者血漿細胞因子的影響及療效觀察[J].中國藥師,2012,15(8):1165-1166.
[5]季尚瑋,徐嚴,張永貴,等.替比夫定治療HBeAg陽性慢性乙型肝炎[J].中華傳染病雜志,2012,30(10):624-627.
[6]劉平,李建團,穆懷暢,等.IFN-α對老年女性丙型病毒性肝炎患者Th1/Th2型細胞因子的影響[J].中國老年學雜志,2011,31(24):4802-4803.
[7]席宏麗,柳芳芳,袁家穎,等.乙型肝炎病毒感染者外周血單個核細胞內(nèi)IL-2、IL-4和 IFN-γ檢測及意義[J].臨床肝膽病雜志,2010,26(6):627-629.
[8]彭丹紅,龔環(huán)宇,劉振國,等.核苷類似物抗病毒治療對乙型肝炎肝硬化患者血清Th1/Th2型細胞因子水平的影響及臨床意義[J].中西醫(yī)結(jié)合肝病雜志,2011,21(3):145-151.
[9]馬學莉.拉米夫定治療變異后慢性乙型肝炎患者血清IFN-γ和IL-10的測定及臨床意義[J].醫(yī)藥論壇雜志,2010,31(23):62-64.
[10]Paul S,Tabassum S,lslam MN.Interfeorn-gamma(IFN-gamma)response to different Hepatitis B virus antigens in hepatitis B virus infection[J].Bangladesh Med Res Counc Bull,2004,30(2):71-77.
[11]郭塹.阿德福韋酯對慢性乙型肝炎患者Th1/Th2型細胞因子和纖維化指標的影響[J].實用臨床醫(yī)藥雜志,14(11):19-21.
[12]趙學輝,楊介鉆,胡云良,等.抗病毒治療過程中慢性乙型肝炎患者外周血輔助性T細胞因子的變化[J].中華傳染病雜志,2011,29(11):664-668.
[13]Wu ZG,Yan WM,Guo W,et al.Telbivudine preserves T-helper 1 cytokine production and downregulates programmed death ligand 1 in a mouse model of viral hepatitis[J].Viral Hepat,2010,17(1):24-33.
[14]黃勝,黃躍成,黃偉,等.替比夫定治療e抗原陰性的慢性乙型肝炎療效觀察[J].山東醫(yī)藥,2012,52(31):52-54.
[15]盧俊敏,馬麗娜,趙中夫,等.核苷類藥物抗病毒治療對HBV感染者血清IFN-γ和IL-2水平的影響及臨床意義[J].長治醫(yī)學院學報,2008,22(6):405-407.
[16]王煜,焦運,彭曉明,等.替比夫定對HBeAg陽性慢性乙型肝炎患者細胞免疫應答的影響[J].中華傳染病雜志,2011,29(10):623-624.

