唑來膦酸聯合甲羥孕酮治療惡性腫瘤骨轉移的療效分析
羅麗華 冉瑞智 羅流芳 幸茂輝 張 倩
骨轉移是惡性腫瘤常見并發癥,我們采用唑來膦酸聯合甲羥孕酮治療惡性腫瘤骨轉移,現將結果報告如下。
1 資料與方法
1.1 一般資料
60例惡性腫瘤患者均為Ⅳ期,均經病理或細胞學診斷,同時經過ECT(骨掃描)、MRI、CT或X線等影像學檢查證實為骨轉移,并且伴有中度或以上骨痛。60例中男性40例,女性20例,年齡35~67歲,中位年齡54.8歲;肺癌30例,前列腺癌10例,乳腺癌20例。剔除標準:①治療前接受過激素類藥物治療;②有高血壓、糖尿病和血栓病史;③接受腸內、外高營養治療(包括輸血及蛋白類生物制劑);④肝腎功能及血常規異常。60例隨機分為治療組與對照組,2組在性別、年齡、病情及病程方面均無顯著性差異。
1.2 方法
對照組單純給予唑來膦酸(南京制藥)4 mg、生理鹽水250 m l,靜脈滴注,時間至少30min,每3周給藥1次,連用2次。治療組在對照組的基礎上加用甲羥孕酮片500 mg,口服,每日2次,連用6周。
1.3 療效評定
觀察與唑來膦酸、甲羥孕酮有關的不良反應,如發熱、水腫、血糖升高、陰道出血及深部靜脈血栓形成等。治療前及治療中每周測1次體重,并記錄每日進食量。每周至少查1次血常規及1次肝腎功能、血漿白蛋白及血糖。
1.3.1 止痛療效評價 按WHO疼痛程度分級標準劃分為0級:無疼痛;Ⅰ級(輕度):略有疼痛,患者可以耐受,對正常生活無影響;Ⅱ級(中度):疼痛顯著,不可以忍受,需要服用鎮痛藥物,正常生活和睡眠受影響;Ⅲ級(重度):疼痛劇烈,不可以耐受,需要服用鎮痛藥物,正常生活和睡眠受到嚴重影響,伴有植物神經功能紊亂表現或出現被動體位。止痛評價標準:完全緩解(CR):治療后完全無痛;部分緩解(PR):疼痛較給藥前明顯減輕,睡眠基本不受干擾,能正常生活;輕度緩解(MR):疼痛較給藥前減輕,但仍感明顯疼痛,睡眠仍受干擾;無效(NR):與治療前比較無減輕[1]。
1.3.2 厭食及體重 厭食的改善以進食量為標準,治療后食量較治療前增加50%以上為增加,治療后食量增加不足50%,但超過25%為穩定,治療后食量增加不足25%或無增加或減少均為無效。體重:治療后較治療前體重增加或減少1 kg者為增加或減少,增加或減少未超過1 kg者為穩定。
1.3.3 卡氏評分 以Karnofsky評分標準為指標,治療結束后較治療前上升≥10分為增加,下降≥10分為下降,變化在10分以內為穩定。
1.4 統計學處理
應用SPSS 13.0統計軟件,采用卡方檢驗,以P<0.05為差異有顯著性。
2 結果
2.1 止痛效果
對照組止痛效果總有效率為66.7%,治療組止痛總有效率為 93.3%,2 組差異有統計學意義,χ2=5.10,P <0.05,見表1。
治療后7天,疼痛緩解率治療組為76.7%,對照組為56.7%,治療組較對照組緩解率高,但無統計學差異,P=0.17。治療后14天,2組疼痛緩解率分別為83.3%和56.7%,認為加用甲羥孕酮可明顯縮短疼痛緩解時間,統計學比較有顯著差異,P <0.05。見表2。

表1 2組治療后止痛療效情況(例,%)
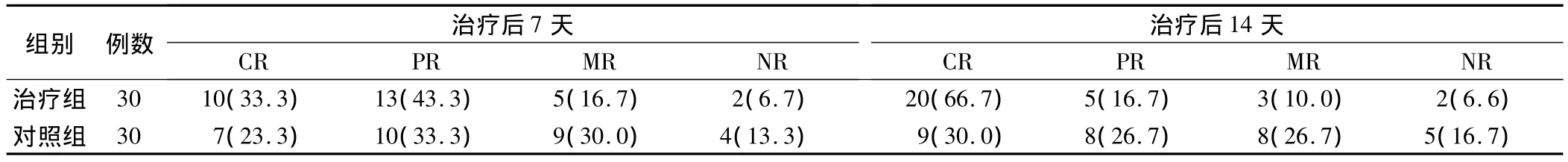
表2 2組在治療后7天和14天疼痛緩解率比較(例,%)
2.2 食量和體重
比較2組治療前后食量及體重的變化,唑來膦酸加用甲羥孕酮在改善食量及體重方面的效果明顯優于單純唑來膦酸組,統計學比較有顯著差異(P<0.05),見表3。

表3 2組治療后食量及體重的變化(例,%)
2.3 卡氏評分
比較2組治療前后卡氏評分的變化,唑來膦酸加用甲羥孕酮對卡氏評分的增加明顯優于單純唑來膦酸組,統計學比較有顯著差異(χ2=6.90,P <0.01),見表4。

表4 2組治療后卡氏評分情況(例,%)
2.4 血漿白蛋白及血紅蛋白
治療后血漿白蛋白較治療前平均增加治療組為(1.3±2.8),對照組為(-10.2 ±11.8);血紅蛋白平均增加治療組為(-2.7±11.4),對照組為(-2.1 ±3.3)。可見唑來膦酸加用甲羥孕酮治療后血漿白蛋白及血紅蛋白的增加效果明顯優于單純唑來膦酸組,顯示出甲羥孕酮的蛋白同化作用,統計學比較有顯著差異(χ2=12.0,P <0.05)。
2.5 不良反應
全組60例中,不良反應多為Ⅰ~Ⅱ度,主要包括低熱、骨痛一過性加重、輕度下肢水腫、輕度血糖升高,均未行特殊處理,自行緩解。
3 討論
骨轉移是惡性腫瘤常見的并發癥,病變以溶骨性破壞為主,主要表現為骨痛、活動受限、高鈣血癥、脊髓壓迫及病理性骨折等[2]。一般認為骨轉移癌引起疼痛的機制為:①浸潤至骨膜及周圍組織;②惡性腫瘤細胞和宿主細胞分泌的體液因子刺激破骨細胞,使溶骨過程增強,破壞了骨吸收與骨形成之間的平衡,造成骨破壞;③腫瘤細胞或附近炎癥細胞分泌前列腺素、白介素-1、腫瘤壞死因子等至痛性遞質,刺激末梢神經,從而增加了機體對痛覺刺激的敏感性。如何減輕骨轉移癌引起的疼痛,提高患者的生活質量是近年來的研究熱點。
雙磷酸鹽治療骨轉移引起的骨質破壞及惡性腫瘤引起的高鈣血癥已有10余年歷史,其中唑來膦酸是第三代雙磷酸鹽類骨吸收抑制劑,通過抑制甲醛戊酸生物合成通路及焦磷酸法尼酯合成酶的活性,來抑制破骨細胞活性和過量的骨吸收,減少其對骨質的破壞。同時唑來膦酸可減少和抑制腫瘤細胞釋放的各種細胞因子(如IL-6、腫瘤壞死因子等),減少骨骼中鈣的釋放,降低血清鈣濃度,從而減輕骨破壞,緩解骨痛癥狀。因此,唑來膦酸作為目前藥理活性最強的1種雙磷酸鹽,被首個批準用于多發性骨髓瘤、肺癌、乳腺癌等腫瘤骨轉移的治療[3]。
醋酸甲羥孕酮屬于人工合成孕激素中的17A-羥孕酮類,抑制下丘腦-垂體系統和轉化子宮內膜。由于合成類孕激素的不同來源,在發揮孕激素作用的同時,還可以表現出其他甾體激素樣的作用,特別是長期使用或大量使用時,17A-羥孕酮類可以有抗雄激素和糖皮質激素樣作用[4]。大量的臨床研究表明,大劑量甲羥孕酮對非激素敏感性腫瘤患者不僅能改善食欲和增加體重,促進蛋白同化,使機體組織成份特別是脂肪組織實質性增加,導致基礎體力、蛋白質、熱量及鈉攝取增加,維持正氮平衡(惡性腫瘤大多數呈負氮平衡)[5];還能減輕癌痛,降低化療藥物對骨髓及胃腸道的毒副作用,全面提高化療期癌癥患者的生活質量及對化療的耐受性。本臨床觀察結果與國內文獻[6]報道一致,同時血漿蛋白水平客觀指標增加治療組明顯優于對照組,顯示出甲羥孕酮骨髓保護作用。其機制可能為大劑量MPA抑制多能前體細胞的分裂活動和分化成相應細胞的過程,抑制造血干細胞的有絲分裂活性,使干細胞處于 G0期,保護分化中粒細胞及紅細胞的前體細胞免受化療藥物的攻擊,同時起到動員骨髓儲存池粒細胞到外周血的作用[7]。
因此唑來膦酸聯合甲羥孕酮治療惡性腫瘤骨轉移療效肯定,臨床獲益較大,副作用少,使用方便,值得進一步研究推廣。
[1] Egol K A,Connor PM,Karunakar M A,et al.The floating shoulder:clinical and function ~ results〔J〕.J Bone Joint Surg Am,2001,83(8):1188.
[2] 孫 燕,石遠凱.臨床腫瘤內科手冊〔M〕.第5版.北京:人民衛生出版社,2007:135~145.
[3] 夏環玲,梁彬彬,楊京華.唑來膦酸治療惡性腫瘤骨轉移臨床觀察〔J〕.中國現代藥物應用,2010,4(7):147.
[4] 李揚志,謝梅青.孕激素制劑分類及臨床應用特點〔J〕.實用婦科雜志,2011,27(1):5.
[5] 張天澤,徐光煒.腫瘤學〔M〕.天津:天津科技出版社,1996:2638~2639.
[6] 盧計珍,雷 霞,秦 怡.CAP聯合甲羥孕酮治療晚期乳腺癌25例療效觀察〔J〕.實用癌癥雜志,2007,22(4):390.
[7] 何 朗,李光明,文世民.甲羥孕酮減輕化療患者骨髓抑制臨床觀察〔J〕.華西醫學,2010,25(5):865.

