妊娠期糖尿病孕婦及胎兒胰島素與游離脂肪酸分析
朱自強,曹 芳,黃瑞萍,虞 斌,王慧艷,王新紅,張 銘,王秋偉
妊娠期糖尿病(gestational diabetes mellitus,GDM)是指妊娠期間首次發現或發生的不同嚴重程度的糖耐量異常,其發病率在我國呈迅速升高趨勢,嚴重影響了母嬰健康。近年來國內外研究發現,對GDM孕婦進行飲食控制,能夠有效降低母親血糖與血脂水平,并改善不良妊娠結局。然而血糖控制是否能夠有效阻斷GDM孕婦子代糖尿病等代謝性疾病的發生仍然沒有明確的依據與結論[1-2]。本研究從胎兒起源學說的角度,試圖探討經血糖控制后,GDM孕婦胎兒是否具有正常的血糖、血脂與胰島素代謝水平,為預防與控制其子代糖尿病等代謝性疾病的發生發展提供研究基礎和臨床思路。
1 資料與方法
1.1一般資料本研究通過常州市衛生局及常州市婦幼保健院倫理委員會批準,并且參與試驗的患者簽署了相關知情同意書。在2010年6月—2011 年7月,常州市婦幼保健院產科定期產檢并住院分娩的GDM孕婦中,按照GDM患者初次確診的時間順序,按隨機數字順序表,隨機錄取GDM患者為研究候選人,并進一步選擇其中經飲食控制轉為正常血糖水平的81例為GDM組;另外,按照健康孕婦初次確診妊娠的時間順序,按隨機數字順序表,隨機分配86例至對照組。GDM診斷按國內的標準,即至孕24~28周行葡萄糖負荷試驗(50 g葡萄糖粉溶于200 ml水中5 min內喝完,1 h后測血糖),如果≥7.8 mmol/L則進一步進行75 g糖耐量檢查,若其中兩項值超過參考值即診斷為GDM。兩組孕婦既往均無GDM除外的高血壓、內分泌代謝性疾病及肝臟病史等其他妊娠合并癥與并發癥。最終,研究對象中GDM組取得胎兒臍血65例,對照組取得胎兒臍血47例。
1.2研究方法(1)標本收集:兩組孕婦于分娩前一周,清晨空腹采母體肘靜脈血,于分娩時取新生兒臍靜脈血,胎兒胎盤娩出后鉗夾臍帶兩端,在臍帶兩端正中立即用5 ml注射器刺入臍靜脈,抽取4 ml左右臍血,2 000 r/min離心(離心半徑為15 cm)后,取上清液置于-80 ℃低溫冰箱內保存。(2)檢測方法:電化學發光法檢測母血清及臍血的胰島素(COBAS e601全自動電化學發光免疫分析儀,德國);采用生化分析儀檢測血清及臍血的血糖、游離脂肪酸(NEFA)、總膽固醇(TC)和三酰甘油(TG)(Hitachi 7180全自動生化分析儀,日本)。
2 結果
2.1基本情況兩組孕婦身高與孕周的差異無統計學意義(P>0.05),但年齡、孕前體質量與孕前BMI值間差異有統計學意義(P<0.05,見表1)。為避免年齡、孕前體質量與孕前BMI的干擾,在統計母胎的血糖、血脂與胰島素代謝指標時,均對年齡及孕前BMI進行校正。
2.2兩組孕婦血糖、血脂及胰島素情況對GDM孕婦經飲食控制后,血糖控制在正常范圍內。兩組血糖TG、TC、NEFA水平間差異無統計學意義(P>0.05),但胰島素水平間差異有統計學意義(P<0.05,見表2)。
2.3兩組胎兒血糖、血脂及胰島素情況兩組胎兒臍血的血糖、TG、TC水平間差異無統計學意義(P>0.05),但NEFA、胰島素水平間差異有統計學意義(P<0.05,見表3)。

Table1Comparison of general information of pregnant women between two groups

組別例數年齡(歲)身高(cm)孕前體質量(kg)孕前BMI(kg/m2)孕周(周)GDM組8130±4161±557±1022.0±3.538.8±1.0對照組8628±3161±453±720.5±2.339.0±1.2t值2.660-0.2792.7933.062-1.456P值0.009 0.7810.0050.002 0.147
注:GDM=妊娠期糖尿病,BMI=體質指數

Table2Comparison of glucose,lipids and insulin of pregnant women between two groups

組別例數血糖(mmol/L)三酰甘油*(mmol/L)總膽固醇(mmol/L)游離脂肪酸(mmol/L)胰島素*(mU/L)GDM組814.7±1.04.27±2.716.84±2.031.01±0.4725±15對照組864.7±0.73.73±1.097.24±1.290.95±0.3715±8F值▲0.8070.3561.4730.1068.675P值 0.3070.5520.2270.7460.004
注:*對數轉化偏斜數據后進行統計分析;▲對孕婦年齡及孕前BMI進行校正

Table3Comparison of glucose,lipids and insulin of fetus between two groups
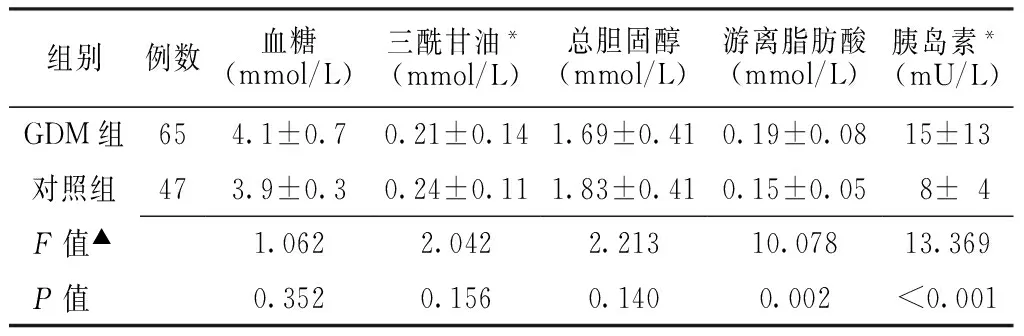
組別例數血糖(mmol/L)三酰甘油*(mmol/L)總膽固醇(mmol/L)游離脂肪酸(mmol/L)胰島素*(mU/L)GDM組654.1±0.70.21±0.141.69±0.410.19±0.0815±13對照組473.9±0.30.24±0.111.83±0.410.15±0.05 8±4 F值▲1.0622.0422.21310.07813.369P值 0.3520.1560.1400.002<0.001
注:*對數轉化偏斜數據后進行統計分析;▲對孕婦年齡與孕前BMI進行校正
3 討論
本研究顯示GDM組胎兒的NEFA與胰島素水平比正常組胎兒升高。這與其他國家和種族的試驗結果相一致[2-4]。本研究對經飲食控制達到正常血糖水平的GDM孕婦研究發現,其血脂代謝有所改善,跟正常孕婦無差異;但是胰島素水平仍高于對照組,與國外已有研究結果相似[2-5]。GDM的發生主要經歷胰島素抵抗、高胰島素血癥、β細胞分泌功能受損的過程[6]。GDM組胰島素水平仍高于對照組,說明GDM孕婦的胰島素生物活性或效應沒有改善至正常水平。
本研究顯示雖然兩組孕婦血脂(TG、TC與NEFA)間無差異,但是GDM母親胎兒中NEFA水平仍升高,這可能是由GDM患者的母胎兩方面共同導致的。一方面,最近研究報道在GDM孕婦的胎盤中,與脂質合成和轉運途徑相關的基因與蛋白增強表達[7-8],提示參與了胎兒體內循環中NEFA的增高。另一方面,GDM母親胎兒體內存在的高胰島素血癥,能夠增強胎兒脂肪組織的脂質分解活性,從而進一步提高其胎兒血清中的NEFA水平。
經飲食控制血糖正常后,GDM孕婦仍存在高胰島素血癥。雖然胰島素不能直接通過胎盤,但本研究發現GDM母親胎兒仍存在增高的胰島素水平,提示較高的胰島素抵抗水平。GDM母體胰島素如何間接影響其胎兒的胰島素水平,至今仍是國內外未能完全解決的重大問題。目前國際最新研究提示,母體的高胰島素水平可能通過母胎代謝或表觀遺傳學的機制影響其胎兒的胰島素水平[4,9-10]。其中,NEFA是目前公認的致胰島素抵抗因子之一,它可影響胰島素信號轉導的多個環節,如抑制胰島素受體酪氨酸的磷酸化、降低磷脂酰肌醇激酶和葡萄糖轉運蛋白的活性等[11-12]。本研究證實GDM母親胎兒體內存在增高的NEFA水平,因此推測NEFA水平的增高可能是促進GDM母親胎兒胰島素水平增高的重要因素之一,進而引起胰島素抵抗,產生高胰島素血癥[7-8]。
糖尿病易感者在發病前往往已有高胰島素血癥,糖調節受損階段血脂出現紊亂。尤其是NEFA的增高對胰島素抵抗及胰島β細胞功能的影響有著不可忽視的影響,NEFA的升高也是除胰島素抵抗之外的2型糖尿病發病的獨立危險因素。隨著研究的深入,人們已逐漸認識到以高血糖癥與血脂異常不僅與糖尿病并發癥的發生和進展密切相關,同時也可能是2型糖尿病發生的始動因素。因此本研究認為GDM母親胎兒體內NEFA與胰島素的增高,可能是其子代成年后糖尿病發生的重要初始因素。通過調節GDM母體代謝,為胎兒創造良好的宮內環境,可能是降低其胎兒成年期糖尿病發病的有效途徑,從而最終減少糖尿病等代謝性疾病的患病率。
1付根學.妊娠糖尿病診治進展[J].河北醫藥,2011,33(10):1559.
2Schaefer-Graf UM,Meitzner K,Ortega-Senovilla H,et al.Differences in the implications of maternal lipids on fetal metabolism and growth between gestational diabetes mellitus and control pregnancies[J].Diabetes Med,2011,28(9):1053-1059.
3Ortega-Senovilla H,Schaefer-Graf U,Meitzner K,et al.Gestational diabetes mellitus causes changes in the concentrations of adipocyte fatty acid-binding protein and other adipocytokines in cord blood[J].Diabetes Care,2011,34(9):2061-2066.
4Luo ZC,Delvin E,Fraser WD,et al.Maternal glucose tolerance in pregnancy affects fetal insulin sensitivity[J].Diabetes Care,2010,33(9):2055-2061.
5Shields BM,Knight B,Turner M,et al.Paternal insulin resistance and its association with umbilical cord insulin concentrations[J].Diabetologia,2006,49(11):2668-2674.
6梁怡,龐燕,楊文建,等.妊娠期糖尿病患者C-反應蛋白、血尿酸和血脂水平的臨床研究[J].河北醫藥,2011,33(10):1471.
7Radelli T,Lepercq J,Varastehpour A,et al.Differential regulation of genes for fetoplacental lipid pathways in pregnancies with gestational and type 1 diabetes mellitus[J].Am J Obstet Gynecol,2009,201(2):209.
8Marseille-Tremblay C,Ethier-Chiasson M,Forest J,et al.Impact of maternal circulating TC esterol and gestational diabetes mellitus on lipid metabolism in human term placenta[J].Mol Reprod Dev,2008,75(6):1054-1062.
9Ortega-Senovilla H,Schaefer-Graf U,Meitzner K,et al.Gestational diabetes mellitus causes changes in the concentrations of adipocyte fatty acid-binding protein and other adipocytokines in cord blood[J].Diabetes Care,2011,34(9):2061-2066.
10 Miehle K,Stepan H,Fasshauer M.Leptin,adiponectin and other adipokines in gestational diabetes mellitus and pre-eclampsia[J].Clin Endocrinol,2012,76(1):2-11.
11Capurso C,Capurso A.From excess adiposity to insulin resistance:The role of free fatty acids[J].Vascul Pharmacol,2012,57(2-4):91-7.
12van Hees AM,Jans A,Hul GB,et al.Skeletal muscle fatty acid handling in insulin resistant men[J].Obesity,2011,19(7):1350-1359.

