11C-乙酸鹽自動化合成改進工藝及PET/CT顯像
甘滿權,唐小蘭,唐剛華,王紅亮,胡孔珍
(1.廣州醫學院第一附屬醫院 PET/CT中心,廣州 510230;2.華南農業大學 理學院,廣州 510642; 3.中山大學附屬第一醫院 核醫學科, 廣州 510515)
11C-乙酸鹽(11C-AC)是用于測定心腦氧化代謝、多種腫瘤 (如泌尿道腫瘤、頭頸部癌、肝細胞癌等)類脂代謝的正電子發射斷層(PET)顯像劑,具有較高的靈敏度,優于2-18F-2-脫氧-D-葡萄糖(18F-FDG)[1-3]。國外已報道了多種11C-乙酸鹽的自動化合成方法[4-12],國內也有文獻[13]報道,主要有Loop環固相反應法和液相反應法,前體主要為溴化甲基鎂和氯化甲基鎂,改進處主要集中在11C-AC純化方法。純化方法有:1) 液-液提取法[14]。該法麻煩耗時,得到的11C-AC放化產率較低,合成時間較長,不便于實現全自動化生產。2) HPLC純化法[15]。該法得到的11C-AC放化產率較高(校正產率約72%),放化純度也高(>99%),但11C半衰期短,HPLC純化耗時,合成時間較長,也不便于實現全自動化生產。(3)蒸餾法[5-6]。除去中間體11C-乙酰溴(或氯)化鎂加合物中溶劑四氫呋喃后,加入酸并加熱將11C-AC從溶液中蒸出。該法放化產率較低,合成時間較長,最終產品中可能含有機雜質11C-丙酮和11C-叔丁醇。(4) 固相小柱純化法[4, 7-13, 16]。該法放化純度、化學純度和放化產率均較高,是目前合成乙酸鹽最常用的方法。但是,該法可能生成AgCl或AgBr沉淀而造成管路堵塞和11C-AC合成失敗,且終產品中需要加酸除11CO2并用堿中和,給11C-AC自動化生產帶來不便。最近報道的液相反應結合中性氧化鋁小柱純化法[16],可彌補Loop環固相反應結合固相小柱純化法的不足,但中性氧化鋁小柱捕集11C-AC有限,也會損失部分11C-AC。本工作采用改進的Loop環合成11C-Ac,結合固相小柱水解純化法,在國產碳-11膽堿/蛋氨酸合成模塊中進行11C-AC的自動化合成,并建立簡單放射性HPLC測定11C-AC放化純度,為11C-AC自動化合成提供簡便、快速、實用的合成工藝。
1 實驗材料
碳-11膽堿/蛋氨酸自動化合成模塊:派特北京科技有限公司;LC-10AT HPLC分析系統:日本Shimadzu公司產品,配有LB 508 型放射性流量探測器,德國EG&G公司產品;質檢HPLC分析條件:Xdp-C18柱(4.5 mm×150 mm,5 μm),流動相為5%的乙腈溶液,流速為1 mL/min,紫外(UV)檢測波長為214 nm,美國 Agilent公司;CS-9301 PC 薄層層析掃描儀:日本Shimadzu公司產品;γ計數儀:上海原子核研究所產品;CRC-15R型活度計:美國CAPINTEC公司產品;Sep-Pak C18小柱:美國Waters公司產品;掏空Sep-Pak Plus C18小柱和Sep-Pak Al2O3中性小柱:經消毒酒精和無菌水處理后,裝載AG50w-X8樹脂(H+型,Bio-Rad公司產品)或AG11A8離子滯留樹脂,Bio-Rad公司產品,分別制作Sep-Pak Tscx小柱(600 mg)和Sep-Pak Tix小柱(1 200 mg);硅膠60薄層層析鋁板:德國Merck公司產品;1.0 mol/L溴化甲基鎂:Across Organics公司產品;NaOH、冰乙酸:分析純,廣州化學試劑公司;其他試劑為國產分析純。
2 實驗方法
2.1 合成方法
11C-AC合成路線示于圖1。采用柱水解法自動化合成11C-AC。以溴化甲基鎂為前體,在Loop環中與11CO2反應生成中間體11C-乙酰溴化鎂加合物。該步不經純化過程,通N2除凈四氫呋喃(THF)后,加水依次通過一體化小柱(Sep-Pak Plus C18小柱、Sep-Pak Tscx小柱和Sep-Pak Tix小柱),中間體11C-乙酰溴(或氯)化鎂在Sep-Pak Tscx小柱中發生進一步水解,并經一體化小柱分離純化后,得11C-AC 注射液。
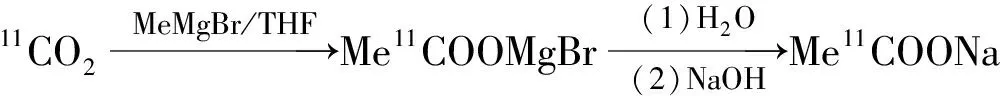
圖111C-AC合成路線
圖1Syntheticrouteof11C-AC
2.2 實驗流程
采用碳-11膽堿/蛋氨酸模塊合成11C-AC,其合成流程示于圖2。在合成前,取濃度為0.87~1.5 mol/L的溴化甲基鎂無水四氫呋喃溶液0.1 mL裝于Loop環2中,Loop環2置于活度計內。由PETtrace回旋加速器通過14N(p, α)11C核反應生產11CO2,11CO2在液氮冷卻下被捕集在置于冷阱的Loop環1中。在室溫下,以10 mL/min N2作載氣將11CO2載帶至Loop環2中,并與環中的溴化甲基鎂反應生成中間體乙酰溴化鎂加合物,溶劑四氫呋喃在氮氣載帶下被傳至廢液瓶中。1號瓶中5 mL水在N2作用下(30 mL/min)經Loop環2將乙酰溴化鎂載至一體化小柱,在柱上進一步發生水解反應。收集產品在無菌真空小瓶4中,繼續通入30 mL/min N2流除去酸性條件下釋放的11CO2。經堿溶液中和后過無菌濾膜得11C-AC注射液。
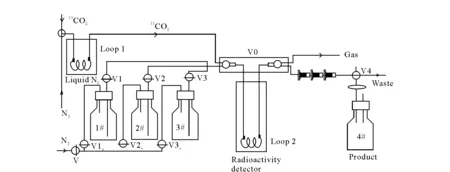
圖2 碳-11膽堿/蛋氨酸模塊合成11C-AC示意圖Fig.2 Schematic diagram of 11C-AC synthesis using 11C-choline/methionine synthesizer
2.3 產品質量檢驗
用精密pH試紙測定注射液的pH,目測其顏色和澄清度。取即時制備的11C-AC注射液,用活度計測定不同時間點的活度,用半對數作圖法估測半衰期和核純度。用放射性HPLC系統及TLC法[5]測定11C-AC注射液的化學純度和放化純度。TLC硅膠鋁板,樣品加入1 mol/L NaOH后點樣,展開劑為甲醇[11]。
按中華人民共和國藥典2010年版所述方法對11C-AC注射液進行異常毒性檢查、無菌檢查及細菌內毒素檢查。異常毒性檢查:4組小鼠,每組10只,每只尾靜脈給予0.5 mL衰變后的11C-AC注射液,觀察48 h后小鼠生長情況。
2.4 正常和模型動物PET/CT顯像
腹腔注射10%的水合氯醛麻醉SPF級實驗兔(約3 kg),經耳緣靜脈注射0.6 mL的11C-AC (18.5 MBq),固定于掃描床上。于注射20 min后行PET/CT全身顯像,經衰減校正和迭代重建后,獲得橫斷面、矢狀面、冠狀面斷層圖像及最大密度投影(maximum intensity projection,MIP)圖像。
將S180纖維肉瘤細胞株復蘇后,培養3~4代,制成癌細胞懸浮液,調整濃度為1×107個/mL,取0.1 mL注射到小鼠右肩皮下。接種后第10天,小鼠右背部可見明顯的腫塊,瘤直徑大于1 cm入選為腫瘤模型。所有動物飼養于中山大學實驗動物中心實驗室動物房,恒溫恒濕條件,定時給食。S180型纖維肉瘤模型小鼠經水合氯醛麻醉后,由尾靜脈注射生理鹽水稀釋的11C-AC 約1.85~3.7 MBq (0.2 mL),20 min后固定于小鼠架上,行全身PET/CT掃描。經衰減校正和迭代重建后,獲得橫斷面、矢狀面、冠狀面斷層圖像及MIP圖像。
3 結果與討論
3.1 11C-AC自動化合成
采用碳-11膽堿/蛋氨酸模塊,以1 mol/L溴化甲基鎂作前體,可自動化合成11C-AC,總過程耗時約8 min,總校正放化產率為(40.5±4.6)%(n=6)。廢液中放射性約占24%,一體化小柱中放射性約占8%,還有約27%為未反應的11CO2(通氮氣除去)和反應過程損失的放射性。用PETtrace加速器和質子束流25 μA轟擊5 min,得 7.9 GBq的11CO2,可生產2.6 GBq的11C-AC注射液。
采用0.2 mL 0.9 mol/L溴化甲基鎂替代0.1 mL 1.5mol/L溴化甲基鎂,廢液中放射性下降,粗產品中11CO2含量上升,標記率略降低。采用1 mol/L和1.5 mol/L溴化甲基鎂作前體,可獲得相同的放化產率。
本工作采用一體化小柱完成水解和純化工作,與現有文獻報道的小柱純化法[4, 7-13,16]相比,本法很容易實現11C-AC的自動化合成,總合成時間較短。中間體11C-乙酰溴化鎂加合物可在Sep-Pak Tscx強陽離子小柱中完成水解,從而可得較純11C-AC注射液。
3.2 11C-AC質量檢驗
11C-AC注射液為無色或淺黃色溶液,pH約為7.0,比活度≥4.6×1011Bq/g。用時間衰變法測定11C半衰期約為20 min,放射性核純度大于99%。
采用HPLC法測量11C-AC注射液的放化純度,主峰(圖3A)與標準品乙酸的紫外吸收峰(圖3B)保留時間一致,11C-AC放化純度大于95%。用放射性TLC法測定,11CO2在原點,11C-AC的Rf=0.8,11C-AC放化純度大于98%。
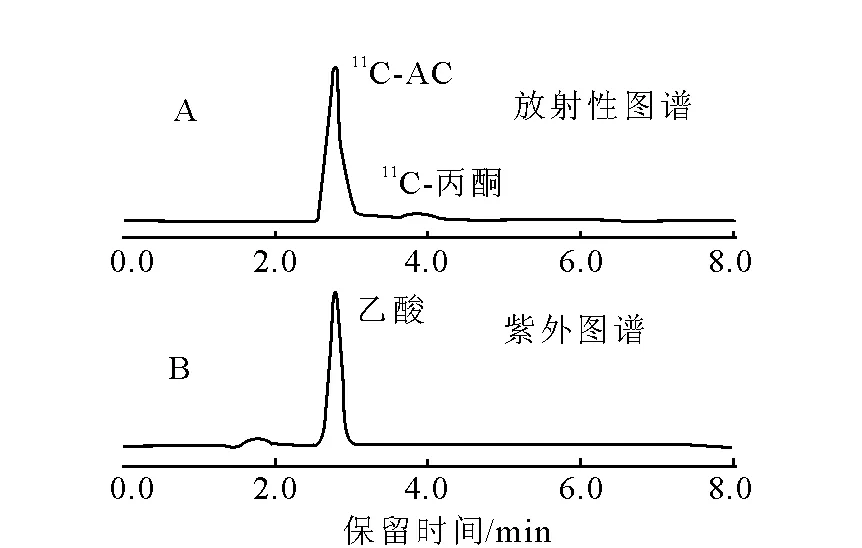
圖3 HPLC測定純化后11C-AC圖譜Fig.3 HPLC chromatogram of purified 11C-AC. Figure A is radioactivity chromatogram and Figure B is UV chromatogram
此外,經放射性HPLC法測定,11C-AC 注射液在2 h內放化純度沒有明顯變化,均大于95%。異常毒性檢查:尾靜脈給予11C-AC注射液0.5 mL后,觀察48 h后,發現小鼠生長正常,無死亡及不良反應現象發生,解剖后觀察,未見任何器官損傷。無菌檢查和細菌內毒素檢查均為陰性。
3.3 動物PET/CT顯像
給予11C-AC后20 min,對正常實驗兔進行全身PET/CT顯像,顯像結果示于圖4。由圖4可知,肺和肝臟有較高放射性分布,其他組織放射性攝取較低。
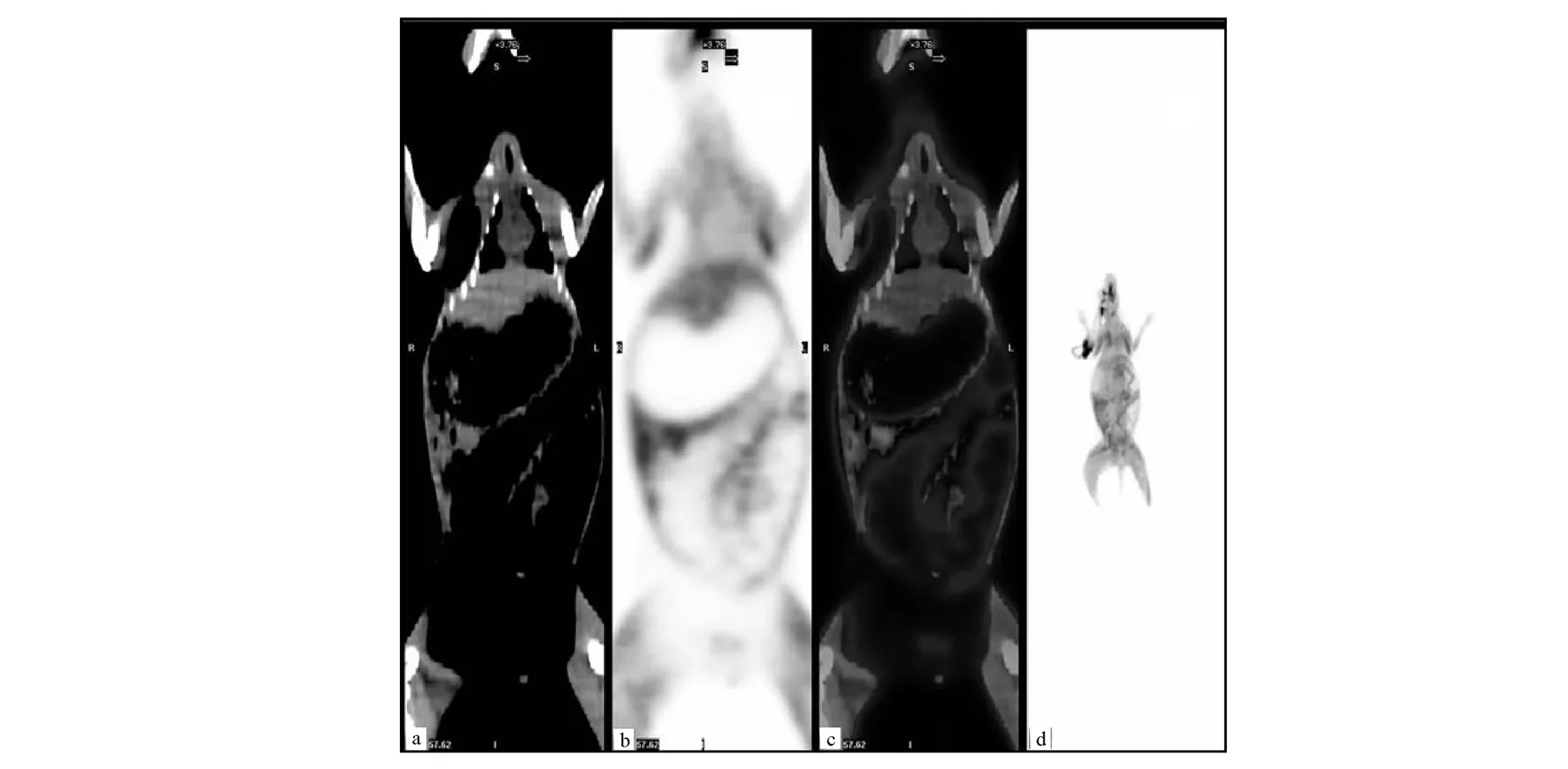
a—冠狀CT斷層圖;b—冠狀PET斷層圖;c—冠狀PET/CT融合圖;d—冠狀MIP圖。圖4 正常兔全身11C-AC PET/CT顯像圖像a—coronal CT image;b—coronal PET image;c—coronal PET/CT fused image;d—coronal MIP imageFig.4 Whole-body 11C-AC PET/CT images of normal rabbit
另給予11C-AC后20 min,對荷S180纖維肉瘤小鼠行全身PET/CT顯像,獲得顯像圖示于圖5。放射性主要分布于上腹部;給藥后20 min,腫瘤組織有較低放射性攝取(腫瘤與健側肌肉放射性攝取比約為1.5),其原因可能是S180纖維肉瘤對11C-乙酸鹽的攝取不夠敏感。給藥后30 min,腫瘤組織放射性攝取略有增加(腫瘤與健側肌肉放射性攝取比約為2.2)。

a—CT斷層圖;b—PET/CT橫斷層融合圖;c—冠狀PET/CT融合圖;d—冠狀MIP圖。圖5 荷S180纖維肉瘤小鼠全身PET/CT顯像圖像。a—Transverse CT images; b—Transverse PET/CT fused images;c—coronal PET/CT fused images; d— coronal MIP images.Fig.5 Whole body PET/CT images of S180 fibrosarcoma-bearing mice
4 小結
本工作建立了簡單、快速自動化合成11C-乙酸鹽(11C-AC)的工藝流程,總合成時間約8 min,校正放化產率為(40.5±4.6)%,放化純度大于95%,經質量控制檢驗后符合放射性藥物質量要求,并經正常動物和模型動物PET/CT顯像驗證。實驗結果表明,自動化生產的11C-AC是安全、有效的,有望進一步用于人體PET/CT研究。
參考文獻:
[1]Ho CL, Yu SC, Yeung DWC.11C-Acetate PET Imaging in Hepatocellular Carcinoma and Other Liver Masses [J]. J Nucl Med, 2003, 44:213-221.
[2]Sun A, Sorensen J, Karlsson M, et al. 1-[11C]-acetate PET imaging in head and neck cancer—a comparison with18F-FDG-PET: implications for staging and radiotherapy planning [J]. Eur J Nucl Med Mol Imaging, 2007, 34: 651-657.
[3]唐剛華, 伍光遠. 正電子發射斷層顯像在泌尿系統腫瘤中的應用[J]. 同位素, 2007, 20(2): 114-119.
Tang ganghua, Wu guangyuan. Clinical Application of Positron Emission Tomography Imaging in Urologic Tumors[J]. Journal of Isotopes, 2007, 20(2): 114-119(in Chinese).
[4]Moerlein SM, Gaehle GG, Welch MJ. Robotic preparation of Sodium Acetate C 11 Injection for use in clinical PET [J]. Nucl Med Biol, 2002, 29: 613-621.
[5]Mitterhauser M, Wadsak W, Krcal A, et al. New aspects on the preparation of [11C]acetate—a simple and fast approach via distillation [J]. Appl Radiat Isot, 2004, 61: 1 147-1 150.
[6]Cheung M, Ho CL. A simple, versatile, low-cost and remotely operated apparatus for [11C]acetate, [11C]choline, [11C]methionine and [11C]PIB synthesis [J]. Appl Radiat Isot, 2009, 67: 581-589.
[7]Roeda D, Dolle F, Crouzel C. An improvement of [11C]acetate synthesis—non-radioactive contaminants by irradiation-induced species emanating from the [11C]carbon dioxide production target [J]. Appl Radiat Isot, 2002, 57: 857-860.
[8]Kruijer PS, Linden TT, Mooij R, et al. A practical method for the preparation of [11C]acetate [J]. Appl Radiat Isot, 1995, 46: 317-321.
[9]Lodia F, Trespidia S, Pierro DD, et al. A simple Tracerlab module modification for automated on-column [11C]methylation and [11C]carboxylation [J]. Appl Radiat Isot, 2007, 65: 691-695.
[10]Felicinia C, Nagrenc K, Bertonb A, et al. Development of an automated modular system for the synthesis of [11C]acetate [J]. Nucl Med Commun, 2010, 31:1 033-1 039.
[11]Le Bars D, Malleval M, Bonnefoi F, et al. Simple synthesis of [1-11C]acetate [J]. J Label Compd Radiopharm, 2006, 49: 263-267.
[12]Soloviev D, Tamburella C. Captive solvent [11C]acetate synthesis in GMP conditions [J]. Appl Radiat Isot, 2006, 64: 995-1 000.
[13]張錦明, 田嘉禾, 陳燕等.11C-膽堿模塊合成11C-乙酸鹽的研究[J]. 中華核醫學雜志, 2008, 28(5): 319-322.
Zhang Jinming, Tian Jiahe, Chen yan, et al. A study of11C-acetate production using11C-choline commercial module[J]. Chinese Journal of Nuclear Medicine, 2008, 28(5): 319-322(in Chinese).
[14]Berridge MS, Cassidy EH, Miraldi F. [11C]acetate and [11C]methionine: Improved syntheses and quality control [J]. Appl Radiat Isot, 1995, 46(3): 173-175.
[15]Pike VW, Horlock PL, Brown C, et al. The remotely-controlled preparation of a11C-labelled radiopharmaceutical—[11C]acetate [J]. Int J Appl Radiart Isot, 1984, 35(7): 623-627.
[16]Mock BH, Brown-Proctor C, Green MA, et al. An automated SPE-based high-yield synthesis of [11C]acetate and [11C]palmitate: no liquid-liquid extraction, solvent evaporation or distillation required [J]. Nucl Med Biol, 2011, 38: 1 135-1 142.

