二組分氣一液平衡相圖體系的選擇
摘 要: 考慮學生知識水平現狀和倡導綠色化學實驗教學,用正丙醇代替環己烷,采用正丙醇—乙醇體系做二組分氣—液平衡相圖測繪實驗,經多次實操和歷屆學生實訓驗證,均得到了較好的二組分氣一液平衡相圖,是比較理想的選擇。
關鍵詞: 正丙醇 乙醇 氣液平衡 相圖 選擇
1.引言
高職院校化工類各專業在物理化學實驗教學中,二組分體系氣—液平衡相圖的測繪是一個重要的實訓項目,學生經過本項目的實訓,能進一步理解相律公式及相圖中點、線、面的意義,為后續學習精餾打下好的基礎;另外這也是學生掌握阿貝折光儀基本操作的重要實訓機會。在我院采用的高職高專“十一五”規劃教材《物理化學》中,二組分體系氣—液平衡相圖的測繪采用的是環己烷—乙醇體系,在實訓過程中我們發現,這個體系有一些不足的地方:環己烷屬中等毒性類溶劑,但揮發性高,在實訓過程中環己烷的刺激性氣味比較大,且它的脂溶性高,在人體內可蓄積,特別是對神經系統有毒性,實為高毒性物質。近年來因普通高等院校的擴招等原因,高職院校生源整體素質下降。環己烷—乙醇體系的相圖比較復雜,學生對實驗基本原理的理解和實訓操作的把握有一定難度,描繪相圖有一定困難,很難達到實訓目地。考慮上述情況,我們在二組分體系選擇上查閱了相關資料,做了一些調整:用正丙醇替代環己烷,采用正丙醇—乙醇體系。
2.實驗部分
2.1儀器與試劑
阿貝折光儀1臺,沸點儀1套,超級恒溫槽1臺,穩流電源1臺,精密溫度計1支(50℃~100℃,精確到0.01℃),25mL移液管1支,長滴管2支,無水乙醇、正丙醇。
2.2實驗目的
2.2.1掌握用沸點儀測沸點的方法;
2.2.2繪制常壓下正丙醇—乙醇雙液系的沸點—組成圖;
2.2.3掌握阿貝折光儀的使用方法;
2.2.4理解相圖中點、線、面的意義,了解精餾原理。
2.3實驗原理
兩種液態物質混合而成的二組分體系稱為雙液系。兩個組分若能按任意比互溶,則稱為完全互溶雙液系。液體的沸點是指液體的蒸氣壓與外壓相等時的溫度。在一定的外壓下,純液體的沸點有其確定值。但雙液系的沸點不僅與外壓有關,而且與雙液系的組成有關。
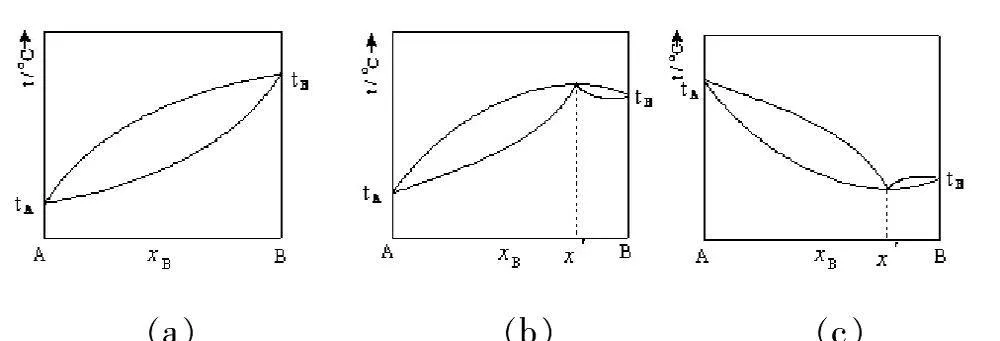
完全互溶的雙液系的沸點—組成圖可分為三類:
(1)混合物沸點介于兩純組分沸點之間(如圖(a))
(2)混合物存在最高恒沸點(如圖(b))
(3)混合物存在最低恒沸點(如圖(c))
(a) (b) (c)
環己烷—乙醇相圖屬于第一種類型,相圖較復雜;而正丙醇—乙醇體系相圖屬于第一種類型,相圖相對簡單。
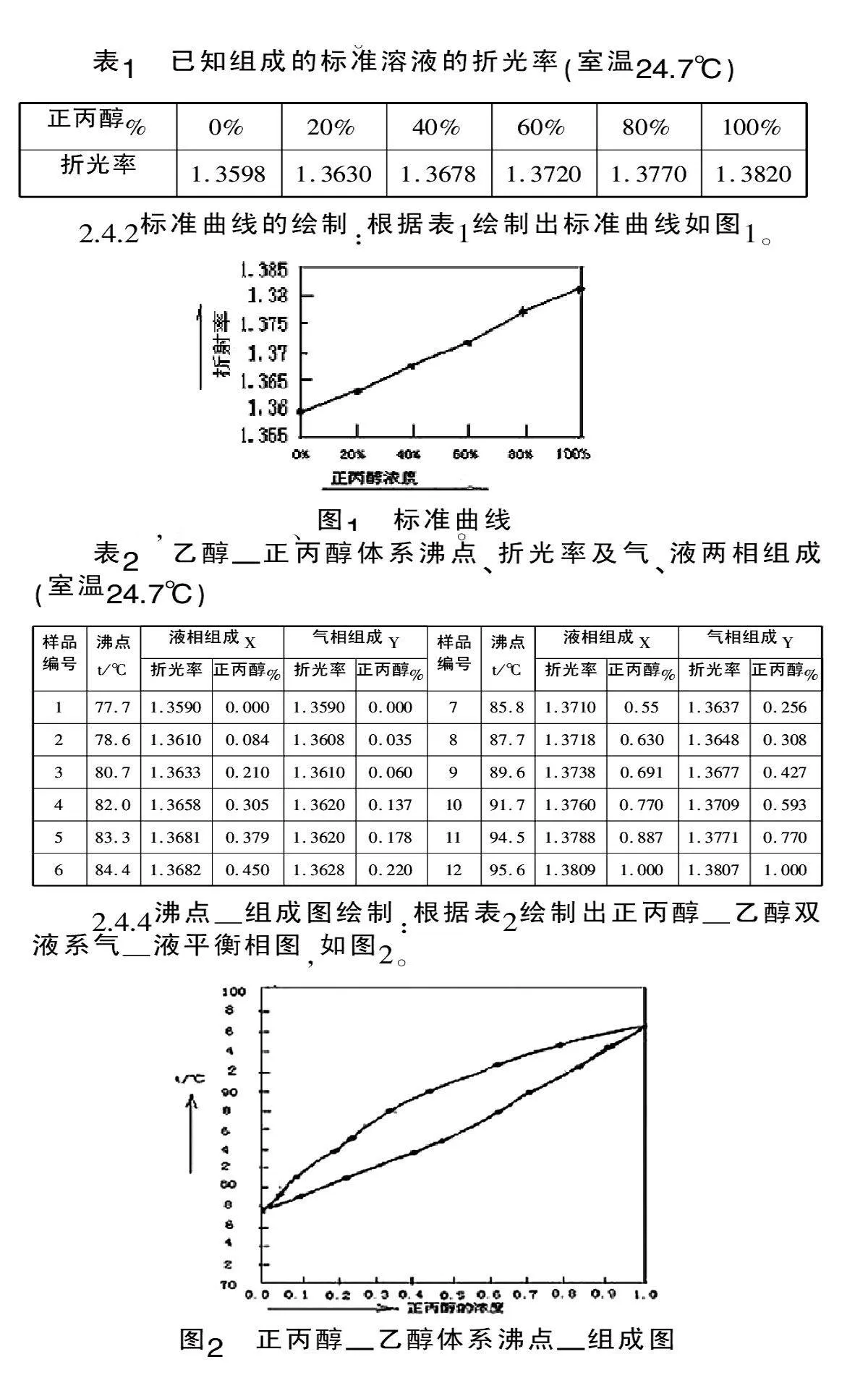
預先測定一系列已知組成的標準溶液的折光率,繪制在一定溫度下該標準溶液的折光率—組成曲線,作為標準曲線;然后采用回流冷凝法,以沸點儀餾出液的組成作為平衡時氣相組成Y,以沸點儀中溶液的組成作為平衡時液相組成X,然后根據測定的氣相和液相的折光率在標準曲線上找到相對應的平衡時氣液兩相的組成,繪制待測體系的沸點——組成圖。
2.4實訓結果及數據處理
2.4.1標準溶液折光率的測定:在一定溫度下,純物質具有一定的折光率,當兩種物質互溶形成溶液后,溶液的折射率與其組成有一定的對應關系。
2.4.2標準曲線的繪制:根據表1繪制出標準曲線如圖1。
2.4.3待測溶液的沸點及氣—液兩相的折光率。
利用阿貝折光儀測定待測溶液氣、液兩相的折光率,查詢標準曲線,確定其氣、液兩相組成。
2.4.4沸點—組成圖繪制:根據表2繪制出正丙醇—乙醇雙液系氣—液平衡相圖,如圖2。
3.結語
3.1正丙醇—乙醇相比環己烷—乙醇體系相圖,在要求和難度上有所降低,符合學生目前知識水平現狀,也改善了實驗室環境,減少了有毒物質對人體的危害。
3.2通過多次實操和歷屆學生實訓驗證,用正丙醇—乙醇體系來做二組分氣一液平衡相圖實驗是比較理想的選擇,學生一般都能得到理想的雙液系溫度——組成圖,較好完成本項目的實訓任務。
3.3為保證標準曲線的準確性和節省實驗時間,標準溶液可由實驗老師預先配制好。
3.4考慮學生實操水平,我們在前面的物化實訓項目中,開設了常用儀器操作技能訓練,有針對性地用阿貝折光儀進行了無水乙醇、正丙醇等樣品的折光率測定訓練,學生在本次實訓中,能熟練進行測試,為相圖的測繪打下了好的基礎。
參考文獻:
[1]湯瑞湖,李莉主編.物理化學.北京:化學工業出版社,2008.
[2]侯德順,鐘紅梅.二元液系汽—液平衡相圖測繪實驗的探討[J].高校實驗室工作研究,2009(總第102期).
[3]張祝蓮,侯向陽.雙液系氣一液平衡相圖體系的選擇[J].延安大學學報(自然科學版),1998,VOL17(3).
[4]李俊新,孫寶,等.二元液系氣—液平衡相圖實驗體系的綠色選擇[J].實驗室科學,2011,VOL14(3).

