奶水牛乳腺組織學研究報告
朱 柳,譚麗勤,余長林,王紹卿,劉學洪
在我國,水牛的用途多為役用。近年來,水牛的乳用性能開發利用越來越得到關注,采用乳役兼用河流型水牛與我國沼澤型水牛雜交,改進其產奶性能,取得良好的效果。然而,與普通牛相比,水牛的泌乳性仍有很多特殊性,如放乳慢、產量不高等。泌乳量與乳腺內部結構有關,水牛與普通奶牛泌乳的差異特性是否因為水牛乳房內部結構與普通奶牛不同是值得探索的。
1 材料與方法
1.1 材料
乳腺組織采自云南省大理州家畜繁育指導站奶水牛場的摩拉水牛和摩×尼×本三元雜水牛泌乳正常,無疾病的水牛。
1.2 試劑及工具
4%甲醛溶液、Harris蘇木精染色液、鹽酸酒精分色液、0.5%伊紅染液、50%酒精、75%酒精、85%酒精、95%酒精Ⅰ、95%酒精Ⅱ、100%酒精Ⅰ、100%酒精Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ、石蠟Ⅰ、石蠟Ⅱ、蛋白甘油,中性樹脂。手術刀、手術剪、毛筆、細針、小鑷子、載玻片、蓋玻片、小木塊,小瓶子、濾紙、恒溫箱、水浴箱、石蠟切片機、熒光顯微鏡。
1.3 方法
1.3.1 取材和固定 屠宰,割下乳房并將其固定在解剖臺上,用手術剪剪開皮膚,用手術刀在乳房的左上、左外、左后、左前靠中、右外、右前靠中、右后、右上乳頭周圍處切取大小1.0cm×2.0cm×4.0cm組織塊,投入到4%的甲醛溶液中固定24h以上。
1.3.2 組織塊處理 將固定好的組織從甲醛溶液中取出,用鋒利的手術刀修成大小為1cm×1cm×0.2cm組織塊。將修整好的組織塊放到洗瓶內,每隔15min用清水沖洗一次,洗1h左右。
1.3.3 脫水和包埋 將組織塊依次放到50%(3 h),75%乙醇(3h),85%乙醇(3h),95%乙醇Ⅰ(過夜),95%乙醇Ⅱ(3h),100%乙醇Ⅰ(1.5h),100%乙醇Ⅱ(1.5h)進行脫水。將脫水后的組織放入二甲苯中半小時左右使組織透明。提前一天將石蠟Ⅰ和石蠟Ⅱ放到58~60℃的恒溫箱中融化,將處理好的組織放到石蠟Ⅰ中浸1h,之后再放到石蠟Ⅱ中浸1h。將熔好的石蠟Ⅱ倒入包埋盒內,用鑷子夾取組織塊放到石蠟中,置好方向,放到室溫下冷卻。
1.3.4 制片 切去組織周圍過多的石蠟,在組織周圍留有1~2mm的蠟邊,對邊須平行,這樣切出的切片比較均勻。將修好的蠟塊固定在小方木塊上,用夾子固定在切片機上,調整角度及厚度進行連續切片,將切好的薄片放到裝有40℃水的水浴箱中進行展片,用涂有蛋白甘油的載玻片取出,并隨手將玻片上的水甩干,有利于切片與載玻片之間的結合。將展好的切片放到40℃恒溫箱中烤1h,之后用H.E染色法進行染色,中性樹脂封片,最后蓋上蓋玻片放到顯微鏡下觀察照相。
2 結果與分析
泌乳期水牛乳腺結締組織和脂肪組織較少,腺泡較多,且為不規則的卵圓形,大小不一,內充滿乳汁(圖1),經過H.E染色后,結締組織、上皮細胞的細胞質和腺泡內的乳汁被染成紅色,上皮細胞的細胞核被染成紫藍色。顯微鏡觀察初步統計該水牛在乳腺小葉區域的乳腺泡數量范圍為80~150個/mm2,直徑范圍為50~100μm。經過顯微圖片初步統計泌乳水牛乳腺組織占62.8%,結締組織占7.6%,脂肪組織占19.6%。
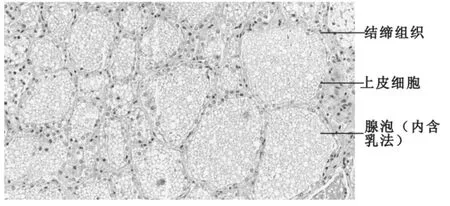
圖1 摩拉水牛泌乳期乳腺組織切片(H.E×100倍)

圖2 摩×尼×本三元雜水牛泌乳后期乳腺組織切片(H.E×40倍)
圖2、3、4為不同放大倍數下的摩尼本三元雜泌乳后期水牛乳腺組織切片,泌乳后期水牛泌乳量減少,乳腺間質開始增加,在顯微鏡觀察下乳腺內的結締組織和脂肪組織相對較多,導管較發達,從圖2中可以清楚的看到與乳腺泡相連的乳腺小葉內導管,小葉間導管和導管與腺泡間的結締組織,腺泡數量相對較少,腺泡較小,乳汁被擠出,內為空腔。在顯微鏡下統計該水牛在乳腺小葉區域的腺泡數量范圍為50~100個/mm2,直徑范圍為50~150μm。摩×尼×本三元雜泌乳后期的腺泡數量與摩拉水牛泌乳期的相比較少,但最大腺泡直徑相比要大一些。

圖3 摩×尼×本三元雜水牛泌乳后期乳腺組織切片(H.E×100倍)

圖4 摩×尼×本三元雜水牛泌乳后期乳腺組織切片 (H.E×200倍)
3 討論
乳腺泌乳能力是由分泌乳汁的細胞數量和活力大小來決定的。在泌乳期激素的刺激下,乳腺上皮細胞增加,表現為乳腺泡的增大。在反芻動物中,乳腺在進入泌乳期時開始生長,Tucker(1987)對動物妊娠后期和泌乳第一天乳房中的DNA總量估計,山羊和奶牛的乳腺細胞數量呈顯著上升趨勢[1],在泌乳期的第一周DNA水平持續增加[2]。Knight(1987)在體外測量到有乳糖和蛋白的合成證明,在泌乳期開始時乳腺上皮細胞的活性開始升高3]。Franke(1979)研究發現,泌乳期乳腺上皮細胞發生有絲分裂現象[4]。而在泌乳期即將結束時,乳腺上皮細胞的活性開始下降,并逐漸衰亡,細胞數量逐漸減少,乳腺泡也逐漸變少。有研究發現在小鼠的乳房退化期乳腺細胞發生程序化死亡[5,6]。在奶牛泌乳期結束后,乳腺泡上皮細胞開始膨脹,細胞內脂質逐漸積累,細胞脫落進入腺泡腔內或被細胞膜降解,凋亡的細胞在衰退的奶牛乳腺組織中占4.8%,比在泌乳期占有 的比例 (2.4%)要高[7]。Capuco(1997)等研究表明,荷斯坦奶牛乳腺上皮細胞在泌乳期第90d時占乳腺組織的79%,240d以后只占73%[8]。
本試驗結果顯示摩拉水牛在泌乳中后期乳腺小葉區域的腺泡數量范圍為80~150個/mm2,直徑范圍為0.05~0.1mm,與Parekh(2002)[9]報道的水牛在泌乳期的乳腺泡數量范圍72.73~123.38個/mm2和 A.K.Patel(2007)[10]報道的摩拉水牛泌乳期乳腺泡數量平均分別為130.0±2.98個/mm2以及腺泡直徑平均大小在泌乳期腺泡直徑42.89~71.47μm基本相符。這在一定程度上說明,摩拉水牛的乳腺上皮細胞的數量和大小是遺傳力較大的性狀,受環境的影響小,可以穩定遺傳并表達,奶水牛的這一特點為我們的選種帶來了便利。
摩×尼×本三元雜在泌乳后期乳腺小葉區域的腺泡數量范圍為50~100個/mm2,直徑范圍為0.05~0.15mm,與摩拉水牛相比,腺泡直徑范圍很接近,而腺泡數量明顯較少,這可能就是摩×尼×本三元雜泌乳量較摩拉水牛低的原因之一。本研究沒有取沼澤型水牛做對照,原因是沼澤型水牛并不擠奶,希望以后對沼澤型水牛哺乳期的乳腺組織進行研究,提供更多的證據。
試驗結果表明,泌乳量均與腺泡數量和大小有關,這與Linzell(1966)研究報道乳腺大小與產奶量之間存在著正相關[11]結果一致。Nagai(1978)等在小鼠中發現乳腺細胞的數量與乳腺大小相比,數量與泌乳量的相關性更高[12]。Capuco(2001)等在研究奶牛泌乳中發現在泌乳期第90~240d內產奶量下降了23%,與乳腺上皮細胞的總DNA下降了17%[13]的研究結果具有一致性。值得注意的是,本研究中摩拉水牛的腺泡直徑上限比雜交牛的小,這也許是測定誤差所致,有待進一步研究。
據報道荷斯坦奶牛在泌乳期乳腺泡直徑范圍為50~250μm,比水牛的腺泡直徑范圍中的最大值要大,由此推測荷斯坦奶牛的分泌細胞分泌乳汁的能力比水牛的要大,但單位面積的腺泡數量未見報道。試驗中測定的水牛乳腺組織中,在泌乳中后期,腺泡部分占整個乳房的62.8%,而荷斯坦奶牛的占75%~80%[14]左右,荷斯坦奶牛的泌乳期乳腺泡直徑最大值和其乳腺組織含量均明顯大于奶水牛,通過觀察乳腺組織切片得到的這一差距不僅從生理結構上解釋了荷斯坦牛優越的泌乳性能,更為我們的今后選種提供指導依據。
4 結論
奶水牛的乳腺腺泡數量少于荷斯坦牛,腺泡直徑小于荷斯坦牛;雜種水牛腺泡數比摩拉水牛的少,暗示腺泡數及大小是影響水牛泌乳量的重要內在因素。
[1]Tucker H A.Quantitative estimates of mammary growth during various physiological states:a review[J].J Dairy Sci.,1987,70:1958-1966.
[2]Anderson R R,Harness J R,Snead A F,etal.Mammary growth pattern in goats during pregnancy and lactation[J].J Dairy Sci.,1981,64:427-432.
[3]Knight C H,Wilde C J.Mammary growth during lactation:implications for increasing milk yield[J].J Dairy Sci.,1987,70:1991-2000.
[4]Franke W W,Keenan T W.Mitosis in milk secreting epithelial cells of mammary gland:an ultrastructural study[J].Differentiation,1979,13:81-88.
[5]Quarrie L H,Addey C V,Wilde C J.Programmed cell death during mammary tissue involution induced by weaning,litter removal,and milk stasis[J].J Cell Physiol.,1996,168:559-569.
[6]Strange R,Li F,Saurer S,etal.Apoptotic cell death and tissue remodeling during mouse mammary gland involution[J].Development,1992,115:49-58.
[7]Wilde C J,Addey C V,Li P,etal.Programmed cell death in bovine mammary tissue during lactation and involution[J].Experimental Physiology,1997,82:943-953.
[8]Capuco A V,Akers R M,Smith J J.Mammary growth in Holstein cows during the dry period:quantification of nucleic acids and histology[J].J Dairy Sci.,1997,80:477-487.
[9]Parekh B H.Gross and microscopic studies on the udder of lactating and non lactating,non pregnant adult buffaloes(Bubalus bubalis)[J].M.V.Sc.Thesis submitted to Gujarat Agriculture University,Anand,2002.
[10]Pate A K,Koringa P G,Nandasana K N,etal.Comparative histology of mammary gland in heifer,pregnant,lactating and dry buffaloes[J].Indian Journal of Veterinary Anatomy,2007,19(1):71-78.
[11]Linzell J L.Measurement of udder volume in live goats as an index of mammary growth and function[J].J Dairy Sci.,1966,49:307-311.
[12]Nagai J,Sarkar N K.Relationship between milk yield and mammary gland development in mice[J].J Dairy Sci.,1978,61:733-739.
[13]Capuco A V,Wood D L,Baldwin R,etal.Mammary cell num-ber,proliferation,and apoptosis during a bovine lactation:relation to milk production and effect of bST.J Dairy Sci.,2001,84:2177-2187.
[14]莫 放.養牛生產學[M].北京:中國農業出版社,2010.

