3種疾病腎陽虛證“同證異治”的信號通路調控研究*
嚴石林,沈宏春,2,王浩中,魯法庭,于宏波,陳 為,陶 怡
(1.成都中醫藥大學,四川成都 610075;2.瀘州醫學院,四川瀘州 646000;3.云南中醫學院,云南昆明 650500)
1 資料與方法
1.1 資料來源
病例資料來源于成都中醫藥大學附屬醫院、瀘州醫學院附屬中醫院。從2009年3月至2010年7月期間符合診斷標準及納入標準者,共收集慢性腎炎、糖尿病腎病、陽痿病3個病種典型腎陽虛證患者9例,分別抽取血樣標本。
1.2 實驗方法
抽取實驗者空腹靜脈血10mL,裂解紅細胞,分離獲得白細胞,Trizol法提取總RNA。將總RNA進行IVT體外擴增,采用cy-3標記擴增后的cDNA,單標法與agilent4*44k人類全表達譜芯片進行雜交,洗脫、干燥、數據提取、歸一化處理。
1.2.1 分組
共分為4組,分別為慢性腎炎、糖尿病腎病、陽痿病3個實驗組共9例,健康對照組共3例。
2 數據統計分析方法
使用SAM軟件進行統計分析。
3 實驗結果
3.1 差異表達基因篩選
數據全部錄入SAS系統,數據采用DiffGene方法,分別將慢性腎炎腎陽虛組與正常組比較得到1435條差異表達基因,將糖尿病腎病腎陽虛組與正常組比較得到2306條差異表達基因,將陽痿腎陽虛組與正常組比較得到2060條差異表達基因。為了找到3種不同疾病腎陽虛組在腎陽虛證方面的共同生物學特征,我們把3組數據錄入EXCEL工作表,采用高級篩選功能進行兩兩篩選,最后找出332條共同差異表達基因,其中有注釋的基因為181條。
采用Pathway分析,發現3組間差異表達顯著的信號通路有37條。分別是腎細胞癌,氨酰-tRNA生物合成,Notch信號通路,纈氨酸、亮氨酸、異亮氨酸的生物合成,在癌細胞中協調促進啟動轉錄的核染質重塑的復合物與共激動劑的活性,Pitx2基因轉錄的多步校正,MEF2D在T細胞凋亡的作用,胰島素信號通路,神經營養蛋白信號通路,丙酮酸代謝,賴氨酸降解,阻止肉毒菌毒素引起的神經遞質釋放,非小細胞肺癌,前列腺癌,ps1簇淀粉樣的b-縮氨酸,mTOR(哺乳動物雷帕霉素靶蛋白)信號通路,半胱氨酸和蛋氨酸代謝,丙酸代謝,腫瘤通路,基本轉錄因子,代謝途徑,心血管系統中低氧可誘導因子,TGF-β信號通路,Wnt信號通路,g-分泌素介導的ErbB4信號通路,阿爾茨海默病,PPAR信號通路,黑色素細胞及色素沉著通路,Pelp1雌激素受體活性調節,精子生成的肌酸酐調控,新型冠狀病毒的生命周期,磷脂酰肌醇信號系統,DREAM轉錄調控鎮痛,PPAR-gamma復合激動劑在肥胖和產熱過程中的作用,SODD/TNFR1信號通路,CARM1甲基轉移酶基因轉錄調控,甘油磷酸酯代謝。
3.2 每組樣本特有的差異表達基因結果
通過篩選功能,我們還得到每組樣本所特有的差異表達基因。從這些差異表達基因中,找尋出同為腎陽虛證這一生物學意義下的不同點。數據處理示意圖見圖1。

圖1 數據篩選示意圖
3組病例都包含腎陽虛證,經統計處理后找出了腎陽虛證的共同差異表達基因。但是,3組樣本來至不同疾病,所以存在不同的生物學意義。通過對各病所特有的基因進行分析后,除發現大部分基因與本身的疾病有關外,卻又驚奇發現有一小部分基因參與了共同差異表達基因里面的3條信號通路,具體結果如下:
3.2.1 mTOR(哺乳動物雷帕霉素靶蛋白)信號通路
是一種非典型絲氨酸/蘇氨酸蛋白激酶,可整合細胞外信號,磷酸化下游靶蛋白核糖體p70S6激酶,如S6K1及4E-BP1,影響基因轉錄與蛋白質翻譯,從而參與調控細胞生長、增殖等過程。該通路與糖尿病腎病的發生密切相關,研究發現TSC-mTOR通路之一,即PI3K-Akt-TSCI/2-mTOR信號通路可能參與系膜肥大增殖。如PI3K-Akt-TSCI/2-mTOR在生長停滯特異性基因6(Growtharrest.specificgene6)誘導系膜和腎小球肥大過程中起重要作用,雷帕霉素可阻斷PI3K-Akt-TSCI/2-mTOR通路活化和系膜肥大[1]。Komers等報告,PI3K-Akt-TSCI/2-mTOR路還可通過調節mTOR主要的下游分子p70S6K和elF-4E的表達,引起DN的腎臟肥大[2]。我們的實驗結果表明,在3組腎陽虛的共同特征是PDK1調控PI3KAkt-TSCI/2-mTOR通路,通過PP2A調控磷酸化下游靶蛋白核糖體p70S6激酶,如S6K1及4EBP1。糖尿病腎病組在該通路中還存在差異基因FKBP12,直接通過雷帕霉素調控mTOR信號通路(見圖2)。也就是說在糖尿病腎病腎陽虛證在mTOR信號通路上與健康組有3個位點存在差異表達,而在3組腎陽虛證共有的特征中僅有2個位點有差異,這就決定了在治療上有所不同。
3.2.2 Notch信號通路
廣泛存在于多種動物體內,在進化過程中高度保守,主要介導細胞的分化抑制信號,在胚胎發育、血細胞發育、腫瘤形成等生理病理過程中起重要作用。
3組病例在notch信號通路中共同的差異表達基因有:MAML1(mastermind-like1)、EP300(E1Abindingproteinp300),見圖3。
MAML1:有證據表明人類在體外homolog形成一個復雜的人類細胞內的部分缺口受體和可以增加表達Notch-induced基因。此證據支持這個提議的功能相當于一個co-activator切口轉錄在信號傳導途徑。有證據表明它是該通路的一個催化劑。
EP300(E1Abindingproteinp300)它的功能是通過組蛋白乙酰轉移酶調節轉錄核染質的再塑造和重要過程中細胞的增生和分化。可以調節cAMP-gene結合具體的調節蛋白磷酸化CREB。這個基因也被認定為缺氧因子1a的催化劑復合物,因此就在如血管內皮生長因子等缺氧誘導基因中扮演了一個重要角色。
上述表明,腎陽虛證在notch信號通路中通過在基因MAML1、EP300表達下調,降低了對細胞增殖和分化的催化作用,使與該通路相關的胚胎發育、血細胞發育降低,骨髓細胞生成減少。這種作用與中醫描述的腎藏精、主骨生髓的生理功能非常相似。腎藏先天之精,靠后天滋養,人體的生長發育與之密切相關;腎主骨,骨生髓、髓能生血;當人體出現在腎陽虛的病理狀態下時,就可能導致小兒生長發育遲緩,髓不能生血出現血液虧虛,腎的這一生物學機制可能與notch信號通路調控有關。


然而在陽痿腎陽虛組中我們發現在Notch通路中還存在CIR1(corepressor interacting with RBPJ1)和DVL3表達有差異,二者均是起負反饋作用。所以對陽痿腎陽虛證的治療不同于其他疾病腎陽虛證的治療,可能是在于對CIR1和DVL3基因表達的調節上。
3.2.3 Wnt信號通路
Wnt是一類分泌型糖蛋白,通過自分泌或旁分泌發揮作用。Wnt信號途徑能引起胞內β-連鎖蛋白 (β-catenin)積累。β-catenin是一種多功能的蛋白質,在細胞連接處它與鈣黏素相互作用,參與形成黏合帶。而游離的β-catenin可進入細胞核,調節基因表達。正常機體腎臟中Wnt信號是“沉默”的,胞質中僅有少量游離態的β-catenin,體內絕大多數β-catenin在胞膜處與E-cadherin形成復合體,對維持同型細胞的黏附、防止細胞的遷移發揮作用。Surendran等[3]利用單側輸尿管結扎方法造成大鼠腎小管間質性腎纖維化模型,發現wnt4在集合管中有表達伴隨集合管周圍纖維化形成,間質成纖維細胞wnt4高水平表達與I型膠原mRNA及a-sMA的高表達一致;體外實驗表明Wnt4可以誘導培養的成纖維細胞β-catenin進入細胞核內。提示Wnt信號轉導通路可能在腎臟纖維化中發揮著重要作用。慢性腎炎腎陽虛證組與腎陽虛證共同特征的差異在于,前者通過CAMK2G還參與了Wnt蛋白介導的Wnt5/Ca2+通路 (如圖4)。CAMK2G是屬于絲氨酸/蘇氨酸蛋白激酶家族4種亞基之一,在Ca2+通路中發揮關鍵作用。
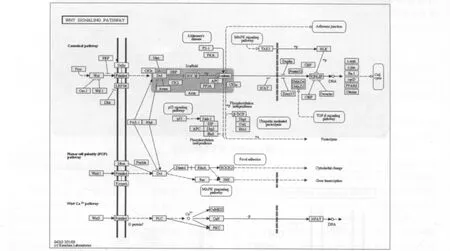
圖4 Wnt信號通路示意圖
4 討論
本次研究通過基因篩選,發現慢性腎炎、糖尿病腎病、陽痿等3種疾病的腎陽虛證除各有不同的差異表達基因外,還有共同的差異表達基因332條,其中有注釋的基因為181條。并通過轉錄組特征分析,發現與腎陽虛證相關的共同信號通路37個。說明不同疾病除具備各自特征的信號通路調控基因外,還具有共同的信號通路調控,為中醫“異病同證”、“異病同治”的經典論述從分子生物學的角度找到理論依據。
本次研究從每組樣本特有的差異表達基因中發現有mTOR、notch、Wnt等3條信號通路與腎陽虛證共有的信號通路一致,只是在通路的調控上有基因表達差異。
其中糖尿病腎病腎陽虛組在mTOR信號通路中存在差異基因FKBP12,直接通過雷帕霉素調控該信號通路;陽痿腎陽虛組中發現在Notch通路中存在CIR1(corepressor interacting with RBPJ1)和DVL3表達有差異;慢性腎炎腎陽虛組通過CAMK2G的差異表達調控Wnt信號通路。以上說明,3種不同疾病,同有腎陽虛證,雖然有共同的信號通路,即反應于外的大證相同,但因受不同疾病的影響,同一信號通路的調控基因有所差異,其細證的表現和病機也有所差異,這些表達差異基因有可能決定了治療上的差異。這一研究結果,為我們提出“同證異治”的創新治法觀點提供了分子生物學依據。由此可以認為,中醫在辨證論治的時候,應高度重視疾病對證候的影響,必須“從病辨證”。不僅要嚴格遵循“異病同證”, “同證同治”的傳統經典論述。還要重視疾病對證候的影響,參照“異病同證”,“同證異治”這一對傳統治法的補充和完善的創新理念,才能提高辨證論治的水平。
[1] NagaiK,MatsubaraT,MimaA,eta1.Gas6 induces Akt/mTOR-mediated mesangial hypertrophy in diabetic nephropathy[J].KidneyInt,2005,68(2):552-561.
[2]HiroyukiM,InokiK,KohsukeM,eta1.The mTOR pathway is highly activated in diabetic nephropathy and rapamycin has a strong therapeutic potential[J].Bloc and Biop ResCom,2009,384(105):471-475.
[3] SurendranK,Schiavi,HruskaKA.Wnt- dependentbeta-catenin signaling is activated after unilateralureteral obstruction and recombinant secreted frizzledrelated protein4 alters the progression of renal fibrosis[J].JAmSocNephrol,2005,16(8):2373 -2384.

