連續性靜脈靜脈血液濾過治療肝腎綜合征的臨床研究
李 靖 肖 瓊 韓志武 夏小紅 涂 娟 王 芳 徐友平 姚國乾
中國人民解放軍第161醫院全軍血液凈化中心 (湖北武漢,430010)
肝腎綜合征 (hepatorenal syndrome,HRS)是慢性肝病患者出現進展型肝功能衰竭和門脈高壓時,以腎功能損傷、腎血流灌注減少和內源性血管活性物質分泌異常為特征的一種綜合征。目前尚無有效治療措施,患者存活率低、預后差。我們應用連續性靜脈靜脈血液濾過 (continuous venovenous hemofiltration,CVVH)治療肝硬化肝腎綜合征患者,并與對照組進行比較,現將結果報告如下。
1 資料與方法
1.1 一般資料 2004年1月至2010年12月在我院住院的患者32例,均符合1996年國際腹水研究小組發表的關于肝腎綜合征的定義與診斷標準[1];其中男17例,女15例;年齡26~72歲,平均 (47.8±26.7)歲;肝腎綜合征Ⅰ型26例,Ⅱ型6例;原發疾病為乙型肝炎肝硬化20例,丙型肝炎肝硬化4例,膽汁性肝硬化2例,酒精性肝硬化1例,原因不明肝硬化3例,肝硬化合并原發性肝癌2例。所有HRS患者均無肝昏迷,無合并呼吸衰竭、心力衰竭、糖尿病及周圍血管病變存在。患者入院接受治療時均簽署知情同意書。將32例病例隨機分為兩組,每組16例,兩組患者在基線水平臨床及生化指標差異無統計學意義 (P>0.05),具有可比性 。見表1。
表1 兩組患者基線水平及臨床生化指標比較 ()
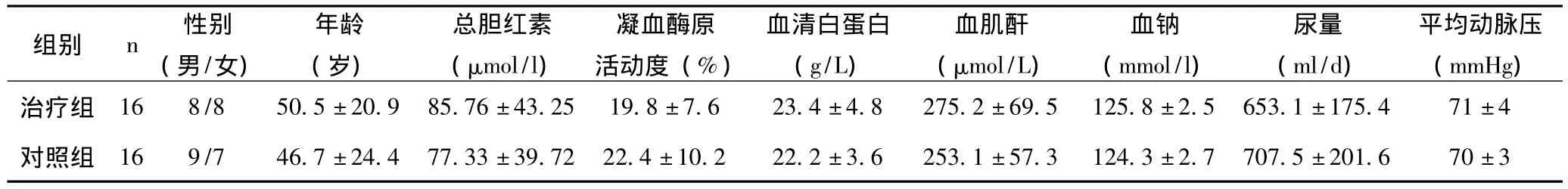
表1 兩組患者基線水平及臨床生化指標比較 ()
表2 兩組患者治療前及治療2周時生化指標、尿量、平均動脈壓變化比較()

表2 兩組患者治療前及治療2周時生化指標、尿量、平均動脈壓變化比較()
與本組治療前比較,*P<0.05;與對照組治療后比較,#P<0.05
表3 兩組治療前后血漿TNF-α、內毒素、腎素、血管緊張素Ⅱ變化()

表3 兩組治療前后血漿TNF-α、內毒素、腎素、血管緊張素Ⅱ變化()
與本組治療前比較,*P<0.05;與對照組治療后比較,#P<0.05
1.2 治療方法 所有患者均給予內科基礎治療,補充足夠能量,維持水、電解質和酸堿平衡,補充白蛋白、新鮮血漿、支鏈氨基酸,使用甘草酸二銨及抗生素等。
對照組患者在基礎治療上,采用去甲腎上腺素持續靜脈泵入,根據臨床平均動脈壓和尿量改變,去甲腎上腺素由0.5 mg/h逐漸增加至最大劑量3 mg/h,用至HRS恢復或至14天,而后3天內逐漸停藥。根據尿量,呋塞米起始量40 mg/d,最大量160 mg/d。
治療組患者在基礎治療上采用CVVH治療,具體實施方法:血管通路均為深靜脈置管 (頸內靜脈插管或股靜脈插管)。使用設備為PRISMATM機器 (Hospal)以及配套的M60管路和濾器 (AN69膜,0.6 m2),置換液采用Port配方配制,加溫后前稀釋法輸入,流量為1500~2000 ml/h,5%NaHCO3另路同步勻速輸入。普通肝素抗凝。血流量為150~180 ml/min,超濾量200~300 ml/h,嚴密觀察患者生命體征,治療時間為8~10小時,2~3次/W。兩組患者療程均為兩周。
1.3 觀察指標 觀察患者臨床癥狀、腹圍、飲食、精神狀態、尿量、生化指標,同時評估終止治療事件及轉歸。兩組患者在治療兩周時留取血清樣本,進行肝、腎功能、凝血功能、電解質、腫瘤壞死因子-α(TNF-α)、血清內毒素及腎素、血管緊張素Ⅱ檢測。
TNF-α測定應用ELISA雙抗體夾心法,試劑由深圳晶美生物工程有限公司提供。血清內毒素測定采用鱟試驗檢測,試劑由上海伊華臨床科技公司提供。腎素、血管緊張素Ⅱ采用放射免疫競爭結合法,試劑盒由中國北方生物技術研究所提供。
1.4 統計學方法 應用SPSS 13.0軟件進行統計分析,計量資料用()表示,治療前后比較應用配對資料t檢驗,組間比較應用方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者治療后臨床癥狀、預后及轉歸 治療組患者治療后臨床癥狀改善優于對照組,患者腹水減少或消失8例。對照組僅1例腹水減少。治療組存活患者腹脹減輕,腹圍縮小,體重下降,精神及食欲明顯改善。治療兩周時,治療組16例存活8例 (50%),死亡8例,對照組16例存活2例(12.5%),死亡14例,兩組存活率比較,差異有顯著性意義 (P<0.05)。治療期間兩組患者均無不良反應發生。
2.2 兩組患者治療前后血清生化指標及尿量變化 見表2。
2.3 兩組患者治療前及治療兩周時血漿TNF-α、內毒素、腎素、血管緊張素Ⅱ變化 見表3。
3 討論
肝腎綜合征是肝病終末期常見的嚴重并發癥[1],發病機制主要是全身血流動力學的改變,表現在內臟血管擴張,輸出量相對不足和有效血容量不足,腎素-血管緊張素-醛固酮系統和交感神經系統被進一步激活,最終導致腎皮質血管強烈收縮、腎小球濾過率下降[2]。肝移植雖是治療肝腎綜合征的有效方法,但由于患者生存時間短及肝源有限很難實施。因此,采取積極有效的方法,改善肝腎功能,使患者渡過危險期,為肝移植作準備,具有重要的臨床價值。
CVVH治療具有穩定血液動力學,精確控制容量,維持水、電解質酸堿平衡、改善平均動脈壓和外周血管阻力,改善氮質血癥的作用,能清除包括細胞因子、炎癥介質在內的小分子、中分子物質[3,4]。
肝硬化患者常由于腸黏膜滲透性增高、肝臟清除及滅活內毒素功能降低、門-體分流等原因導致血漿內毒素升高,而發生內毒素血癥。有研究顯示,HRS患者血漿內毒素水平與NO(一氧化氮)、TNF-α呈直線正相關,提示內毒素血癥和TNF-α在HRS發病機制中發揮非常重要的作用[5,6]。有研究表明,內毒素血癥可激活循環腎素-血管緊張素-醛固酮系統,引起機體血管強烈收縮[7]。同時低鈉血癥與有效血容量降低、腎灌注減低等因素可促進腎素-血管緊張素-醛固酮系統進一步激活[8,9],而誘發HRS。
本研究中應用CVVH治療HRS,一方面通過清除患者體內內毒素等代謝產物,創造穩定的內環境;另一方面調理炎癥介質及血管活性物質。結果顯示:治療組患者的臨床癥狀得到不同程度的改善,低鈉血癥、血流動力學、腎臟功能得到改善,生存率明顯提高。
究其機制可能為:①有效地清除血中的內毒素及炎癥因子,調理血管活性物質,改善血液循環功能紊亂狀態。②通過清除間質水分,改善微循環和細胞攝氧力,從而改善組織的氧利用率。③持續穩定調控氮質血癥和水、電解質及酸堿平衡。④為營養及代謝支持創造條件,從而使患者內穩機制得以重建。CVVH治療HRS療效肯定,簡便易行,值得進一步研究和推廣使用。
[1]ARROYO V,GINES P,GERBES AL,et al.Definition and diagnostic criteria of refractory ascites and hepatorenal syndrome in cirrhosis.International Ascites Club [J].Hepatology,1996,23(1):164-176.
[2]SALERNO F,GERBES A,GINE SP,et al.Diagnosis,prevention and treatment of hepatorenal syndrome in cirrhosis [J].Gut,2007,56(9):1310-1318.
[3]KADA K,PIERRE C,PIERRE P,et al.Continuous veno-venous hemofiltration improves hemodynamics in septic shock with acute renal failure without modifying TNF and IL6 plasma concentrations[J].Nephrol,2002,15(1):150-157.
[4]于光,田野芊,袁偉杰,等.連續性血液凈化對全身炎性反應綜合癥合并急性腎衰患者血漿炎性介質水平的影響 [J].中國急救醫學,2002,22(1):74-77.
[5]SUCH J,HILLEBRAND DJ,GUARNER C,et al.Tumor necrosis factor-alpha,interleukin-6,and nitric oxide in sterile ascetic fluid and serum from patients with cirrhosis who subsequently develop ascetic fluid infection [J].Dig Dis Sci,2001,46(10):2360-2366.
[6]盧放根,吳小平,霍繼榮,等.肝腎綜合征患者血漿TNF-α、NO及內毒素水平變化[J].暨南大學學報 (醫學版),2007,28(4):401-403.
[7]李晶鈴,王超,文艷,等.內毒素血癥時循環腎素血管緊張素系統改變的實驗研究[J].中國危重病急救醫學,2006,18(2):92-95.
[8]顧錫炳,陳浩坤,朱銀芳,等.補鈉與限鈉對肝硬化血腎素、血管緊張素Ⅱ、醛固酮及腎功能的影響[J].中華肝臟病雜志,2004,12(6):370.
[9]高寶秀,賀勇,李貴星,等.慢性重型肝炎并發肝腎綜合征的相關因素分析 [J].臨床肝膽病雜志,2011,27(7):749-751.

