利用等位基因特異性擴增檢測人結直腸癌BRAF基因V600E突變
司徒博,曹楠楠,劉麗琴,李 博,劉芹蘭,林 麗,王 前,鄭 磊*
(1.南方醫科大學南方醫院 檢驗醫學科,廣東 廣州510515;2.廣州軍區廣州總醫院 醫學實驗科,廣東 廣州510010)
RAS/RAF/MEK/ERK/MAPK信號轉導通路參與細胞生長、分化、凋亡等多種生物學事件。BRAF基因的編碼產物的是參與該通路信號轉導的一種重要絲氨酸/蘇氨酸激酶,該基因的15外顯子1799位核苷酸的T→A突變是BRAF基因的熱點突變(約占80%-90%)[1],此突變使其編碼的氨基酸由纈氨酸變為谷氨酸(V600E),導致該激酶活性大大增強,能持續激活MAPK信號通路,致使細胞異常增殖及分化,被認為是細胞癌變的關鍵因素[2,3]。在結直腸腫瘤治療中,BRAF V600E突變情況被認為是除KRAS突變外對分子靶向藥物西妥昔單抗與帕尼單抗的療效預測的另外一個重要指標[4,5]。此外,突變的BRAF基因也是結直腸腫瘤預后較差的一個生物標志物[6],以及區分散發性結直腸癌與Lynch綜合征的分子指標[7]。因而,準確檢測腫瘤組織中BRAF基因的突變情況具有重要的診療意義。本研究以人BRAF基因V600E突變位點設計等位基因特異性擴增引物,通過選擇性擴增實現檢測BRAF基因熱點突變的目的,通過與金標準Sanger測序法比較,探討該方法的可行性。
1 材料與方法
1.1 材料
1.1.1 細胞株 人大腸癌SW480及HT29細胞分別由南方醫院消化科及廣州軍區總醫院醫學實驗科惠贈。兩株細胞均經過測序證實分別為BRAF野生型及攜帶BRAF V600E雜合突變。
1.1.2 結直腸癌標本 40例結直腸癌石蠟標本來源于廣州軍區廣州總醫院病理科。所有提取DNA腫瘤組織切片均經鏡檢證實腫瘤細胞含量大于90%。
1.1.3 試劑與儀器 細胞核酸提取試劑盒(美國Omega公司),石蠟組織核酸提取試劑盒(德國Qiagen公司),TaKaRa TaqTM試劑盒(日本TaKaRa公司),瓊脂粉(西班牙Biowest公司)。Nanodrop2000分光光度計(美國Thermo公司),PCR儀(德國Eppendorf公司),凝膠成像儀(美國Bio-Rad公司)。
1.1.4 引物設計及合成 針對人BRAF基因V600E位點設計3’末尾堿基錯配的上游引物:TGATTTTGGTCTAGCTACAGA,下游引物:TTTCAACAGGGTACACAGAACA,下劃線堿基與BRAF野生型模板15外顯子1799位堿基錯配,與突變熱點V600E匹配而達到選擇性擴增的目的,擴增產物長度為490bp。測序引物擴增范圍覆蓋BRAF基因第15外顯子V500E突變位點:上游引物:AGATCTACTGTTTTCCTTTACTTACTACACC,下游引物:AATCAGTGGAAAAATAGCCTCAATTCT,擴增片段184bp。所有引物均由上海生工生物工程有限公司合成 ,PAGE純化。
1.2 方法
1.2.1 核酸提取 分別用細胞核酸提取試劑盒及石蠟組織核酸提取試劑盒對細胞及腫瘤標本進DNA提取,模板DNA置-20℃保存。
1.2.2 等位基因特異性擴增 對人大腸癌細胞株SW480、HT29以及40例腫瘤標本進行等位基因特異性擴增,條件如下:PCR體系總體積為20μl,含Mg2+buffer 2μl,dNTP mixture 1.5μl(各 2.5 mM),上下游引物各0.5μl(10umol),模板 DNA 30ng,加滅菌去離子水至20μl。反應條件:95℃預變性30s;95℃變性10s,67℃退火20s,72℃延伸30s,共45個循環。腫瘤標本取1μl第一次擴增產物作為進行二次擴增,擴增條件一致。PCR產物取5μl進行瓊脂糖(2%)凝膠電泳30min后顯像。
1.2.3 普通PCR并測序 所有標本及細胞株均經PCR后測序與等位基因特異性擴增結果作比較。PCR反應條件:含 Mg2+buffer 2μl,dNTP mixture 1.5μl(各2.5mM),上下游引物各1μl(10μmol),模板DNA 30ng,加滅菌去離子水至20μl。反應條件:95℃預變性30s;95℃變性10s,54℃退火20s,72℃延伸30s,共40個循環。PCR產物經瓊脂糖(2%)凝膠電泳證實目的條帶擴增成功后送測序(華大基因有限公司)。
1.2.4 靈敏度檢測 取SW480及 HT29細胞株DNA經核酸定量儀均定量為30ng后,按一定比例用攜帶有BRAF野生型(SW480)的核酸混合到帶有BRAF V600E突變(HT29)的核酸中,得到分別含有50%、25%、12.5%、6.2%、3.1%、1.5%的突變DNA的混合模板,分別取30ng進行等位基因特異性擴增與普通PCR后測序進行靈敏度比較。
2 結果
2.1 等位基因特異性擴增BRAF V600E突變結果 在上述PCR條件下,該方法成功選擇擴增出攜帶有BRAF V600E雜合突變的細胞株(圖1)。而在40例大腸癌石蠟標本中,3例出現了目的擴增產物(圖2)。
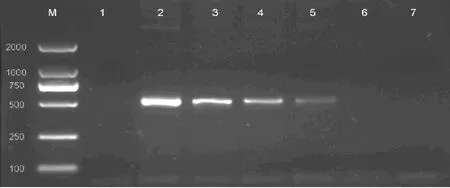
圖1 不同比例的BRAF V600E突變核酸經等位基因特異性擴增后行瓊脂糖凝膠電泳

圖2 利用等位基因特異性擴增檢測40例大腸癌石蠟標本
2.2 普通PCR后測序結果 40例大腸癌石蠟標本經成功擴增后送測序,測序結果顯示40例標本中37例BRAF基因15外顯子1799位核苷酸為野生型,3例為BRAF V600E突變,檢測結果與等位基因特異性擴增結果一致。
2.3 兩種方法靈敏度比較 如圖1顯示,通過等位基因特異性擴增不同比例突變核酸,本方法可在6.2%的突變基因模板中擴增出目的條帶,顯示本方法檢測BRAF V600E突變的敏感度可低至6.2%。普通PCR后測序結果則能從峰圖中顯出50%、25%、12.5%的突變位點,低于12.5%則與背景信號混雜無法測出(圖3)。
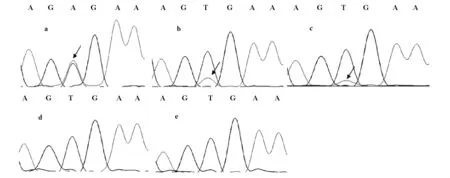
圖3 不同比例的BRAF V600E突變核酸經普通PCR后測序的信號峰圖
3 討論
腫瘤是由于細胞在致癌因素的影響下發生基因變異,從而失去對生長的正常調控而導致的單克隆性異常增生所致。其中,被認為對腫瘤形成起重要作用的突變被稱為“驅動突變”(Driver Mutation),準確、敏感地檢測該類突變可作為腫瘤的生物標志物從而對腫瘤的分子診斷提供重要信息。BRAF V600E突變已被證實出現于甲狀腺癌、大腸癌、惡性黑素瘤、肺癌、毛細胞白血病等多種腫瘤中[8],在腫瘤的早期診斷、鑒別診斷、預后判斷以及分子分型中起了重要作用。近年來,隨著分子靶向藥物的不斷研發,作用于BRAF突變蛋白的靶向藥物也陸續進入臨床。目前該基因突變情況被認為是對大腸癌[9]、惡性黑素瘤[10]分子靶向藥物療效預測的重要指標而受到人們的日益重視。由于靶向藥物往往價格昂貴且毒副作用明顯,因而準確、敏感地檢測出判斷其療效的基因突變情況具有重要的指導意義。然而,眾多晚期腫瘤患者初診時已失去手術機會,檢測腫瘤源性的突變基因情況只能通過穿刺組織活檢、胸腹水等檢測。該類標本腫瘤細胞豐度低且混雜了大量正常的體細胞,即使是腫瘤組織本身,也常混雜了大量野生型的體細胞。目前檢測突變的常用方法有測序、RFLP(限制性片段長度多態性)、SSCP(單鏈構象多態性)、熒光定量PCR、dHPLC(變性高效液相色譜)、HRM(高分辨率溶解曲線)等,RFLP與SSCP存在步驟繁瑣、敏感性欠佳的缺點;定量PCR、HRM及dHPLC均需要特殊設備或標記探針;被認為是基因檢測“金標準”的測序法往往需要昂貴的測序儀器及較復雜操作要求,且成本較高、操作耗時,一般實驗室難以開展。此外,臨床上利用測序作為檢測方法實驗室為避免假陰性,往往拒收腫瘤細胞含量低于50%的標本,導致了一部分晚期腫瘤病人對靶向治療選擇無據可循。
等位基因特異性擴增是檢測已知突變的一種簡便方法,該方法利用Taq酶缺少3’→5’外切酶活性,引物3’末端堿基與模板錯配時,擴增難以進行的原理,而達到選擇性擴增定點突變或野生型基因的目的。本研究通過設計上游引物3’端與BEAF基因V600E點突變完全互補、與野生型堿基錯配的上游引物,通過優化反應條件,從而達到選擇性擴增BRAF V600E突變的目的。通過利用攜帶V600E突變的HT29細胞與BRAF野生型的SW480大腸癌細胞株的模板稀釋實驗,證實該方法可檢測出混雜于野生型中的6.2%BRAF突變,與測序相比(12.5%)本方法具有更高的靈敏度。利用本研究建立方法檢測40例大腸癌石蠟標本,成功檢測出3例,與PCR后測序結果對比一致。
綜上所述,等位基因特異性擴增可快速檢測出腫瘤BRAF基因V600E突變,與測序法相比,本方法無需特殊設備,具有簡便、快捷、靈敏、經濟的特點,較適合普通實驗室對腫瘤突變基因的篩查檢測。
[1]Kumar R,Angelini S,Czene K,et al.BRAF mutations in metastatic melanoma:apossible association with clinical outcome[J].Clin Cancer Res,2003,9:3362.
[2]Balmanno K,Cook SJ.Tumour cell survival signalling by the ERK1/2pathway[J].Cell Death Differ,2009,16:368.
[3]Wickenden JA,Jin H,Johnson M,et al.Colorectal cancer cells with the BRAF(V600E)mutation are addicted to the ERK1/2 pathway for growth factor-independent survival and repression of BIM[J].Oncogene,2008,27:7150.
[4]Amado R G,Wolf M,Peeters M,et al.Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer[J].J Clin Oncol,2008,26:1626.
[5]Di Nicolantonio F,Martini M,Molinari F,et al.Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer[J].J Clin Oncol,2008,26:5705.
[6]Yokota T,Ura T,Shibata N,et al.BRAF mutation is a powerful prognostic factor in advanced and recurrent colorectal cancer[J].Br J Cancer,2011,105:856.
[7]Domingo E,Laiho P,Ollikainen M,et al.BRAF screening as a low-cost effective strategy for simplifying HNPCC genetic testing[J].J Med Genet,2004,41:664.
[8]Davies H,Bignell GR,Cox C,et al.Mutations of the BRAF gene in human cancer[J].Nature,2002,417:949.
[9]Loupakis F,Ruzzo A,Cremolini C,et al.KRAS codon 61,146and BRAF mutations predict resistance to cetuximab plus irinotecan in KRAS codon 12and 13wild-type metastatic colorectal cancer[J].Br J Cancer,2008,101:715.
[10]Paul BC,Axel H,Caroline R,et al.Improved Survival with Vemurafenib in Melanoma with BRAF V600EMutation[J].N Engl J Med,2011,364:2507.

