基質金屬蛋白酶及其抑制劑與腦出血預后的關系*
陜西省人民醫院神經內科 (西安710068)
李 偉 方 婷△ 于叔麒 楊 謙 王 倩 陳 巖 郭生龍
腦出血占腦血管病約20%~30%。盡管腦出血有較高的致死率,但目前尚無有效的治療措施[1]。研究發現,出血灶周圍水腫體積和血腫再擴大與患者的不良預后相關[2]。因此,了解這些并發癥的分子學基礎有助于更好的采取措施,改善患者預后。
正常情況下,基質金屬蛋白酶(Matrix metalloproteinases,MMPs)參與細胞外基質的重塑,但在一些病理過程中如炎癥、新生血管形成、腫瘤侵襲轉移等也起很重要的作用。MMPs可損害血腦屏障,導致水和一些有害分子進入腦實質。目前大量的證據表明,MMPs與腦梗死的預后相關[3],但其與腦出血的預后研究較少。研究發現,血清MMP-9水平升高是所有類型卒中出血性轉化的獨立預測因素[4]。腦出血患者在發病24h內,血清 MMP-9的表達有明顯增加[5,6]。本研究的目的是觀察腦出血患者MMPs及其抑制劑(Tissue inhibitors of metalloproteinases,TI MPs)的表達情況,以及這些分子與患者神經影像學和預后的關系。為腦出血的臨床干預提供理論基礎。
對象和方法
1 研究對象 納入發病12h內的腦出血患者。詳細收集患者的臨床資料。排除繼發于腦血管畸形、凝血障礙、腦外傷和腦腫瘤性出血以及出血性腦梗死。共有56例患者納入,均未手術治療。分別于入院時、發病24h、48h、7d和3個月時采用格拉斯哥昏迷量表(Glasgow Co ma Scale,GCS)和美國國立衛生研究院卒中量表(National Institutes of Health Stroke Scale,NI HSS)評價患者的意識狀況和神經功能缺損程度。同時在發病后3月時采用Barthel指數和改良Rankin量表評價患者的預后。死亡和神經功能惡化均為不良結局。神經功能惡化是指前后兩次NI HSS評分增加4分以上者。
2 頭顱CT檢查 所有生存患者均在入院時、發病后48h、7d和3月時行頭顱CT。盲法讀片。血腫體積的計算采用多田氏公式:出血量(ml)=0.5×最大面積長軸(c m)×最大面積短軸(c m)×血腫層面數[7],這個公式也用于3月后殘余病灶體積的測量。出血灶周圍水腫體積的絕對值=CT掃描所示的總病灶的體積-高密度灶的體積,出血灶周圍水腫體積的相對值=出血灶周圍水腫體積的絕對值/血腫體積。如果較初次出血體積增大30%,則定義為血腫再擴大。出血部位分為深部和腦葉,深部是指基底節區和丘腦。
3 免疫測定法 分別于入院時、發病后24h、48h、7d和3個月時靜脈采血。高速離心機內2000g/min離心10 min,分離血清,轉移至1.5 ml EP管內,保存于-80℃冰箱中備用。ELISA法統一測定血清MMP-9、MMP-3、MMP-2、TI MP-1和TI MP-2的水平(試劑盒購自美國RB公司),嚴格按試劑盒說明書操作。
4 統計學方法 采用SPSS 13.0進行統計學分析。分類變量用頻數,連續性變量用均數±標準差或中位數(四分位間距)表示。分類變量采用Fisher確切概率法,計量資料采用Mann-Whitney U檢驗。連續性變量采用Spear man相關分析法。Logistic回歸模型分析與死亡相關的獨立因素。P<0.05定義為有統計學意義。
結 果
1 臨床和影像學 人口學特征、危險因素等見表1。基線時和隨訪的頭顱CT見表2。48h內血腫擴大有18例(32.1%)。出血灶周圍水腫體積在發病48h內明顯增加(P=0.013),之后的一周內保持穩定。27例(48.2%)患者在發病48h內病情加重。在隨訪期末有17例(30.4%)患者死亡。14例(25%)嚴重殘疾(中位值 MRS=3)。

表1 患者的一般資料
2 MMPs和TI MPs 血清MMP-2和TI MP-2水平在基線時最高,MMP-9和TI MP-1水平在發病后24h時最高,MMP-3在發病后48h時最高。除了基線時和3月時MMP-9、7d和3月時的MMP-3外,其余均在腦出血急性期表達增加(P<0.01)。與基線時比較,MMP-2水平在發病24h內明顯降低(P=0.004)。TI MP-1水平在發病24h內明顯增加。同時發現,MMP-2與TI MP-2在基線時有相關性(r=0.492,P=0.034),發病24h時MMP-9與MMP-3的水平有相關性(r=0.513,P=0.023)。
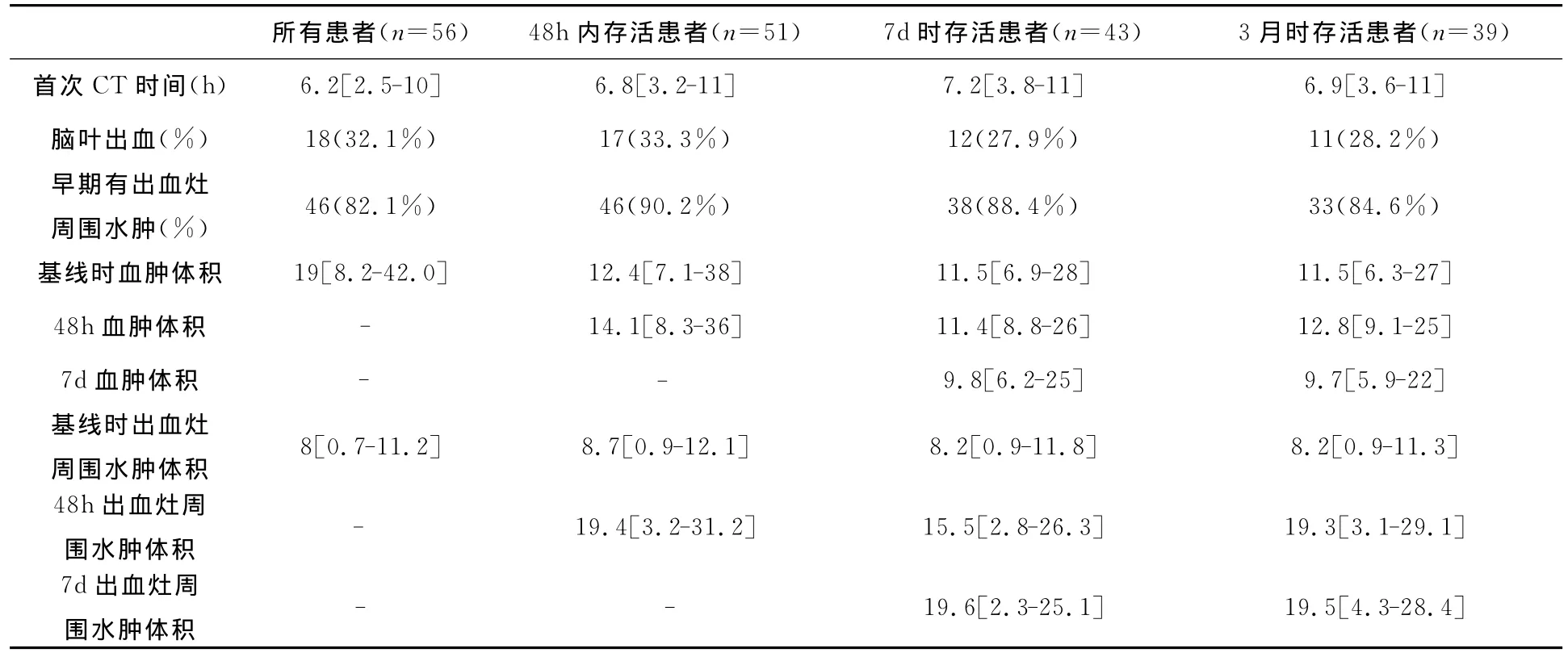
表2 基線和隨訪時頭顱CT資料
3 MMP、TI MP和影像學的關系 MMP和TI MP的水平與出血量無相關性。基線時出血灶周圍水腫體積與MMP-9水平正相關(r=0.586,P=0.042),與TI MP-1水平反相關(r=-0.484,P=0.043)。同時,我們發現MMP-9/TI MP-1與出血灶周圍水腫體積的相關性更強(r=0.69,P<0.01)。24h內出血灶周圍水腫體積擴大與基線時MMP-9水平相關(r=0.57,P=0.020),基線時TI MP-1水平與7d時出血灶周圍水腫體積擴大呈反相關(r=-0.51,P=0.043)。殘余病灶體積(中位值:3.54 ml)與48h時的出血灶和出血灶周圍水腫體積相關度最高(r=0.793,P=0.008;r=0.869,P<0.01)。基線時 MMP-9和24h時MMP-3的水平與殘余病灶體積相關(r=0.642,P=0.031;r=0.832,P<0.01),見表3。

表3 MMPs和TI MPs在腦出血后不同時點的表達(ng/ml)
4 MMPs和TI MPs與預后的關系 在基線資料中,血腫量、病情嚴重程度和MMP-3水平與死亡相關(見表4);多因素分析顯示,基線GCS和NIHSS評分及MMP-3水平與死亡獨立相關(RR=2.32,95%CI:1.75~8.51,P=0.029;RR=3.62,95%CI:2.05~9.16,P=0.046;RR=4.02,95%CI:1.54~14.9,P=0.023)。
討 論
本研究動態觀察了MMPs和TI MPs在腦出血不同時點的水平。這些分子在不同時點的過度表達與腦出血患者的影像學和預后相關。基線時MMP-9和TI MP-1水平與出血灶周圍水腫體積相關,殘余病灶體積與基線時MMP-9和24h時MMP-3水平相關。基線時MMP-3水平與腦出血患者3月時預后相關,MMP-3是死亡的獨立預測因素。
研究發現,腦出血患者的血清 MMP-9水平升高[5]。MMP-3、-7和-9水平在癥狀性腦出血后立即升高[8]。血清MMP-9水平升高是所有類型卒中出血性轉化的獨立預測因素[4]。腦出血病灶周圍組織中MMP-9水平較遠隔血腫部位腦組織水平高[9,10]。MMP-2和MMP-9水平升高可能在腦淀粉樣血管病導致的腦出血中起重要作用[11]。本研究發現,基線時MMP-9水平與早期水腫相關,且在第二天MMP-9隨著水腫的擴大而升高。
本研究發現,腦出血后TI MPs的表達不盡相同。TI MP-1在腦出血早期即升高,而TI MP-2則降低。缺血性和出血性腦卒中后TI MP-2的表達不同,Horstmann等發現腦卒中后 TI MP-2降低[12],Alvarez-Sabin等也發現腦出血后患者的TI MP-2水平降低[13]。3月后TI MP水平恢復正常。而Vukasovic等則發現缺血性腦卒中患者的TI MP-2水平升高[14]。有學者認為,TI MP-2可通過保護血腦屏障來降低出血灶周圍水腫體積[15]。TI MP-1可能像其他MMP抑制劑一樣有抗凋亡作用[16]。本研究支持基線時TI MP-1的表達有保護作用,機制可能是TI MP-1通過抑制MMP-9的表達來調整基質的合成和降解間的平衡起作用。
本研究發現,腦出血后24h時MMP-3水平與3月時血腫殘余病灶體積相關,MMP-3水平與患者3月時死亡獨立相關。MMP-3可降解層粘連蛋白,導致神經細胞死亡[17]。直接將純化的MMP-3注入大鼠體內,可增加大鼠血腦屏障的通透性;MMP-3可降解基底膜、破壞緊密連接蛋白和開放血腦屏障,因此便于中性粒細胞的進入[18]。因而我們推測MMP-3可能通過多種相關聯的機制導致細胞死亡,最終導致一些腦出血患者死亡。預后不良和殘余病灶體積可能是因其他機制作用,比如血清谷氨酸含量的增加[19]。
本研究的樣本量較小和納入患者病死率較高,導致可用于分析3月時患者結局的資料較少。其次,我們僅研究了一些與水腫和血腦屏障破壞相關的分子,為了闡明腦出血并發癥的分子基礎,以后的研究應盡可能納入更多與腦出血后血腫擴大相關的分子。
總之,腦出血后MMP和TI MP的水平發生改變。MMP-9水平升高與出血灶周圍水腫體積相關,MMP-3與患者3月時死亡相關,這兩種分子與殘余病灶體積相關。降低這兩種分子是否有利于腦出血患者還需要進一步研究。
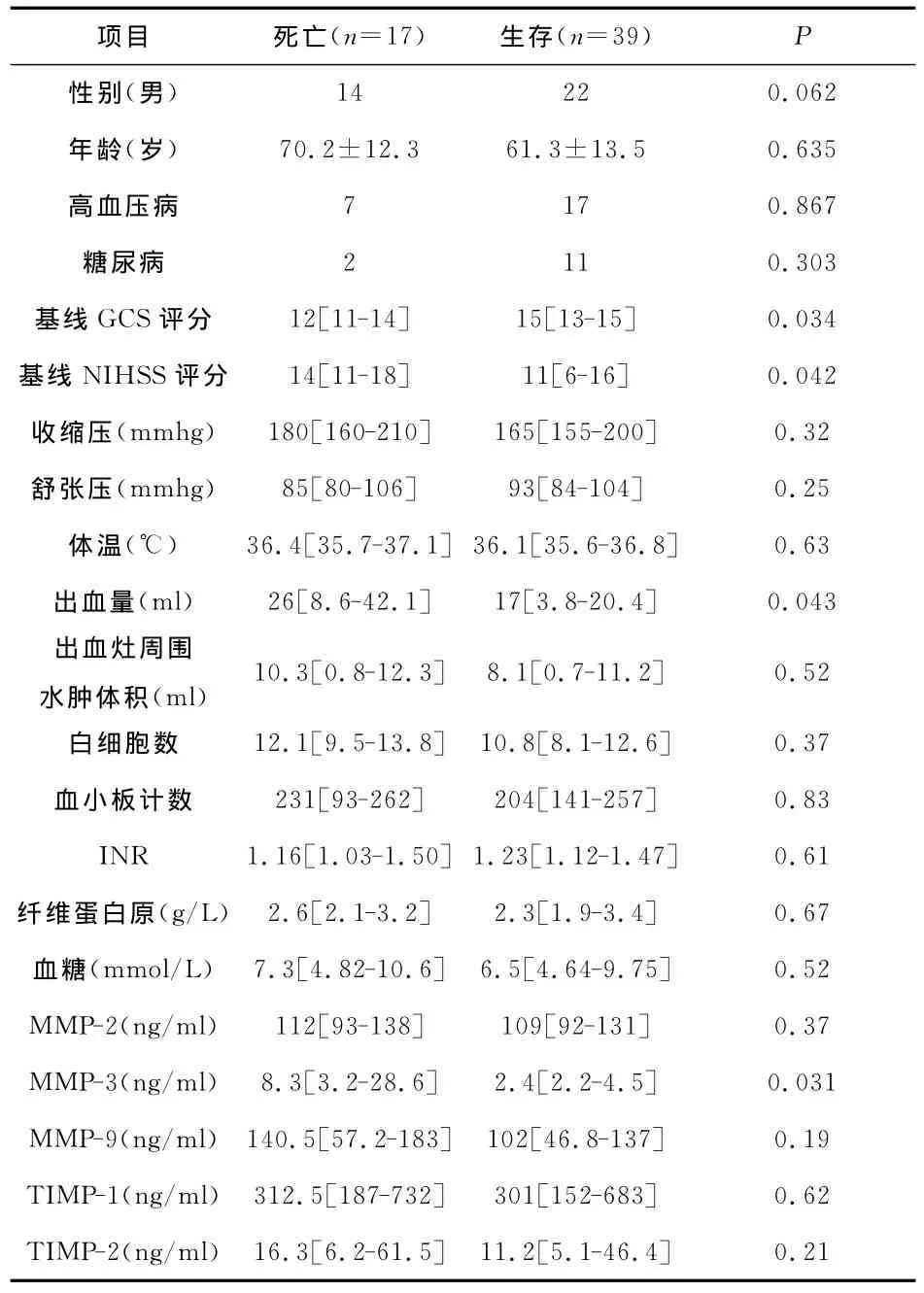
表4 死亡和生存患者的臨床、影像學和實驗室資料
[1]Steiner T,Bosel J.Options to restrict hemato ma expansion after spontaneous intracerebral hemorr hage[J].Stroke,2010,41(2):402-409.
[2]Leira R,Davalos A,Silva Y,etal.Early neurologic deterioration in intracerebral hemorrhage:predictors and associated factors[J].Neurology,2004,63(3):461-467.
[3]Manso H,Krug T,Sobral J,etal.Variants of the Matrix Metalloproteinase-2 but not the Matrix Metallopr oteinase-9 genes significantly influence f unctional outco me after stroke[J].BMC Medical Genetics,2010,11(1):40.
[4]Castellanos M,Leira R,Serena J,etal.Plas ma metaloporteinase-9 concenrtration predicts hemorrhagic transformation in acute ische mic stor ke[J].Stor ke,2003,34(1):40-46.
[5]Abilleira S,Montaner J,Molina CA,etal.Matrix metalloproteinase-9 concentration after spontaneous intracerebral hemorr hage[J].J Neur osur g,2003,99(1):65–70.
[6]吳成翰,皇甫赟,王開宇,等.腦出血患者血漿及血腫引流液中基質金屬蛋白酶-9的動態變化[J].中華醫學雜志,2008,88(3):174-176.
[7]Khotari RU,Brott T,Broderick JP,etal.The ABCs of measuring intracerebral hemorr hage volu me[J].Stroke,1996,27(8):1304–1305.
[8]Sansing L H,Kaznatcheeva EA,Per kins CJ,etal.Edema after intracerebral hemorrhage:correlations with coagulation para meters and treat ment[J].J Neurosurg,2003,98(5):985–992.
[9]Rosell A,Ortega-Aznar A,Alvarez-Sabin J,etal.Increased brain expression of matrix metalloproteinase-9 after ischemic and he morr hagic hu man stroke[J].Stroke,2006,37(6):1399–1406.
[10]尹曉亮,張新慶,張智敏,等.腦出血患者血腫周圍組織中基質金屬蛋白酶-9及其抑制劑的表達[J].中風與神經疾病雜志,2008,25(3):319-321.
[11]Lee JM,Yin KJ,Hsin I,etal.Matrix metalloproteinase-9 and spontaneous hemorrhage in an animal model of cerebral amyloid angiopathy[J].Ann Neurol,2003,54(3):379–382.
[12]Horst mann S,Kalb P,Koziol J,etal.Profiles of matrix metalloproteinases,t heir inhibitors,and la minin in stroke patients:influence of different therapies[J].Stroke,2003,34(9):2165-2170.
[13]Alvarez-Sabin J,Delgado P,Abilleira S,etal.Temporal profile of matrix metalloproteinases and their inhibitors after spontaneous intracerebral hemorr hage:relationship to clinical and radiological outco me[J].Stroke,2004,35(6):1316-1322.
[14]Vukasovic I,Tesija-Kuna A,Topic E,etal.Matrix metalloproteinases and their inhibitors in different acute stroke subtypes[J].Clin Chem Lab Med,2006,44(4):428-434.
[15]Rosenberg GA,Kor nfeld M,Estrada E,etal.TI MP-2 reduces proteolytic opening of blood-brain barrier by type IV collagenase[J].Brain Res,1992,576(2):203 –207.
[16]Baker AH,Zalts man AB,Geor ge SJ,etal.Divergent effects of tissue inhibitor of metalloproteinase-1,-2,or-3 overexpression on rat vascular s mooth muscle cell invasion,proliferation,and death in vitro.TI MP-3 promotes apoptosis[J].J Clin Invest,1998,101(6):1478–1487.
[17]Chen ZL,Strickland S.Neuronal death in the hippocampus is pro moted by plas min-catalyzed degradation of laminin[J].Cell,1997,91(7):917–925.
[18]Gur ney KJ,Estrada EY,Rosenber g GA.Blood–brain barrier disruption by stro melysin-1 facilitates neutrophil infiltration in neuroinflammation[J].Neurobiol Dis,2006,23(1):87–96.
[19]Castillo J,Davalos A,Alvarez-Sabin J,etal.Molecular signatures of brain injur y after intracerebral he morr hage[J].Neurology,2002,58(4):624–629.

