Wistar大鼠卵巢顆粒細胞的分離、培養與鑒定
肖 娟 鄔 靜,2 屠 迪,2 袁 慧,2 文利新,3 李榮芳※,2
由于卵巢顆粒細胞通過凋亡和激素分泌在生殖過程中起著非常重要的作用,因此對顆粒細胞的研究越來越受到人們的重視,加上生殖系統的調控機制相當復雜,很難直接通過動物實驗探討相關受試化合物的毒理學作用機制。因此,本次實驗建立大鼠卵巢顆粒細胞體外原代培養體系,為研究毒物對生殖系統造成毒性的作用機理提供有效的體外模型。
1.材料與方法
1.1 實驗動物 (21~29)天齡未成熟雌性wistar大鼠,體重80±20g,SPF級,由湖南斯萊克景達實驗動物有限公司提供。
1.2 主要試劑 DMEM培養基購自Gibco公司。胎牛血清(FBS)購自四季青公司。孕馬血清(PMSG)購自北京海德創業。四甲基偶氮唑藍(MTT)、二甲基亞砜(DMSO)購自Amresco公司。大鼠孕酮(P)和雌二醇(E2)ELISA檢測試劑盒購自Rapidbio.Lab公司。卵泡刺激素受體(FSHR)免疫組化檢測試劑盒購自博士德公司。
1.3 主要儀器 倒置顯微鏡、生物顯微鏡,CO2培養箱、全自動高壓滅菌器,超凈工作臺,臺式離心機,多功能酶標儀。
2.方法
2.1 Wistar大鼠卵巢顆粒細胞的分離和培養 每只wistar大鼠一次性皮下注射PMSG 40IU,作用48小時,頸椎脫臼處死。打開腹腔,在無菌條件下迅速取出雙側卵巢,40倍解剖顯微鏡下眼科剪剪破有腔卵泡,輕輕拍打與擠壓,使卵母細胞及顆粒細胞同時逸出,反復輕輕吹打使顆粒細胞釋放進入預冷的DMEM培養基中。200目不銹鋼細胞篩過濾,1000rpm、10分鐘離心后,在含10%FBS的DMEM培養基中重懸并記數,苔盼藍染色檢測細胞活力,細胞活力>90%,調整細胞密度為1×105cells/ml,接種于6孔板,置于37℃,5%CO2濃度,飽和濕度培養箱中培養,每隔48小時更換培養液,倒置顯微鏡下觀察、拍照。
2.2 Wistar大鼠卵巢顆粒細胞的鑒定
2.2.1 顆粒細胞的HE染色 取重懸的顆粒細胞接種于24孔板中,每孔接種1×105個細胞,放入CO2培養箱中,在37℃,5%CO2濃度,飽和濕度下進行培養,當細胞長至鋪滿蓋玻片70%~80%時取出玻片;用PBS洗玻片,5分鐘×3次;4%多聚甲醛固定20分鐘,取出玻片,PBS洗玻片,5分鐘×3次;蘇木素染色2分鐘,流水沖去浮色;入鹽酸酒精中分色數秒,流水小心沖洗;顯微鏡下觀察細胞核清晰,胞漿不著色;5%伊紅染色(2~3)分鐘,流水沖去浮色;梯度酒精脫水,二甲苯透明,中性樹脂封面后顯微鏡下觀察細胞形態,拍照。
2.2.2 免疫細胞化學法觀察FSHR蛋白表達 用于檢測的細胞爬片制作同前,4%多聚甲醛固定20分鐘,固定好的玻片,PBS洗滌5分鐘×3次;3%雙氧水于室溫下孵育5分鐘,PBS洗滌5分鐘×3次;加正常的山羊血清,封閉無關的抗原,室溫下孵育20分鐘,傾去不洗;于玻片上滴加一抗FSHR兔多克隆抗體(1∶200),置于濕盒中4℃過夜,PBS洗滌5分鐘×3次;滴加二抗IgG,37℃孵育60分鐘;PBS洗滌5分鐘×3次。滴加辣根過氧化酶標記的鏈霉素工作液50μl,37℃孵育30分鐘;PBS洗滌5分鐘×3次。于玻片上滴加DAB顯色液,在顯微鏡下觀察控制顯色時間;流水沖洗,蘇木素復染(5~10)分鐘;流水沖洗3次;常規梯度酒精脫水,二甲苯透明,中性樹脂封片后顯微鏡下觀察細胞形態,拍照。
2.2.3 顆粒細胞生長曲線的測定 取重懸的顆粒細胞接種于96孔板內,每孔接種2×104個細胞,每天接種4孔,連續接種8天,于第9天加入 MTT溶液10μL,置于CO2培養箱,37℃培養4小時后取出,小心用移液槍吸出上清液,每孔加入DMSO 150μL,于振蕩器震蕩10分鐘,使細胞內MTT藍紫色結晶完全溶解,在酶標儀570nm波長處進行比色、讀數,測出每孔吸光度值(OD值),取4孔平均值,實驗重復3次。以培養時間為橫軸,吸光值為縱軸,繪制細胞生長曲線。
2.2.4 顆粒細胞激素分泌情況的測定 取重懸的顆粒細胞接種于24孔板內,每孔接種1×105個細胞,共接種3孔,加入不含血清的DMEM培養基(含有10ng/ml FSH、3ng/ml雄烯二酮),置于CO2培養箱中,在37℃,5%CO2濃度,飽和濕度下進行培養,每隔24小時更換并收集培養液放于-80℃保存,連續收集8天,最后進行孕酮(P)和雌二醇(E2)含量的檢測,按照ELISA檢測試劑盒的說明書進行操作。
3.結果
3.1 Wistar大鼠卵巢顆粒細胞的分離和培養 顆粒細胞從卵泡中釋放出來時,鏡下觀察呈圓形,表面可見黑色顆粒,約(4~6)小時貼壁,48小時后置于倒置顯微鏡下觀察,可見細胞生長呈星狀或梭狀,細胞與細胞間有延長的絲狀偽足相互連接,細胞核大而圓,胞質富含空泡及顆粒,細胞聚集生長,96小時左右基本鋪滿培養瓶底部,見圖1。
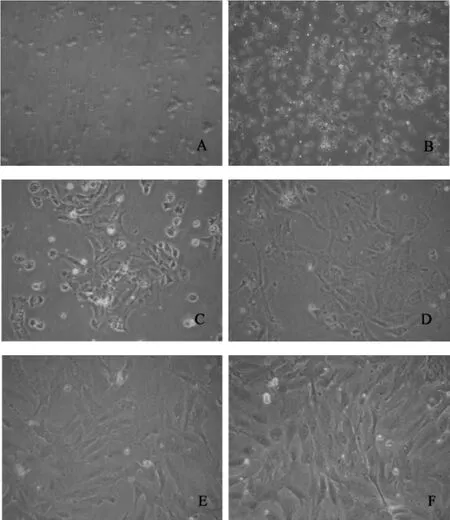
圖1 大鼠卵巢顆粒細胞原代培養圖(200×)
3.2 Wistar大鼠卵巢顆粒細胞體外生長曲線 MTT法測得的細胞生長曲線見圖2。由圖可見,卵巢顆粒細胞培養初期隨著培養時間的延長而增殖,培養24小時內細胞處于貼壁生長適應期,24小時后OD值開始大幅度的增高,判斷細胞迅速進入對數生長期,到120小時細胞生長極度旺盛,OD值達到最大值;隨后逐漸下降,第168小時開始,出現類似成纖維細胞的形態,培養168小時以后,細胞開始退化,第192小時結束時的吸光度測定。
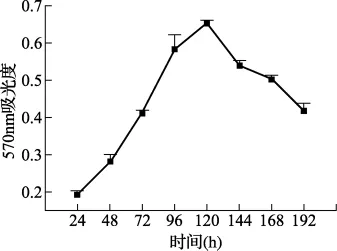
圖2 顆粒細胞體外生長曲線
3.3 Wistar大鼠卵巢顆粒細胞的鑒定
3.3.1 HE染色 HE染色在鏡下可見貼壁細胞形態完整,體積較大,邊緣清晰,大小均一,呈多角形或梭形,細胞漿和細胞核染色均勻,核染深藍色呈卵圓形或不規則形,位于細胞中央,胞漿淡紅色并含有許多顆粒,見圖3。
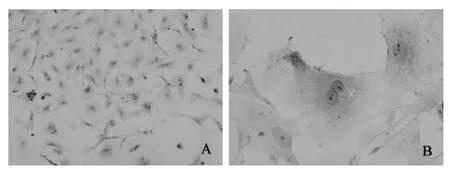
圖3 顆粒細胞HE染色
3.3.2 FSHR免疫細胞化學法 FSHR陽性染色主要位于細胞胞漿,呈棕褐色著染,細胞核呈深藍色,鏡下可見FSHR的陽性率>90%(見圖4),由此表明分離培養的顆粒細胞純度達到90%以上。
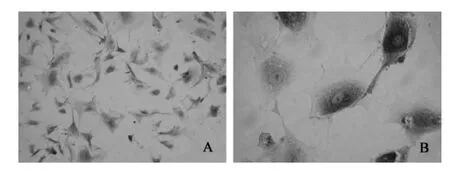
圖4 顆粒細胞免疫細胞化學染色
3.3.3 顆粒細胞的激素分泌 ELISA法測得顆粒細胞P和E2的體外分泌情況見圖5,激素的分泌趨勢與細胞的生長情況基本一致,于在(96~120)小時左右達到峰值,隨后逐漸下降。
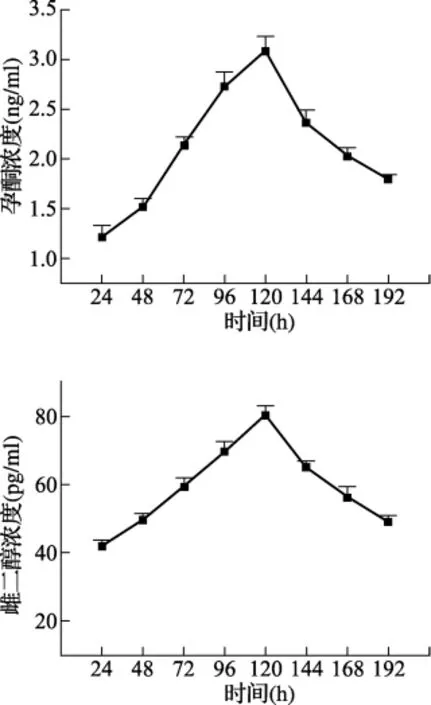
圖5 顆粒細胞體外激素分泌情況
4.討論
目前,研究者對卵巢細胞的培養已不僅僅應用于生殖生理方面的研究,在生殖病理、毒理等的研究方面也有重大的作用[1]。因此,研究顆粒細胞是研究卵母細胞成熟的一個很好的切入點[2]。體外培養的卵巢細胞為研究毒物對生殖系統造成毒性的作用機理提供了有效的體外模型。新生大鼠顆粒細胞在離體前未接觸過內源性促性腺激素的刺激,采用PMSG刺激雌性wistar大鼠使之處于動情前期,獲得大量相同發育階段的顆粒細胞。體外培養(4~6)小時后顆粒細胞開始貼壁生長,(48~96)小時內細胞大量增殖,生長旺盛,并可獲得較高的細胞存活率,實驗結果與文獻報道一致[3]。原代細胞培養的優勢在于最大程度地保存了細胞的特性,使體外實驗結果更符合于體內的情況。
卵巢顆粒細胞是雌性動物卵巢內唯一表達FSHR的細胞[4],可以應用FSHR免疫細胞化學染色對卵巢顆粒細胞的進行特異性染色。因此,本研究采用免疫細胞化學法鑒定顆粒細胞表面FSHR的表達,以此作為原代培養顆粒細胞的鑒定標準。研究結果表明,于體外建立的卵巢顆粒細胞培養體系中,FSHR的陽性率可達到90%以上,可以進行相關實驗,所獲得的實驗數據也相對可信。
顆粒細胞是卵泡內的最大細胞群,也是主要的功能細胞,卵泡發育的顯著標志之一就是顆粒細胞迅速生長及增殖,而成年動物的卵泡閉鎖主要是由顆粒細胞凋亡引起,尤其在卵泡發育后期,此外,顆粒細胞還與卵泡膜細胞共同完成卵巢激素的合成,維持著有利于卵母細胞生長和成熟的微環境[5~8]。雌激素在體內有著廣泛的效應,包括:調控性成熟,控制排卵,調節生殖行為,建立和維持妊娠,調節乳腺發育等。而孕激素能拮抗雌激素的作用,孕激素對E2生殖效應的拮抗作用涉及到多個方面,包括抑制雌激素誘導的細胞周期調節因子的轉位、改變雌激素受體的表達,并能誘導雌激素分解代謝的酶[9]。由此可見,顆粒細胞與卵泡膜細胞之間的相互作用是卵泡發育和卵巢激素合成的基礎[10],它們可通過間隙連接,以自分泌和旁分泌的方式,維持有利于卵母細胞生長和成熟的微環境,提示顆粒細胞在卵巢局部微環境調節系統中發揮著重要作用。實驗過程中,在FSH作用下,顆粒細胞維持著一定的孕酮和雌二醇分泌水平,在(96~120)小時達到峰值,與體內生理情況相符,說明原代培養的顆粒細胞保持了原有細胞的特性。
綜上所述,卵巢顆粒細胞體外培養技術在生殖毒性研究方面有良好的應用前景。本實驗所建立的細胞培養體系是可行的、理想的,適合進行相關的毒理學實驗。如果可獲得人的卵巢組織并進行培養,可直接用于對人體生殖毒性的研究,無疑意義重大。
1 張天寶綜述,楊在昌,孫棉齡審校.大鼠卵巢細胞體外培養及生殖毒理研究中的應用[J].衛生毒理學雜志,1997,11(2):128-130.
2 白曉紅,糜若然,岳天孚,等.體外培養人卵巢黃素化顆粒細胞的鑒定及其分泌功能變化[J].中華婦產科雜志,2005,40(5):351-352.
3 Lovekamp TN,Davis BJ.Mono-(2-ethylhexyl)phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells[J].Toxicol Appl Pharmacol,2001,172(3):217-224.
4 Simoni M,Gromoll J,Nieschlag E.The follicle-stimulating hormone receptor:biochemistry,molecular biology,physiology and pathophysiology[J].Endocr Rev,1997,18(6):739-773.
5 吳際,張麗珠,李潭,等.性激素對人卵巢顆粒細胞凋亡的作用[J]. 中華婦產科雜志,1998,33(3):157 -159.
6 Erickson GF.An analysis of follicle development and ovum maturation[J].Seminars ReProd Endoerinol,1986,4:233 -254.
7 桑潤滋主編.動物繁殖生物技術[M].北京:中國農業出版社,2002.
8 Eriekson GF.Physiologic basis of ovulation induetion[J].Seminars ReProd Endoerinol,1996,14(4):287 -297.
9 許振成,許虹,張素坤,等.2,3,7,8-四氯二苯并對二噁英對大鼠卵巢顆粒細胞雌二醇和孕酮分泌的影響[J].生態毒理學報,2009,4(1):131 -135.
10 莫中福,殷秀玲,徐素欣,等.DahlS高血壓大鼠卵巢的細胞凋亡研究[J].中國醫師雜志,2002,12(4):1328-1331.

