miR-146b-5p異常表達對胰腺癌細胞生物學特性的影響
林凡 王敏 洪曉泉 周偉 王欣 秦仁義
·短篇論著·
miR-146b-5p異常表達對胰腺癌細胞生物學特性的影響
林凡 王敏 洪曉泉 周偉 王欣 秦仁義
MicroRNAs(miRNAs) 是由一類內源性的非編碼RNA組成,長度大約20~24 nt,來源于長的前體pri-miRNA和pre-miRNA[1-3]。在多細胞生物體中,它通過不完全堿基互補配對的方式識別靶位點,轉錄后調控基因的表達[4-5]。盡管過去的幾年中通過基因芯片篩查腫瘤特異性miRNA有很大的進展[6],但miRNA影響腫瘤形成和發展的機制仍不清楚。本研究檢測6株胰腺癌細胞miR-146b-5p的表達,觀察其對胰腺癌細胞生物學特性的影響。
一、材料與方法
1.細胞培養和轉染:人胰腺癌細胞系MIA PaCa-2、BxPC-3、AsPC-1、PANC1、SW1990、PC-3為同濟醫院膽胰外科實驗室保存,3例正常胰腺組織為膽管腫瘤行胰十二指腸切除術的手術標本。取對數生長期miR-146b-5p表達最低的MIA PaCa-2細胞,采用lipofectamineTM2000將miR-146b-5p mimics和陰性對照miRNA(廣州銳博公司)分別轉染細胞,按照lipo2000轉染試劑盒說明書操作。
2.qRT-PCR檢測miR-146b-5p的表達:應用Trizol(Invitrogen公司)提取細胞或組織中的總RNA。分光光度計(Eppendorf BioPhotometer)測RNA的純度和濃度。應用ReverTra Ace?qPCR RT Kit(FSQ-101,TOYOBO公司) 二步法合成cDNA。應用SYBR?Green Realtime PCR Master Mix(TOYOBO公司)行實時熒光定量PCR。miR-146b-5p莖環狀逆轉錄引物,上、下游引物和內參RNA U6引物均購自廣州銳博公司。PCR反應條件:95℃ 3 min,95℃ 15 s、60℃ 1 min,40次循環。獲得的數據運用公式RQ=2-△△Ct的方法計算mRNA表達量。實驗重復3次,取均值。
3.MTT法檢測細胞增殖:直接在96孔板轉染細胞,24、36、48、60、72 h時分別每孔加入20 μl MTT(5 g/L,Sigma公司)繼續培養4 h,棄去液體,加入150 μl DMSO,震蕩10 min,酶標儀測定各孔490 nm 處的吸光值(A490值)。每個時間點設5個復孔,實驗重復3次,取均值。
4.流式細胞儀檢測細胞凋亡率和細胞周期:取轉染48 h細胞,消化后用預冷的PBS洗2次,部分細胞用500 μl Binding Buffer 重懸細胞于流式管中,加入5 μl Annexin Ⅴ/FITC(南京凱基公司),再加入5 μl PI,混勻后室溫避光15 min,上流式細胞儀檢測細胞凋亡率;部分細胞用PBS重懸,加入兩倍體積在-20℃預冷的70%乙醇4℃固定過夜。PBS洗滌2次后加100 μl RNase A,37℃水浴 30 min,再加入400 μl PI混勻,4℃避光30 min,上機檢測細胞周期。實驗重復3次,取均值。
5.細胞劃痕實驗檢測細胞遷移能力:MIA PaCa-2細胞轉染48 h后,用100 μl的消毒槍頭進行人工劃痕,用無血清培養液洗滌2次去除細胞碎片,倒置顯微鏡下(Nikon,日本)測量劃痕區相對距離。繼續培養24 h后,新鮮培養基洗滌2次,鏡下觀察細胞向劃痕區遷移的數目。每組設3個平行孔,每孔隨機選取3個視野進行細胞計數。
6.Transwell小室侵襲實驗檢測細胞侵襲能力:應用基質膠包被Transwell小室(Corning公司)微孔膜。上室加入用無血清RPMI-1640培養液重懸的轉染48 h的MIA PaCa-2細胞200 μl(含10萬個細胞),下室內加入600 μl含20% FBS的RPMI-1640完全培養液。培養24 h后吸去室內液體,用棉棒擦去微孔膜上室面的細胞,甲醛固定15 min,PBS洗2遍后晾干,5 μg/ml DAPI(上海碧云天公司)染色30 min,PBS洗2遍,熒光顯微鏡下隨機選取3個視野計穿膜細胞數。實驗做3個小室,取均值。
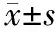
二、結果
1.6株胰腺癌細胞的miR-146b-5p表達:以3例正常胰腺組織miR-146b-5p的表達均值為對照,U6為內參, MIA PaCa-2、BxPC-3、AsPC-1、PANC1、SW1990和PC-3細胞miR-146b-5p表達量均低于正常胰腺組織,其中以MIA PaCa-2細胞表達最低(圖1)。
2.轉染后MIA PaCa-2細胞的miR-146b-5p表達:轉染48 h后,MIA PaCa-2細胞miR-146b-5p表達量較對照組細胞升高306.5倍。
3.細胞增殖變化:轉染 miR-146b-5p的MIA PaCa-2細胞與對照組細胞的生長曲線幾乎一致,差異無統計學意義(P>0.05,圖2)。
4.細胞周期及凋亡率的變化:轉染 miR-146b-5p與對照組MIA PaCa-2細胞的凋亡率和細胞周期差異均無統計學意義(P>0.05,表 1)。
5.細胞遷移和侵襲力的變化:轉染miR-146b-5p組MIA PaCa-2細胞的遷移細胞為(36±4 )個,細胞穿膜數為(35±3)個,均較對照組的(165±10)個及(140±9)個顯著減少(圖3;t=79.00、19.17,P<0.05)。

圖1 正常胰腺組織及6株胰腺癌細胞的miR-146b-5p表達
圖2 轉染組與對照組MIA PaCa-2細胞的生長曲線
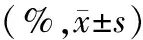
表1 兩組的細胞凋亡率和細胞周期
圖3轉染組(a)與對照組(b)MIA PaCa-2細胞的遷移(上)和穿膜細胞(下)
討論近年來一類長度約為22nt的miRNAs受到了人們的廣泛關注,它是一種廣泛存在的對基因進行微調的分子,約占人類基因組的1%。miRNAs不直接編碼蛋白,其與目的基因結合降解mRNA和(或)抑制其翻譯,對細胞的分化、增殖和凋亡等起著極為重要的調控作用[7]。研究表明,miRNAs和腫瘤的發生、發展密切相關,多個miRNA被證實為癌基因和抑癌基因[8]。
Taganov等[9]研究發現,miR-146通過負反饋調節降低IL-1受體相關激酶1、TNF受體相關因子6蛋白水平而抑制天然免疫反應。Hurst等[10]證實,乳腺癌轉移抑制因子1(BRMS1)上調miR-146,從而抑制乳腺癌細胞轉移。Xia等[11]發現,miR-146b 通過靶向基質金屬蛋白酶抑制神經膠質瘤細胞的遷移和侵襲。之前我們應用miRNAs 芯片技術比較了胰腺癌干細胞(CD24+CD44+ESA+)與非干細胞miRNAs表達譜的差異,發現miR-146b-5p在胰腺癌干細胞中的表達顯著降低。本研究應用qRT-PCR檢測了6株胰腺癌細胞中miR-146b-5p的表達,結果發現,6株胰腺癌細胞miR-146b-5p表達均較正常胰腺組織下調,以MIA PaCa-2細胞的表達最低。
為了明確miR-146b-5p對胰腺癌生物學特性的影響,本研究將miR-146b-5p mimics轉染MIA PaCa-2細胞。結果顯示,轉染miR-146b-5p mimics后,MIA PaCa-2細胞miR-146b-5p表達水平顯著升高,細胞增殖能力、細胞凋亡率、細胞周期無明顯改變,但細胞遷移和侵襲能力明顯降低,表明miR-146b-5p可能對胰腺癌細胞的遷移和侵襲有調控作用。但是miRNAs的作用是協同的,網絡式的,將某一個miRNA挑出來研究可能會孤立地片面的看問題。miR-146b-5p不是胰腺癌中惟一異常表達的小RNA分子,所以應該找出更多異常表達的小RNA分子,發現它們之間的聯系,以便更好地理解胰腺癌的發生機制。
[1] Shabalina SA,Spiridonov NA.The mammalian transcriptome and the function of non-coding DNA sequences.Genome Biol,2004,5:105.
[2] Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell, 1993, 75:843-854.
[3] Lau NC, Lim LP, Weinstein EG, et al. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science, 2001, 294:858-862.
[4] Grishok A, Pasquinelli AE, Conte D, et al. Genes and mechanisms related to RNA interference regulate expression of the small temporal RNAs that control C. elegans developmental timing. Cell, 2001, 106:23-34.
[5] Schwarz DS,Hutvágner G,Du T,et al.Asymmetry in the assembly of the RNAi enzyme complex.Cell,2003,115:199-208.
[6] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 2004, 116:281-297.
[7] Croce CM, Calin GA. miRNAs, cancer, and stem cell division. Cell, 2005, 122:6-7.
[8] DeSano JT, Xu L. MicroRNA regulation of cancer stem cells and therapeutic implications. AAPS J, 2009, 11:682-692.
[9] Taganov KD, Boldin MP, Chang KJ, et al. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proc Natl Acad Sci, 2006,103:12481-12486.
[10] Hurst DR, Edmonds MD, Scott GK, et al. Breast cancer metastasis suppressor 1 up-regulates miR-146, which suppresses breast cancer metastasis. Cancer Res, 2009, 69:1279-1283.
[11] Xia H, Qi Y, Ng SS, et al. microRNA-146b inhibits glioma cell migration and invasion by targeting MMPs. Brain Res, 2009, 1269:158-165.
10.3760/cma.j.issn.1674-1935.2012.02.020
國家自然科學基金(81071775)
430030 武漢,華中科技大學同濟醫學院附屬同濟醫院膽胰外科
秦仁義,Email:ryqin@tjh.tjmu.edu.cn
2011-03-03)
(本文編輯:呂芳萍)

