自身免疫性胰腺炎與小胰腺癌的CT、MRCP征象分析
丁玖樂 邢偉 左長京 俞勝男 邱建國 生晶
·論著·
自身免疫性胰腺炎與小胰腺癌的CT、MRCP征象分析
丁玖樂 邢偉 左長京 俞勝男 邱建國 生晶
目的分析自身免疫性胰腺炎(AIP)與小胰腺癌的CT、MRCP影像學征象的差異,提高對AIP的認識及診斷的準確率。方法回顧性分析符合2008年AIP亞洲診斷標準的24例AIP及病理證實的25例小胰腺癌(≤2 cm)的影像學資料,從胰腺的形態改變、密度及強化方式、胰管及胰周、胰外表現等方面進行比較,采用χ2檢驗或確切概率法行統計學處理。結果在AIP和小胰腺癌組間,腫塊部位、遠端胰腺萎縮、腫塊持續強化、胰管“截斷征”、“鞘膜征”及腎臟受累征象差異具有統計學意義(χ2=9.010、10.506、15.288、8.688、6.292和4.966,P<0.05),但是只有遠端胰腺萎縮和腫塊持續強化征象在局限性AIP與小胰腺癌組間差異具有統計學意義(P<0.05)。結論彌漫性AIP的影像學改變具有特異性,與小胰腺癌容易鑒別診斷,但局灶性AIP與小胰腺癌鑒別診斷價值有限。
自身免疫性胰腺炎; 胰腺腫瘤; 斷層攝影; 體層攝影術,X線計算機; 磁共振成像
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)是由自身免疫介導的一種特殊類型的慢性胰腺炎(CP),組織學上主要表現為顯著的淋巴細胞浸潤、胰腺纖維化伴或不伴功能喪失,影像學改變以胰腺腫大和胰管不規則狹窄為特征。但部分AIP尤其是局灶性AIP與胰腺癌的影像學鑒別診斷有時極其困難[1],常因誤診為胰腺癌而行胰十二指腸聯合切除術,嚴重影響患者的生存質量。據報道,在接受胰十二指腸切除術的良性疾病中,約21%~23%最后診斷為AIP[2]。因此,本研究回顧性分析AIP及小胰腺癌(常徑≤2 cm)的影像學資料,旨在提高對兩者的鑒別診斷。
材料和方法
一、臨床資料
回顧性分析我院2003年1月至2011年6月診斷為CP、長海醫院2006年1月至2011年6月診斷為CP及AIP患者的臨床、病理及影像學資料。其中符合2008年AIP亞洲診斷標準[3]患者24例,男性16例、女性8例,中位年齡59歲。患者均無長期飲酒史。同時回顧性分析我院2008年1月至2011年6月病理診斷為小胰腺癌的25例臨床資料及影像學資料,男性18例、女性7例,中位年齡55歲。
二、影像學檢查
我院使用Siemens Somatom Sensation 16層螺旋CT掃描機。掃描范圍:上起膈頂,下及腎臟下極;掃描參數:重建層厚3.0 mm;增強掃描:團注80~90 ml非離子型對比劑三代顯,流率3.0 ml/s,在平掃后行動脈期(延遲35 s)、實質期(延遲75 s)雙期增強掃描。MRCP成像使用西門子Verio 3.0磁共振,HASTE序列:TR 4500 ms,TE 735 ms,層厚55.0 mm,FOV 300 mm,矩陣 269×384。
長海醫院使用Sensation Cardiac 64排螺旋CT掃描機,腹部平掃后再行胰腺三期增強掃描。采用高壓注射器經肘前靜脈注射碘海醇(300 mg I/ml)90~100 ml,流率為3~4 ml/s,掃描延遲時間自動觸發,動脈期約為23~25 s,胰腺實質期45~50 s,門脈期60~70 s,螺距1.2,重建層厚3 mm。
所有影像資料由兩名具有副主任醫師以上職稱的腹部放射學醫師分別進行分析,閱片者要求作出以下判斷:(1)胰腺實質,如外形(腫大的部位及范圍)、密度及強化方式、胰管改變(擴張、狹窄);(2)胰周包膜;(3)腹部胰外器官異常征象(膽管、腎臟、腹腔或腹膜后淋巴結等)。以上各項判斷指標以2名以上醫師的一致意見作為最終判斷結果。
三、統計學分析
統計學分析采用SPSS13.0統計軟件,組間計數資料采用兩獨立樣本χ2檢驗比較,若總樣本量<40,以確切概率法計算。P<0.05為差異具有統計學意義。
結 果
一、胰腺實質
AIP組中15例(62.5%)胰腺彌漫性腫脹,呈“臘腸狀”改變,外廓平直,失去正常胰腺“羽毛狀”結構,密度均勻,周圍境界尚清晰,增強后持續強化,動脈期及門靜脈期均為相對等密度(圖1a、b);8例(33.3%)胰腺頭部腫脹,胰腺鉤突圓鈍;1例(4.2%)胰腺尾部腫脹,可見稍低密度灶,門靜脈期見病變區密度尚均勻(圖1c)。胰腺癌組中19例腫瘤(76.0%)位于胰頭部,其中11例伴有遠端胰腺實質萎縮,14例(56.0%)見低密度灶,平掃及動脈期呈相對低密度灶(圖2a、b),門靜脈期密度尚均勻(圖2c)。兩組在病灶部位及病灶強化方面差異具有統計學意義(χ2=9.010,P=0.004;χ2=15.288,P=0.000),但局灶性AIP與胰腺癌的病灶部位無統計學意義(88.9%比76.0%,P=0.644),而病灶強化差異具有統計學意義(100%比44%,P=0.047)。
AIP組1例(4.2%)胰腺腫塊遠端實質萎縮,胰腺癌組11例(44.0%)發生萎縮,兩組差異具有統計學意義(χ2=10.506,P=0.002)。局灶性AIP與胰腺癌差異亦具有統計學意義(11.1%比44.1%,P=0.043)。
AIP組23例(95.8%)胰管不同程度狹窄伴擴張(圖1d),胰腺癌組21例(84.0%)胰管不同程度擴張,兩組差異無統計學意義(χ2=5.276,P=0.090);局灶性AIP與胰腺癌差異亦無統計學意義(88.9%比84.0%,P=0.675)。AIP組3例(12.5%)可見“截斷征”,胰腺癌組13例(52.0%)伴有“截斷征”(圖2d),兩組差異具有統計學意義(χ2=8.688,P=0.05),但局灶性AIP與胰腺癌差異無統計學意義(P=0.240)。
AIP組病理示彌漫性淋巴細胞浸潤(圖1e);胰腺癌組病理表現為正常腺體結構消失,被瘤細胞取代(圖2e)。
二、胰腺包膜
AIP組7例(29.2%)在門靜脈期可見胰腺周圍的低密度包膜影(圖1a)。胰腺癌組均未見此征象,兩組差異具有統計學意義(χ2=6.292,P=0.012),但局灶性AIP與胰腺癌差異無統計學意義(25.0%比0,P=0.265)。
三、胰外器官
AIP組17例(70.8%)膽總管及肝內膽管不同程度擴張,膽總管胰腺段明顯均勻狹窄,鄰近十二指腸腸壁未見明顯增厚;胰腺癌組21例(84.0%)膽道梗阻,兩組差異無統計學意義(χ2=3.852,P=0.146),梗阻程度在兩組亦無明顯差異;局灶性AIP與胰腺癌間差異亦無統計學意義(66.7%比84.0%,P=0.077)。AIP組6例(25.0%)伴有多發腎臟稍低密度灶,境界尚可,增強后輕度強化(圖1c);胰腺癌組未見此征象,兩組差異具有統計學意義(χ2=4.966,P=0.026),但局灶性AIP與胰腺癌間差異無統計學意義(11.1%比0,P=0.625)。AIP組1例(4.2%)見膽囊體積增大,膽囊壁增厚,但是均未見腹膜后淋巴結增大;胰腺癌組1例伴有后腹膜淋巴結增大,兩組差異無統計學意義(P=1.000)。
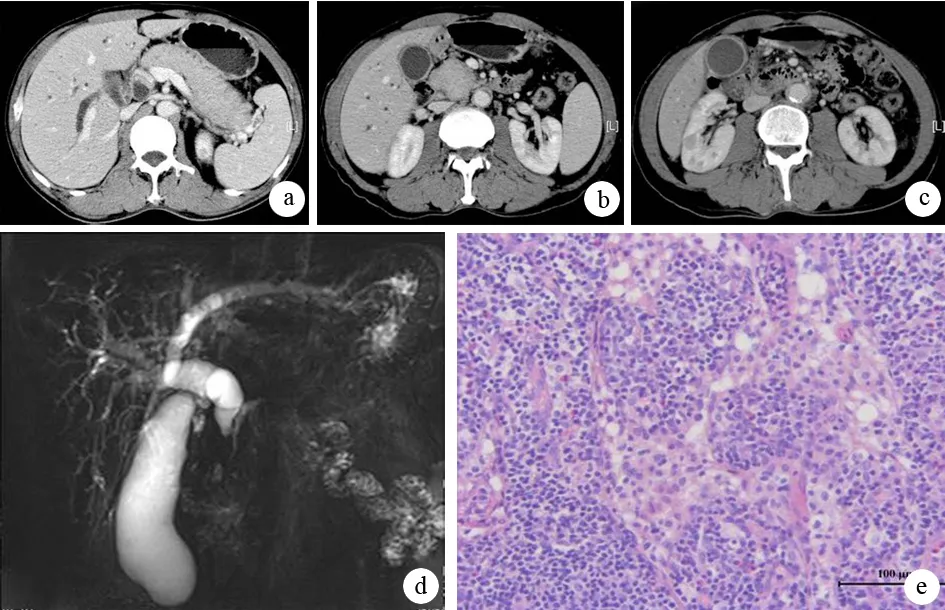
圖1 AIP的CT、MRCP征象及病理改變(HE ×200)
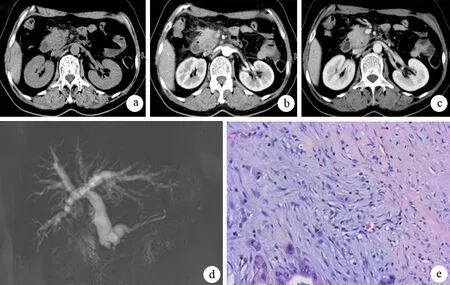
圖2 小胰腺癌的CT、MRCP征象及病理改變(HE ×200)
AIP的確切發病機制尚不清楚。AIP臨床癥狀也無特異性,常因腹部不適、腹痛及黃疸等就診。據報道,46%~74%的患者因肝外膽管狹窄而出現黃疸[4];19%~44%患者主訴腹痛,多為隱痛[4]。但87%的胰腺癌患者也以黃疸就診,兩種疾病的臨床表現相似,所以影像學鑒別診斷對兩種患者的治療方案制定至關重要。
2008年AIP亞洲診斷標準提到了2條必備的影像學改變:(1)胰腺實質影像學:腺體彌漫性或局限性或局灶性增大。有時伴有包塊和(或)低密度邊緣。(2)胰膽管影像學:彌漫性或局限性或局灶性胰管狹窄,常伴有膽管狹窄。由此可見影像學對AIP診斷的重要性。
AlP的形態學改變分為彌漫性和局灶性,Horiuchi等[5]認為,這只是AIP不同階段的表現,前者由后者發展而來。在亞洲人群以局限性為主,約占72%[4],但本組病例中的比例是37.5%,可能與病例數較少及地區差異有關。
彌漫性AIP的影像學改變具有一定的特征性,無論是形態學、胰腺實質密度、強化特點、胰管“截斷征”,還是包膜及胰外表現均與胰腺癌的鑒別診斷相對容易。但局灶性AIP極易誤診為胰頭癌。本組5例均因誤診為胰腺癌行胰十二指腸切除術。但局限性AIP仍具有彌漫性AIP的強化特點,這是因為正常的胰腺組織不同程度地被淋巴細胞及纖維化組織替代,同時發生閉塞性靜脈炎,因此病變區在動脈期的強化程度減弱,可以均勻或不均勻,但在門靜脈期可呈相對稍高密度,或出現較明顯的延時強化,與正常胰腺組織的密度一致[6]。而胰腺癌多見腫塊內低密度灶,增強后強化不明顯,所以增強后是否強化對AIP組與胰腺癌的鑒別診斷有重要價值。當然,不典型的胰腺癌的腫塊強化可以與正常胰腺實質一致[7],此時需要借鑒其他征象,如胰腺腫塊遠段的胰腺萎縮更有助于胰腺癌的診斷[8]。
胰管擴張是胰腺癌常見的征象,也是AIP常見的影像學改變。梗阻程度在兩組間的鑒別診斷價值有限,但是胰管的“截斷征”可以一定程度地反映出胰腺占位的性質。AIP是一種特殊類型慢性炎癥,其累及胰管的范圍常比較廣,呈鳥嘴樣狹窄或在腫塊中穿行;但胰腺癌的梗阻點常使胰管驟然變窄。MRCP在顯示胰管整體形態擴張的程度更加直觀、準確,對胰腺病變的鑒別診斷更有意義。
膽總管狹窄是AIP最常見的胰外影像學改變,約60%~81% AIP患者的膽總管受累[4],稱“IgG4相關性硬化性膽管炎”。淋巴細胞浸潤及管壁纖維化是致胰腺段膽總管的管腔受壓狹窄的病理基礎。CT表現為膽總管下段呈陡然向心性狹窄,狹窄區細長,邊緣光整,增強后未見明顯膽總管壁的異常強化。但胰腺癌,尤其是胰頭癌患者的膽總管擴張更加多見。
29.2%的AIP患者胰周脂肪間隙變小,胰腺周邊呈低密度囊狀緣,類似一個包膜,也稱“鞘膜”征。組織學上表現為胰腺周圍的淋巴細胞浸潤和纖維化。據報道[9],“鞘膜”是AIP相對特征性的影像學特征,其發生率約46%,但局灶性AIP的發生率明顯低于彌漫性AIP,僅11.1%,因而與胰腺癌的鑒別診斷很有限。然而鞘膜的顯示率與檢查的方法有關,楊正漢等[10]報道,磁共振增強檢查發現“鞘膜征”的敏感性明顯高于CT檢查。
AIP同時常見胰外受侵器官,包括腎臟、肺及胃腸道等。腎臟的影像學改變常表現為雙腎實質外圍多發的小結節,境界清晰,可以為類圓形、楔形或斑狀,其病理基礎為淋巴細胞、漿細胞浸潤[8]。但也可以無影像學改變,卻有輕中度腎功能不全,其病理基礎為腎小管間質性腎炎[11]。肺部受侵時表現為間質性炎、局限性或彌散性結節(即炎性假瘤[11])。此外,發生于胰頭部的AIP患者中,約80%有十二指腸乳頭肥大,活檢可發現有大量的炎性細胞和IgG4染色陽性漿細胞浸潤,更具特征性的是經激素治療后乳頭肥大可恢復正常[12]。但本組病例沒有發現十二指腸乳頭部的CT影像改變,可能與CT診斷的敏感性低有關。胰腺癌常經血行或淋巴道轉移至肺,與AIP累及肺部的影像學改變可以相似,所以對其的鑒別診斷價值有待進一步研究。
大部分AIP對激素的治療反應敏感。在激素治療有效的情況下,不僅胰腺本身的病變獲得顯著改善,膽管梗阻解除、黃疸減輕,血清檢查自身抗體和IgG4水平明顯下降,胰腺外受累及的臟器也會明顯好轉。如果對激素治療無效,則應高度懷疑胰腺癌的可能。
[1] 尹秀玲,邱士軍,張雪林.胰頭部腫塊型慢性胰腺炎與胰頭癌的CT分析與鑒別.臨床放射學雜志,2008,27:198-200.
[2] Abraham SC, Wilentz RE, Yeo CJ, et al. Pancreaticoduo-denectomy (Whipple resections) in patients without malignancy: are they all ‘chronic pancreatitis’? Am J Surg Pathol, 2003,27: 110-120.
[3] 呂紅,錢家鳴.自身免疫性胰腺炎不同診斷標準的探討.胃腸病學,2009,14: 4-7.
[4] Kamisawa T, Kim MH, Liao WC, et al. Clinical characteristics of 327 Asian patients with autoimmune pancreatitis based on Asian diagnostic criteria. Pancreas, 2011,40:200-205.
[5] Horiuchi A, Kawa S, Hamano H, et al. ERCP features in 27 patients with autoimmune pancreatitis. Gastrointest Endosc, 2002,55:494-499.
[6] Chang WI, Kim BJ, Lee JK, et al. The clinical and radiological characteristics of focal mass-forming autoimmune pancreatitis: comparison with chronic pancreatitis and pancreatic cancer. Pancreas, 2009, 38:401-408.
[7] 馬天順, 盧明智, 邵成偉, 等. 胰腺癌的不典型64排螺旋CT影像表現. 中華胰腺病雜志, 2010,10:174-176.
[8] Shanbhogue AK, Fasih N, Surabhi VR, et al. A clinical and radiologic review of uncommon types and causes of pancreatitis. Radiographics, 2009, 29:1003-1026.
[9] Manfredi R, Graziani R, Cicero C, et al. Autoimmune pancreatitis: CT patterns and their changes after steroid treatment. Radiology, 2008, 247:435-443.
[10] 楊正漢,張駿,何淑蓉,等.自身免疫性胰腺炎的影像特征.中華放射學雜志, 2007,41:47-50.
[11] Zhang L, Smyrk TC. Autoimmune pancreatitis and IgG4-related systemic diseases. Int J Clin Exp Pathol, 2010, 3:491-504.
[12] Law R,Bronner M,Vogt D,et al.Autoimmune pancreatitis:a mimic of pancreatic cancer.Cleve Clin J Med,2009,76:607-615.
CTandMRCPfindingsofautoimmunepancreatitisandsmallpancreaticcarcinoma
DINGJiu-le,XINGWei,ZUOChang-jing,YUSheng-nan,QIUJian-guo,SHENGJing.
AffiliatedThirdHospitalofSoochowUniversity,Changzhou213003,China
XINGWei,Email:suzhxingwei@126.com
ObjectiveTo increase the awareness of autoimmune pancreatitis (AIP) and correct diagnosis rate of AIP by investigating radiologic characteristic of AIP and small pancreatic cancers.MethodsThe clinical data and radiologic imaging of 24 AIP patients who met the Asia diagnostic criteria of AIP in 2008 and 25 cases of pathologically confirmed small pancreatic cancer were retrospectively reviewed. All imaging findings were reviewed, especially on the shape, enhancement patterns of mass, pancreatic ducts, peri-pancreatic and extra-pancreatic manifestations. Chi-square test and Fisher test were used for statistical analysis.ResultsThe imaging signs, including location of masses, distal pancreatic atrophy, enhancing mass during portal phase, truncated duct sign of pancreatic duct, capsule-like rim and renal involvement, was significantly different between AIP and small pancreatic cancer (χ2=9.010, 10.506, 15.488, 8.688, 6.292 and 4.966 respectively,P<0.05). But only two signs, distal pancreatic atrophy and enhancing mass during arterial and portal phase, were statistically different between local AIP and small pancreatic cancer (P<0.05).ConclusionsThe typical imaging features of diffuse AIP is distinct and helpful for the differential diagnosis of AIP from small pancreatic carcinoma, but there is limited value in the differential diagnosis between local AIP and small pancreatic cancer.
Autoimmune pancreatitis; Pancreatic neoplasm; Tomography; Tomography, X-ray computed; Magnetic resonance imaging
10.3760/cma.j.issn.1674-1935.2012.02.002
213003 常州,蘇州大學附屬第三醫院放射科(丁玖樂、邢偉、俞勝男、邱建國);第二軍醫大學長海醫院核醫學科(左長京),放射科(生晶)
邢偉,Email:suzhxingwei@126.com
2011-08-24)
(本文編輯:呂芳萍)

