信號轉導和轉錄激活子1的活化抑制蛋白對急性胰腺炎的預后判斷
陳平 趙德壽 孫蘊偉 姚瑋艷 章永平 袁耀宗
·論著·
信號轉導和轉錄激活子1的活化抑制蛋白對急性胰腺炎的預后判斷
陳平 趙德壽 孫蘊偉 姚瑋艷 章永平 袁耀宗
目的檢測信號轉導和轉錄激活子1的活化抑制蛋白(PIAS1)在急性胰腺炎(AP)大鼠胰腺中的表達,探討其對AP病情的評估價值。方法SD大鼠按隨機分配表法分為對照組、急性水腫性胰腺炎(AEP)組、急性壞死性胰腺炎(ANP)組,各15只。術后0.5、6、16、24、48、72 h分批處死大鼠,取血清檢測C反應蛋白(CRP)、淀粉酶水平,測胰腺組織含水量,行胰腺常規病理檢查并評分,采用蛋白質印跡法和免疫組化法檢測胰腺組織PIASI表達。記錄大鼠72 h生存情況,行Cox多因素風險評估。結果ANP組16 h時的胰腺病理評分、胰腺含水量、血清CRP和淀粉酶水平分別為(7.70±2.55)分、(2.91±0.57)%、(0.36±0.05)mg/L、(3141±625)U/L,均顯著高于AEP組的(2.60±1.04)分、(2.04±0.47)%、(0.24±0.05)mg/L、(1984± 637)U/L,亦顯著高于對照組的(0.80±0.42)分、(1.21±0.27)%、(0.14±0.03)mg/L、(978±353) U/L(P值<0.05或<0.01)。ANP組大鼠平均生存時間為(26.4±3.4) h,較AEP組的(57.3±4.2)h和對照組的(71.3±0.5) h顯著縮短(P值均<0.01)。ANP組16 h時的胰腺組織PIAS1蛋白表達較AEP組及對照組顯著下調(0.10±0.01比0.80±0.07和0.87±0.05,P<0.01)。Cox分析顯示PIAS1為影響AP大鼠生存時間的獨立因素之一。結論PIAS1在ANP中低表達,與AP病情嚴重度呈負相關,可以成為預測病情嚴重程度及預后的指標。
胰腺炎; PIAS1; 預后; 大鼠
急性胰腺炎(acute pancreatitis, AP)根據病情的輕重,臨床上分為輕癥(mild acute pancreatitis, MAP)和重癥(sever acute pancreatitis, SAP)兩型。適時地判斷病情對疾病的治療方式選擇具有關鍵作用。基于促炎癥介質在AP的進展中發揮重要的介導作用[1],研究促炎癥介質活化環節中樞的信號轉導通路已成為目前研究的熱點之一。我們既往的研究[2]發現,Janus激酶1(janus kinase,JAK1)/STAT1、3信號轉導途徑早期即參與AP促炎癥介質聚集、放大及最終失控的病理過程。通過調控或關閉JAK1/STAT1信號轉導途徑可控制AP時的“瀑布”式炎癥反應。基于此,本研究進一步檢測JAK1/STAT1信號轉導途徑負性調控因子——信號轉導和轉錄激活子1(signal transducer and activator of transcription 1, STAT1)的活化抑制蛋白(protein inhibitor of activated STAT-1,PIAS1)在AP大鼠胰腺組織的表達,探討其評估AP病情的價值。
材料和方法
一、實驗動物及分組
Sprague Dawley大鼠由上海交通大學醫學院附屬瑞金醫院動物實驗室提供。按隨機分配表法分為急性壞死性胰腺炎(ANP)組、急性水腫性胰腺炎(AEP)組和對照組,各15只。參照Mizunuma等[3]分3次腹腔內注射20% L-精氨酸溶液1000 mg/kg體重、間隔1 h的方法構建AEP模型,參照張明鈞等[4]的方法構建ANP模型,對照組僅行開、關腹手術。術后0.5、6、16、24、48、72 h分批處死大鼠,收集血清及胰腺組織。同時各組均制備相同數目的大鼠,觀察生存情況,以72 h為截尾時點,歸為完整數據。
二、觀察指標及方法
1.胰腺組織病理學檢查:取部分胰腺組織置4%多聚甲醛溶液固定48 h,送上海交通大學醫學院病理教研室行病理檢查。采用Grewal等[5]標準進行評分。
2.胰腺組織含水量測定:取部分胰腺組織剔去脂肪,稱濕重,然后置72℃烘烤24 h,稱干重,胰腺組織濕/干重系數=(濕重-干重)/干重×100%,表示胰腺組織的含水量。
3.血清C反應蛋白(CRP)和淀粉酶水平檢測:血清送上海交通大學醫學院附屬瑞金醫院檢驗科通過Beckman X7全自動生化分析儀測定。
4.胰腺組織PIAS1蛋白表達檢測:采用RIPA分裂液(上海申能博彩公司)抽提胰腺組織總蛋白,采用BCA法(Pierce公司)定量蛋白。取20 μg樣品常規行蛋白質印跡法檢測PIAS1蛋白。抗PIAS1一抗(Santa cruz公司)工作濃度1∶200,辣根過氧化物酶標記的二抗(上海康成公司)工作濃度1∶5000,最后應用ECL-plus試劑盒(Amersham Biosciences公司)發光,壓片后沖洗顯影。采用Bio-Rad公司數碼成像系統對圖片進行掃描,Quantity One軟件灰度分析,以GAPDH作為內參照。
另取胰腺組織常規固定、石蠟包埋、切片,行免疫組化染色檢測PIAS1蛋白表達。以磷酸鹽緩沖溶液代替一抗作陰性對照。由病理科醫師盲法讀片,取5個高倍鏡視野,各計數100個細胞,以胞質中出現棕黃色顆粒為陽性表達細胞,計算陽性表達細胞占總細胞數的百分比,<10%為-,10%~29%+,30%~49%++, 50%~69%+++,>70%++++。
三、統計學處理
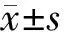
結 果
一、胰腺病理組織學改變
對照組大鼠胰腺組織未見明顯病理改變;AEP組大鼠小葉間明顯充血水腫,中性粒細胞浸潤增多,出現少量壞死;ANP組大鼠見胰腺間質腫脹,炎細胞浸潤,微血管壁結構破壞,紅細胞滲出,腺泡細胞和脂肪壞死(圖1)。對照組、AEP組、ANP組16 h點大鼠胰腺組織病理評分分別為(0.80±0.42)、(2.60±1.04)、(7.70±2.55)分,AEP組顯著高于對照組,ANP組又顯著高于AEP組(t值分別為-3.86、5.14,P<0.05)。

圖1對照組(a)、AEP組(b)、ANP組(c)大鼠胰腺的病理改變( ×200)
二、胰腺組織濕/干重系數變化
對照組、AEP組、ANP組16 h點大鼠濕/干重系數分別為(1.21±0.27)%、(2.04±0.47)%、(2.91±0.57)%, AEP組顯著高于對照組,ANP組又顯著高于AEP組(t值分別為4.74、3.69,P<0.05)。
三、血清淀粉酶及CRP水平變化
對照組、AEP組、ANP組大鼠的血清淀粉酶水平分別為(978±353)、(1984± 637)、(3141± 625)U/L;CRP水平分別為(0.14±0.03)、(0.24±0.05)、(0.36±0.05)mg/L。AEP組顯著高于對照組,ANP組又顯著高于AEP組(t值分別為4.36、4.09、4.62、5.26,P<0.01)。
四、胰腺組織PIAS1蛋白表達的變化
各組大鼠胰腺組織PIAS1的表達見圖2、圖3及表1、表2。ANP組大鼠胰腺組織的PIASI表達明顯下降,以16 h時的變化最明顯。胰腺組織PIAS1蛋白表達與病情嚴重程度之間呈負相關(r=-0.675,P<0.01)。
五、生存率及多因素分析
ANP組大鼠平均生存時間為(26.4±3.4)h,95%可信區間為19.67~33.06;AEP組大鼠平均生存時間為(57.3±4.2)h, 95%可信區間為49.11~65.42;對照組大鼠平均生存時間為(71.3±0.5)h,95%可信區間為70.26~71.40。3組生存率的差異具有統計學意義 (χ2=70.26,P<0.01,圖4)。

圖2 各組大鼠胰腺組織PIAS1蛋白表達

圖3對照組(a)、AEP組(b)、ANP組(c)PIASI蛋白表達(免疫組化×200)
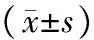
表1 各組大鼠胰腺組織PIAS1蛋白的表達量
注:與對照組比較,t=24.00,aP<0.05;與AEP組比較,t=16.78,bP<0.01

表2 各組大鼠胰腺組織PIAS1蛋白表達
Cox比例風險回歸模型多因素分析結果顯示,血清淀粉酶水平(β=0.001,P=0.003)、PIAS1蛋白表達水平(β=-0.822,P=0.019)為影響AP預后的獨立因素,而血清CRP水平不影響AP預后(β=-2.076,P= 0.619)。

圖4 各組大鼠72 h生存率
討 論
PIAS1作為PIAS家族成員之一和一類小泛素修飾物連接酶E3家族成員之一,位于大鼠8號染色體長臂24區,基因全長1956 bp,蛋白分子質量為71 000,結構序列包括SAP結構域、RLD鋅指結構域、酸性結構域和絲氨酸/蘇氨酸結構域等保守結構域。目前研究發現,PIAS1可與缺氧、炎癥和張力負荷所激活的STAT1相互作用而特異性抑制STAT1下游基因的轉錄[6]。PIAS1基因敲除小鼠的STAT1介導的部分下游基因轉錄增加,從而對脂多糖引起的內毒素性休克敏感,血清中促炎癥介質水平增高,發育遲緩,圍產期死亡增加,因此認為PIAS1敲除小鼠對脂多糖誘導的膿毒血癥具有超敏性[7]。此外,Liu等[8]發現在TNF-α或脂多糖刺激下,PIAS1的Ser90磷酸化,通過SUMO化作用于IκB激酶,發揮
NF-κB活性,減輕炎癥反應。我們前期使用腺病毒肺泡內炎性細胞的數目,減輕疾病的病情[9]。
Ad5/F35-PIAS1質粒尾靜脈注射預處理ANP大鼠,結果明顯上調肺組織PIAS1蛋白表達,下調肺組織STAT1、MMP-9和細胞間黏附分子1蛋白表達,減少本研究結果顯示,ANP大鼠胰腺組織PIAS1蛋白的表達較AEP、對照組大鼠明顯下調,PIAS1的表達與AP病情嚴重程度呈負相關,且PIAS1表達水平是影響AP大鼠生存時間的獨立因素,因此可以作為判斷AP病情及預后的潛在指標。
[1] Bhatia M. Acute pancreatitis as a model of SIRS. Front Biosci, 2009, 14:2042-2050.
[2] 陳平, 姚瑋艷, 章永平, 等. 雨蛙素誘導的急性胰腺炎體外細胞模型的信號轉導通路研究.中華胰腺病雜志, 2010,10: 272-275.
[3] Mizunuma T, Kawamura S, Kishino Y. Effects of injecting excess arginine on rat pancreas. J Nutr, 1984, 114: 467-471.
[4] 張明鈞,姚瑋艷,喬敏敏, 等. 腸壁穿刺逆行胰膽管注射牛黃膽酸鈉重癥急性胰腺炎造模. 上海交通大學學報(醫學版), 2006, 26: 488-490.
[5] Grewal HP, Mohey el Din A, Gaber L, et al. Ameliomoration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-α polyclonal antibody. Am J Surg, 1994, 167: 214-218.
[6] Liu B, Shuai K. Targeting the PIAS1 SUMO ligase pathway to control inflammation. Trends Pharmacol Sci, 2008, 29: 505-509.
[7] Liu B, Mink S, Wong KA, et al. PIAS1 selectively inhibits interferon-inducible genes and is important in innate immunity. Nat Immunol, 2004, 5: 891-898.
[8] Liu B, Yang R, Wong KA, et al. Negative regulation of NF-kappaB signaling by PIAS1. Mol Cell Biol, 2005, 25: 1113-1123.
[9] Chen P, Huang L, Sun Y, et al.Up-regulation of PIAS1 protects against sodium taurocholate-induced severe acute pancreatitis associated with acute lung injury. Cytokine, 2011, 54: 305-314.
SeverityandprognosticpredictionofproteininhibitorofactivatedSTAT1onacutepancreatitis
CHENPing,ZHAODe-shou,SUNYun-wei,YAOWei-yan,ZHANGYong-ping,YUANYao-zong.
DepartmentofGastroenterology,RuijinHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200025,China
Correspondingauthor:YUANYao-zong,Email:yyz28@medmail.com.cn
ObjectiveTo investigate the expression of protein inhibitor of activated STAT-1 (PIAS1) in rat with acute pancreatitis (AP) and study its prediction value for severity and prognosis.MethodsSD rats were randomly divided into control, acute edematous pancreatitis (AEP), and acute necrotizing pancreatitis (ANP) groups with 15 rats in each group. The rats were sacrificed at 0.5, 6, 16, 24, 48, 72 h post-operatively. Serum CRP and amylase levels were determined. Water content of pancreas was measured. The pancreatic tissue was routinely harvested and underwent pathologic examination and was scored. The PIAS1 protein expression was measured by Western blot and immunohistochemistry method. The survival rates at 72h were recorded and the risk analysis of multiple factors was investigated by Cox regression method.ResultsThe pathologic score, water content of pancreas, serum CRP and amylase levels at 16h in ANP group were (7.70±2.55), (2.91±0.57)%, (0.36±0.05)mg/L, (3141±625)U/L, which were significantly higher than those in AEP group [(2.60±1.04), (2.04±0.47)%, (0.24±0.05)mg/L, (1984± 637)U/L)], and also significantly higher than those in control group [(0.80±0.42), (1.21±0.27)%, (0.14±0.03)mg/L,(978±353)U/L, (P<0.05or0.01)]. The survival time of ANP rats was [(26.36±3.41) h, 95%CI:19.67~33.06 h], which were significantly shorter than that in AEP group [(57.26±4.16)h, 95%CI:49.11~65.42)], and also significantly shorter than that in control group [(71.33±0.54) h,95%CI:70.26~71.40,P<0.01]. The expression of PIAS1 at 16h in ANP group was significantly lower than those in AEP group and control group (0.10±0.01vs.0.80±0.07, 0.87±0.05,P<0.01). The Cox analysis suggested that PIAS1 was an independent prognosis factor for the survival time of AP rats.ConclusionsPIAS1 is lowly to moderately expressed in ANP, and is negatively correlated with AP severity, and may be an independent risk factor for the prediction of severity and prognosis of AP.
Pancreatitis; Protein inhibitor of activated STAT-1; Prognosis; Rat
10.3760/cma.j.issn.1674-1935.2012.04.010
200025 上海,上海交通大學醫學院附屬瑞金醫院消化內科(陳平、孫蘊偉、姚瑋艷、章永平、袁耀宗);蘭州大學第二醫院檢驗科(趙德壽)
袁耀宗,Email: yyz28@medmail.com.cn
2012-04-10)
(本文編輯:呂芳萍)

