糖基化終產物對人牙周膜細胞增殖和NF-κB mRNA表達的影響
房 明,汪 濤,王 欣,王新文,王勤濤
(第四軍醫大學口腔醫學院,陜西西安 710032)
牙周炎和糖尿病(Diabetes mellitus,DM)都是人類最常見的慢性疾病。許多研究證明牙周病與糖尿病之間有相互聯系,并且已經將牙周病列為糖尿病的第六大并發癥[1-2]。糖基化終產物(Advanced glycation end products,AGEs)是體內持續高血糖刺激下形成的非酶氧化的不可逆蛋白之一,與糖尿病的多種并發癥均有密切關系[3],當AGEs與人牙周膜成纖維細胞表面的特異性受體(Receptor of advanced glyation end products,RAGE)結合后可刺激細胞分泌炎癥因子,加速細胞的凋亡過程等,繼而對牙周組織的損傷和修復造成影響。NF-κB是一種重要的轉錄因子,參與諸多免疫調節作用,例如細胞凋亡、腫瘤壞死等[4]。有研究指出[5],AGEs能抑制人牙齦成纖維細胞的增殖,并可促進基質金屬蛋白酶-1的合成,導致膠原降解,加劇糖尿病病人牙周炎的進程。
本研究通過觀察糖基化終產物對人牙周膜細胞增殖及NF-κB表達的影響,以期進一步探討糖尿病伴慢性牙周炎的發病機制,并為臨床治療提供一定的理論依據。
1 材料和方法
1.1 主要試劑和儀器
DMEM培養基(HyClone,美國);胰蛋白酶、胎牛血清(杭州四季青生物工程有限公司);I型膠原酶(Gibco,美國);人血清白蛋白(Sigma,美國);流式細胞分析儀(Beckman Coulter,美國);Power/PAC 300 電泳儀(Bio-RAD,美國);7500 Real Time PCR System(Applied Biosystems,美國);細胞總RNA提取試劑盒 TRIZOL Reagent(Invitrogen,美國);SYBY Premix Ex TaqTM(Perfect Real Time)、TaKaRa PrimeScriptTMRT Reagent Kit(寶生物工程有限公司);SW-CJ-2D型超凈工作臺(蘇州凈化設備公司);XDS-1B型倒置相差顯微鏡(重慶光電設備廠);CO2孵箱(Shellab,美國)。
1.2 方法
1.2.1 牙周膜細胞原代培養
選取18~21歲志愿者因正畸減數而拔除的前磨牙,用含慶大霉素的PBS浸泡3~5 min后,普通PBS漂洗3遍,在無菌條件下銳性刮取牙根中部1/3的牙周膜組織,剪成約1 mm×1 mm×1 mm大小的組織塊后平鋪于培養皿內,加入3 mg/mL I型膠原酶消化45 min(37℃,50 mL/L CO2),輕輕吹打,制成單細胞懸液進行離心(800 r/min,5 min),棄上清液。將細胞沉淀含100 mL/L胎牛血清的DMEM培養基重懸,再次離心(800 r/min,5 min),棄上清液,將細胞沉淀平鋪于6孔板內,以無菌蓋玻片覆蓋組織塊,加入1.5 mL含100 mL/L胎牛血清、200 U/mL慶大霉素、100 U/mL青霉素的DMEM培養液,置37℃,50 mL/L CO2條件下進行培養。每3 d換液1次,待細胞生長匯合達80%時進行傳代。
1.2.2 AGEs體外制備
根據文獻[7]方法,分別取 0.5 g人血清白蛋白、3.0 g D -葡萄糖、1000 μg青霉素和500 μg慶大霉素加于10 mL濃度為0.5 mol/L的PBS(pH=7.4)中,避光 37 ℃孵育120 d。用 PBS(pH=7.4)充分透析以除去未結合的葡萄糖后,經熒光分光光度計掃描鑒定,其AGEs質量濃度為26.61 mg/mL。
1.2.3 AGEs對hPDLFs NF-κB mRNA 表達的影響
1.2.3.1 實驗分組及處理
取生長狀態良好的第5代牙周膜細胞,以3×105/mL密度接種于 25 cm2培養瓶,置 37℃,50 mL/L CO2條件下培養,待細胞生長匯合達80%時,棄原液,并隨機分為陰性對照組(L組)、高糖組(H組)和 AGEs組(A組)。L組加入含5.5 mmol/L葡萄糖的DMEM培養基;H組加入含25 mmol/L葡萄糖的DMEM培養基;A組加入含5.5 mmol/L葡萄糖,AGEs 終末濃度為 100 μg/mL的DMEM培養基,繼續培養。
1.2.3.2 Real Time PCR 檢測 NF-κB mRNA 表達
分別于培養后12、24、36 h取各組細胞,采用TRIZOL Reagent一步法提取總RNA,紫外分光光度計定量后,按照反轉錄試劑盒說明書,反轉錄cDNA。以GAPDH為內參照,同時參照GenBank數據庫,采用Primer primer 5.0計算機軟件設計引物,并由Takara公司合成,基因序列見表1。反應條件參考產品說明,進行熒光實時定量PCR檢測,用ABI 7500 real time system SDS軟件分析結果。

表1 引物設計基因序列
1.2.4 AGEs對 hPDLFs增殖能力的影響
同1.2.3.1 分組處理后繼續培養 36 h 后,胰酶消化后棄上清,加入2 mL 7000 mL/L無水乙醇和1 mL PBS吹打混勻后,于4℃固定細胞24 h,用流式細胞儀檢測細胞各周期的DNA含量,計算各組細胞在G1、S、G2期的比例,以%S+%G2反映細胞的增殖能力。
1.3 統計學分析
2 結果
2.1 AGEs對 hPDLFs NF-κB mRNA 表達的影響
各組各時間點NF-κB mRNA表達量均以陰性對照組(L組)最低,AGEs(A組)組最高,各組間兩兩相比,在12、24、36 h時H組、A組均明顯高于L組(P<0.05);A組與H組相比,12 h時無統計學差異(P>0.05),24 h和36 h時差異均有統計學意義(P <0.05);各組組內各時間點 NF-κB mRNA表達量相比L組無統計學差異(P>0.05);H組36 h時明顯高于12 h和24 h(P<0.05);A組各時間點之間差異均有統計學意義(P<0.05),即NF-κB mRNA表達隨AGEs作用時間延長而增加,具有時間依賴性(表2)。
表2 各組不同時間點NF-κB mRNA的表達()

表2 各組不同時間點NF-κB mRNA的表達()
不同字母同組不同時間點相比,P<0.05;★同一時間點內與陰性對照組相比P<0.05;▲同一時間點內與H組相比P<0.05
時間(h)L H A 12 0.996 ±0.009 1.104 ±0.059a★ 1.122 ±0.002a★24 0.977 ±0.058 1.086 ±0.051a★ 1.356 ±0.003b★▲36 0.946 ±0.160 1.811 ±0.006b★ 2.352 ±0.125c★▲
2.2 AGEs對hPDLFs增殖能力的影響
流式細胞儀檢測結果如(圖1),經計算各組%S+%G2以A組最低,與H組、L組相比,差異均有統計學意義(P<0.05),H組與L組相比無統計學差異(P >0.05)(表3)。
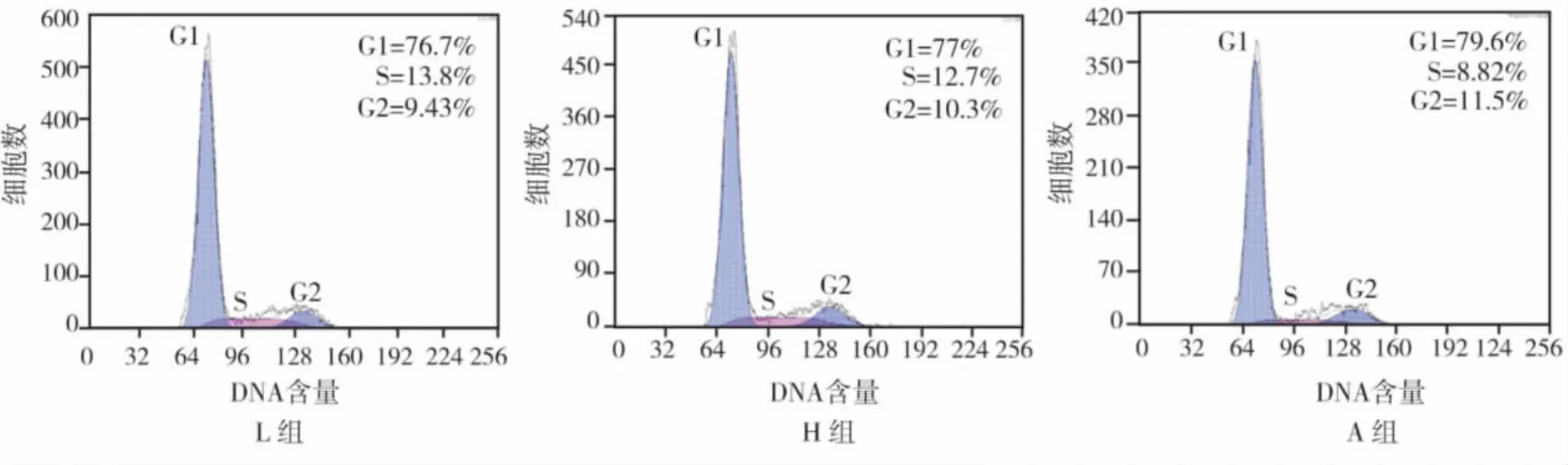
圖1 各組流式細胞儀檢測結果
表3 3組細胞增殖能力的比較()

表3 3組細胞增殖能力的比較()
不同字母組間P<0.05
分組%S+%G2 L 組 23.74 ±0.51a H 組 23.71 ±0.56a A 組 19.57 ±0.74b
3 討論
糖基化終產物(AGEs)是一種非酶糖基化的大分子蛋白質,一旦形成便不可逆,在正常人體內可隨年齡的增長而緩慢增加,但是在長期高血糖的刺激下會導致其形成加速,大量積聚[7]。關于AGEs對糖尿病病人持續高血糖狀態下的牙周組織特別是牙周膜細胞的影響機制和方式,目前尚無定論。Murillo等[8]發現,AGEs可降低人牙齦成纖維細胞(hGF)和人牙周膜成纖維細胞(hPDLF)的遷移率和附著率。Hyun Sook Kim等[9]發現單純高糖培養環境對人牙周膜細胞增殖有一定的抑制作用。
NF-κB是一類具有多向轉錄調節作用的核蛋白因子,廣泛存在于多種組織細胞中,激活后參與許多基因的轉錄調控,在免疫、炎癥、氧化應激、細胞增殖、細胞凋亡等生理病理過程中發揮作用。近年的研究表明,NF-κB與細胞凋亡的關系密切,其參與多種凋亡相關基因的轉錄調控,具有抑制細胞凋亡及促細胞凋亡的雙向作用[10]。AGEs與其受體RAGE結合后促使NF-κB活化,延長壓制內源性自動調整的反饋抑制循環的時間[11]。Maczurek等[12]研究發現,AGEs與RAGE相互作用后,可通過激活細胞內信號轉導通路誘發氧化應激并激,活核因子NF-κB而上調多種細胞因子的生成(如 TNF-α,IL-1β,IFN-γ),參與組織損傷。
本研究通過Real Time PCR技術檢測AGEs刺激不同時間下hPDLFs表達NF-κB的影響,并使用流式細胞儀檢測了相應細胞的增殖情況,結果顯示:AGEs對牙周膜細胞NF-κB mRNA的表達有明顯加強作用,并且對牙周膜細胞的增殖有明顯抑制作用。這一結果與上述研究結果一致。雖然高糖組對牙周膜細胞的凋亡和增殖有一定的影響,但其作用不如AGEs明顯,提示在糖尿病病人的牙周病變中,AGEs對牙周組織的破壞可能起到了更重要的作用。汪濤等[13]發現牙周基礎治療后患有糖尿病伴慢性牙周炎病人的PD、AL、空腹血糖水平均有明顯改善,但是對AGEs水平控制并不理想。因此,在臨床治療糖尿病伴慢性牙周炎的過程中,積極控制病人血糖的同時,如能有效地阻斷AGEs與其受體RAGE的聯合效應,可能會達到更佳的治療糖尿病伴慢性牙周炎的效果。
[1]Sandberg GE,Sundberg HE,Fjellstrom CA,et al.Type 2 diabetes and oral health-a comparison between diabetic and non diabetic subjects[J].Diab Res and Clin Pract,2000,50(1):27-34.
[2]Taylor GW.Bidirectional interrelationships between diabetes and periodontal diseases:an epidemiologic perspective[J].Ann Periodontol,2001,6(1):99 - 112.
[3]Bierhaus A,Humpert PM,Morcos M,et al Understanding RAGE,the receptor for advanced glycation end products[J].Mol Med,2005,83(11):876-886.
[4]Xing L,Bushnell TP,Carlson L,et al.NF-κB p50 and p52expression is not required for RANK-expressing osteoclast progenitor formation but is essential for RANK-and cytokine-mediated osteoclastogenesis[J].J Bone Miner Res,2002,17(7):1200-1210.
[5]鄧雨泉,付云,齊劉英,等.糖基化終產物對人牙齦成纖維細胞增殖和基質金屬蛋白酶-1合成的影響[J].中華口腔醫學研究雜志(電子版),2009,3(3):250 -254.
[6]Gopalkrishnapillai B,Nadanathangam V,Karmakar N,et al.E-valuation of autofiuorescent property of hemoglobin-advanced glycation end product as a long-term glycemic index of diabetes[J].Diabetes,2003,52(4):1041 -1046.
[7]Kasper M,Funk RH.Age-related changes in cells and tissues due to advanced glycation end products(AGEs)[J].Arch Gerontol Geriatr,2001,32(3):233 -243.
[8]Murillo J,Wang Y,Xu X,et al.Advanced glycation of type I collagen and fibronectin modifies periodontal cell behavior[J].J Periodontal,2008 ,79(11):2190 -2199.
[9]Kim HS,Park JW,Yeo SI,et al.Effects of high glucose on cellular activity of periodontal ligament cells in vitro[J].Diabetes Res Clin Pract,2006,74:41 -47.
[10]Dutta J,Fan Y,Gupta N,et al.Current insights into the regulation of programmed cell death by NF- κB [J].Oncogene,2006,25(51):6800-6816.
[11]Bierhaus A,Schiekofer S,Schwaninger M,et al.Diabetes-associated sustained activation of the transcription factor NF-κB[J].Diabetes,2001,50(12):2792 -2809.
[12]Maczurek A,Shanmugam K,Munch G.Inflammation and the redox-sensitive AGE-RAGE pathway as a therapeutic target in Alzheimer’s disease [J].Ann NY Acad Sci,2008,1126(1):147-151.
[13]汪濤,房明,丁鰲,等.牙周基礎治療對Ⅱ型糖尿病伴牙周炎病人糖基化終產物的影響[J].牙體牙髓牙周病學雜志,2011,21(4):237 -239.

